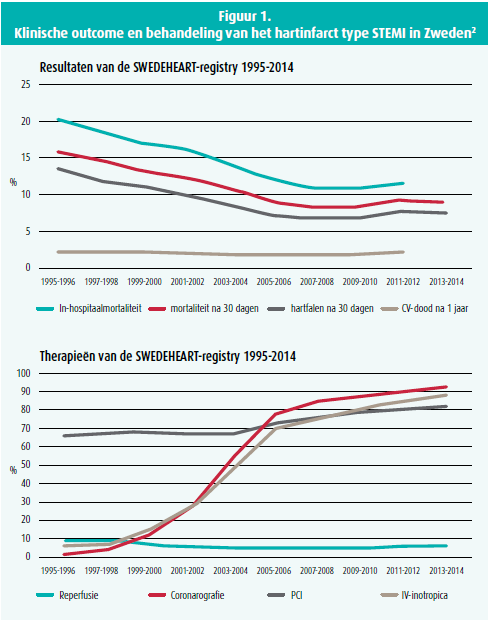
Snelle reperfusie door primaire PCI heeft geleid tot een indrukwekkende verbetering van de klinische outcome van het ST-elevatie-acutemyocardinfarct (STEMI): de in-hospitaalmortaliteit is gedaald van 45 % in de vroege CCU-era1 tot minder dan 10 %, zoals onlangs nog eens bevestigd werd door de resultaten van de SWEDEHEART-registry1, 2.
Door de spreiding van interventionele cathlabs die voor vijf jaar werd doorgevoerd, is België bedekt met een fijnmazig netwerk dat het mogelijk maakt de overgrote meerderheid van de patiënten met acute STEMI binnen een kort tijdsinterval met primaire PCI te behandelen (figuur 1).
Cardiogene shock met arteriële hypotensie (< 90 mmHg) en een lage cardiale index ondanks voldoende hoge vullingsdrukken die leidt tot multi-orgaanfalen, is een belangrijke acute verwikkeling van een acute STEMI. Alhoewel een vroege revascularisatie leidt tot een belangrijke daling van de vroege mortaliteit, blijft cardiogene shock de belangrijkste doodsoorzaak bij een acute STEMI met een mortaliteit die blijft hangen rond 40-50 % volgens een aantal recente registers en gerandomiseerde trials3.
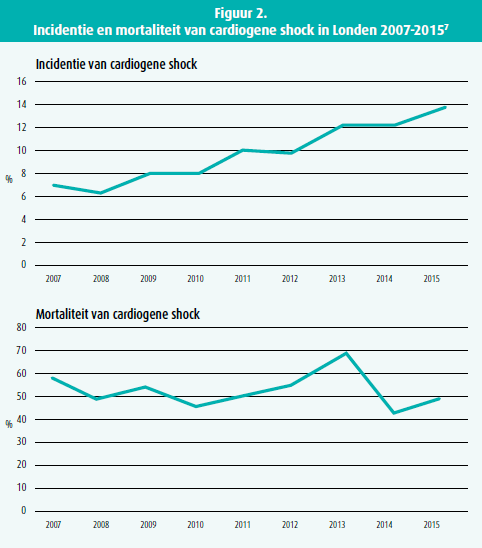
Ongeveer 5 tot 15 % van de patiënten met een STEMI vertoont bij opname of ontwikkelen tijdens hospitalisatie een cardiogene shock3. Ondanks de ontwikkeling en steeds betere organisatie van STEMI-netwerken die in het algemeen leiden tot een betere klinische uitkomst, noteren verschillende recente registers een progressieve toename van de incidentie van cardiogene shock4-7. Deze paradoxale toename is moeilijk te verklaren: aangezien het meestal over PCI-registers gaat, is deze toename mogelijk het gevolg van een selectiebias. Een andere verklaring is dat een betere organisatie van de extramurale urgentiediensten leiden tot een meer succesvolle opvang van de plotse cardiale dood. De patiënten die succesvol gereanimeerd werden van een plotse hartstilstand vertonen na het hervatten van de circulatie vaak een multi-orgaanfalen inclusief een vrij uitgebreide hartbeschadiging die leidt tot het ontwikkelenvan cardiogene shock. Mogelijk is een groter aantal plotsehartstilstandoverlevers verantwoordelijk voor de waargenomen progressieve stijging in de incidentie van cardiogene shock (figuur 2).
Om de stijgende incidentie en blijvend hoge mortaliteit van cardiogene shock op te vangen werd in een recent positieartikel van de American Heart Association gepleit voor de organisatie van regionale, gespecialiseerde cardiogeneshockcentra in de tertiaire ziekenhuizen met een grote ervaring in mechanische cardiale ondersteuning, zowel percutaan met extracorporele membraanoxygenatie (ECMO) of met intraluminele pomp tussen linkerventrikel en aorta (Impella®), als via implanteerbare LVAD's (Left Ventricle Assist Device)8. Deze centra beschikken best over mobiele ECMO-teams die deze behandelingstechniek kunnen installeren en opstarten in de hartkatheterisatiekamer, de spoeddienst en eventueel zelfs extramuraal. In het buitenland zijn voorbeelden te vinden waarbij deze mobiele teams het tertiaire centrum verlaten om in een perifeer ziekenhuis na succesvolle reanimatie een ECMO te installeren9.
Het lijkt beter de cardiogene shockpatiënten te centraliseren in grote centra: uit een recente analyse in de V.S. bleek dat de mortaliteit het laagste is in centra die minstens 108 cardiogeneshockpatiënten per jaar behandelen en die vaker gebruik maken van vroege revascularisatie en mechanische cardiale ondersteuning10. In hartcentra die minder dan 28 cardiogeneshockpatiënten per jaar behandelen is de mortaliteit 27 % hoger. Indien we deze bevindingen doortrekken naar de Belgische situatie dan betekent dit dat de opvang en behandeling van de cardiogeneshockpatiënten best gecentraliseerd wordt in 8 à 10 grote hartcentra met voldoende ervaring met mechanische cardiale ondersteuning, zowel met de percutane, als met chirurgisch implanteerbare systemen (figuur 3).
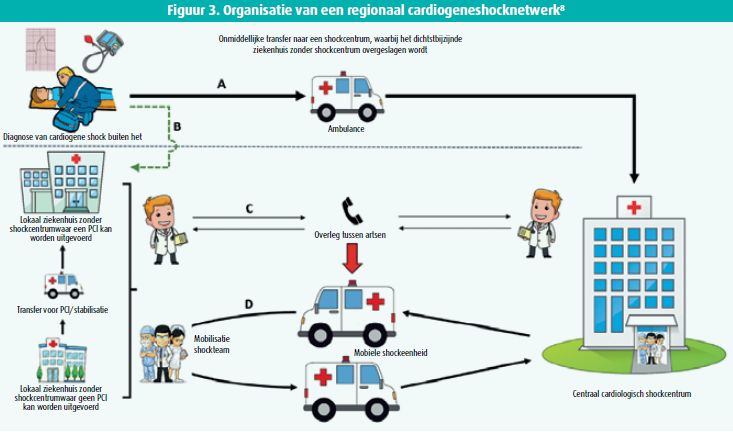
Alhoewel alle Belgische interventionele hartcentra met een geïsoleerd B1B2 cardiologisch zorgprogramma volgens de wettelijke normen beschikken over mechanische hartondersteuning door een intra-aortische ballonpomp (IABP) lijkt het niet opportuun de patiënten met cardiogene shock in al deze centra te behandelen. Vooreerst is IABP sedert de publicatie van de resultaten van de IABP-SHOCK II-trial volledig obsoleet geworden in de behandeling van cardiogene shock. Verder hebben de meeste van deze centra geen ervaring met ECMO en ook een te laag volume aan primaire PCI's om een kwaliteitsvol programma mechanische cardiale ondersteuning te organiseren (minimaal 270 primaire PCI's per jaar noodzakelijk). Ten slotte wordt de laagste mortaliteit ten gevolge van cardiogene shock genoteerd in die centra die in staat zijn de percutane mechanische hartondersteuning op te schalen door chirurgische implantatie van een LVAD in afwachting van harttransplantatie11. De behandeling van cardiogene shock wordt daarom het best georganiseerd in een breed (provinciebreed?) hospitaalnetwerk waarin optimaal 1000 primaire PCI's per jaar verricht worden en waarbij de patiënten met cardiogene shock voor mechanische hartondersteuning getransfereerd worden naar een centraal groot tertiair centrum met een volledig cardiologisch en cardiochirurgisch programma.
Het is evenwel nog veel te vroeg voor de oprichting van cardiogeneshocknetwerken in België: uit een recente meta-analyse bleek mechanische hartondersteuning door ECMO of een Impella-pomp bij hartinfarctpatiënten met cardiogene shock wel een gunstig effect te hebben op de arteriële bloeddruk en het lactaatgehalte, maar niet op de mortaliteit12.
Mechanische hartondersteuning met deze systemen ging gepaard met een tweemaal hogere incidentie van majeure bloedingen in vergelijking met een klassieke behandeling met een IABP. Mogelijk was deze verhoogde incidentie van bloedingen verantwoordelijk voor het uitblijven van enige mortaliteitsverbetering. Dit is het eerste editoriaal voor 2018, de 30ste jaargang van het Tijdschrift voor Cardiologie. Ter gelegenheid van deze bijzondere verjaardag werden de website en de lay-out van het tijdschrift grondig vernieuwd. De redactie dankt alle trouwe lezers en adverteerders en wenst iedereen een gelukkig en gezond Nieuwjaar!
Referenties
- Lüscher, T.F., Obeid, S. From Eisenhower's heart attack to modern management: a true success story! Eur Heart J, 2017, 38 (41), 3066-3069.
- Szummer, K., Wallentin, L., Lindhagen, L., Alfredsson, J., Erlinge, D., Held, C., James, S., Kellerth, T., et al. Improved outcomes in patients with ST-elevation myocardial infarction during the last 20 years are related to implementation of evidence-based treatments: experiences from the SWEDEHEART registry 1995-2014. Eur Heart J, 2017, 38 (41), 3056-3065.
- Thiele, H., Ohman, E.M., Desch, S., Eitel, I., de Waha, S. Management of cardiogenic shock, Eur Heart J, 2015, 36 (20), 1223-1230.
- Kolte, D., Khera, S., Aronow, W.S., Mujib, M., Palaniswamy, C., Sule, S., Jain, D., Gotsis, W. et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. JAMA, 2014, 3 (1):e000590.
- Kunadian, V., Qiu, W., Ludman, P., Redwood, S., Curzen, N., Stables, R., Gunn, J., Gershlick, A. Outcomes in Patients With Cardiogenic Shock Following Percutaneous Coronary Intervention in the Contemporary Era. An Analysis From the BCIS Database (British Cardiovascular Intervention Society), 2014, 7 (12), 1374-1385.
- Mandawat, A., Rao, S.V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions, 2017, 10 (5): :e004337.
- Krishnaraj, S.R., Sudheer, K., Iqbal, M.B., Ajay, K.J., Sundeep, S.K., Zoe, A., Pitt, L., et al. Contemporary trends in cardiogenic shock: Incidence, intra-aortic balloon pump utilisation and outcomes from the London Heart Attack Group. Eur Heart J: Acute Cardiovascular Care, 2017:2048872617741735.
- van Diepen, S., Katz, J.N., Albert, N.M., Henry, T.D., Jacobs, A.K., Kapur, N.K., Kilic, A., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation, 2017, 136 (16):e232-e68.
- Beurtheret, S., Mordant, P., Paoletti, X., Marijon, E., Celermajer, D.S., Léger, P., Pavie, A. et al. Emergency circulatory support in refractory cardiogenic shock patients in remote institutions: a pilot study (the cardiac-RESCUE program). Eur Heart J, 2013, 34 (2), 112-120.
- Shaefi, S., O'Gara, B., Kociol, R.D., Joynt, K., Mueller, A., Nizamuddin, J., Mahmood, E. et al. Effect of Cardiogenic Shock Hospital Volume on Mortality in Patients With Cardiogenic Shock. J Am Heart Assoc, 2015, 4 (1): e001462.
- Kalavrouziotis, D., Rodés-Cabau, J., Mohammadi, S. Moving Beyond SHOCK: New Paradigms in the Management of Acute Myocardial Infarction Complicated by Cardiogenic Shock. Can J Cardiol, 2017, 33 (1), 36-43.
- Thiele, H., Jobs, A., Ouweneel, D.M., Henriques, J.P.S., Seyfarth, M., Desch, S., Eitel, I., et al. Percutaneous short-term active mechanical support devices in cardiogenic shock: a systematic review and collaborative meta-analysis of randomized trials. Eur Heart J, 2017, 38 (47), 3523-3531.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.