ESC-congres 2020
Symposiumverslag
Dit jaar werd op het ESC-congres een sessie gewijd aan het belang van ijzerdeficiëntie in de hartfalenpopulatie. De sessie wordt ingeleid door Andrew Coats, huidige president van de ESC Heart Failure Association, waarbij de nadruk gelegd wordt op levenskwaliteit en functionele testing. In deel twee van de sessie worden de bestaande studies die de rol van IV-ijzer op levenskwaliteit bij hartfalenpatiënten bestudeerden, bekeken. Vervolgens wordt het effect van IV-ijzer op morbiditeit en mortaliteit en de studies die hierover verwacht worden gepresenteerd.
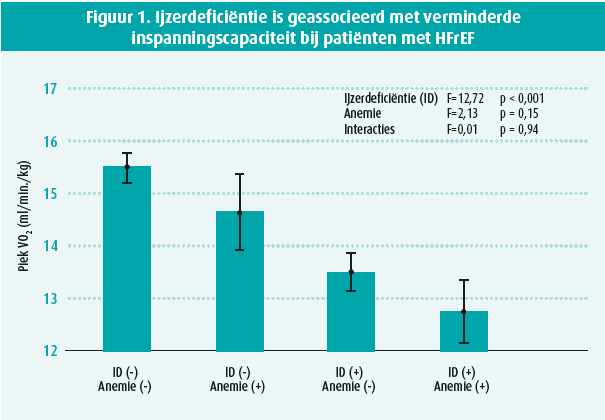
Hartfalen is een chronische ziekte waarbij de voorbije jaren, naast mortaliteitsreductie, de behandelfocus gericht wordt op het verbeteren van de levenskwaliteit van de patiënt. Als we de levenskwaliteit van onze hartfalenpopulatie willen verbeteren, mogen we ijzerdeficiëntie niet uit het oog verliezen. Ijzerdeficiëntie komt voor bij ongeveer de helft van de patiënten met hartfalen met verminderde ejectiefractie (HFrEF). Ijzerdeficiëntie wordt gedefinieerd als serumferritine < 100 mcg/l of ferritine 100-299 mcg/l in combinatie met een transferrinesaturatie < 20 %. Slechts in 33 % van de gevallen gaat dit gepaard met anemie.1 Toch wordt er ook bij deze patiënten een significante daling van de inspanningscapaciteit en levenskwaliteit gezien (figuur 1).2, 3 Dit wordt verklaard door een ijzerafhankelijke ATP-productie in de mitochondriën, een toename van de oxidatieve stress alsook een rechtstreeks inhiberend effect op de contractiliteit en relaxatie van de cardiomyocyt en de skeletspieren.4, 5 Hemoglobine is dus geen goede parameter om ijzerdeficiëntie bij uw hartfalenpatiënt op te sporen.
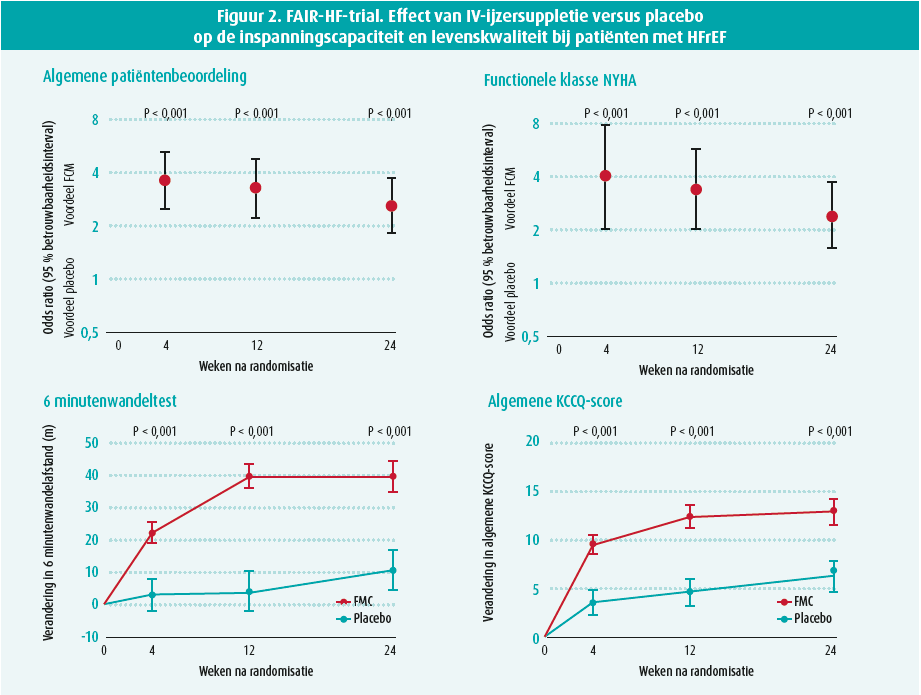
Vervolgens worden de studies overlopen die het effect van ijzersuppletie bestudeerden. De FAIR-HF-studie uit 2009 is een belangrijke studie die het belang van intraveneuze ijzersuppletie bij HFrEFpatiënten en ijzerdeficiëntie aantoont. 459 patiënten werden gerandomiseerd tussen toediening van 200 mg IV-ijzercarboxymaltose en placebo. 50 % van de behandelgroep rapporteerde zich globaal matig tot zelfs veel beter te voelen in vergelijking met slechts 28 % van de patiënten in de placebogroep (OR 2,51; CI 1,75-3,61). 47 % van de patiënten hadden 24 weken na toediening van IV-ijzer klachten compatibel met NYHA-klasse I - II, in vergelijking tot 30 % van de placebogroep (OR 2,40; CI 1,55-3,71). Er werd duidelijk beterschap gezien op de 6 minutenwandeltest en beoordeling van levenskwaliteit. Het effect hiervan werd zelfs al vroeg vastgesteld, namelijk vier weken na de eerste toediening. Deze resultaten waren gelijkaardig voor patiënten met of zonder anemie. (figuur 2)6
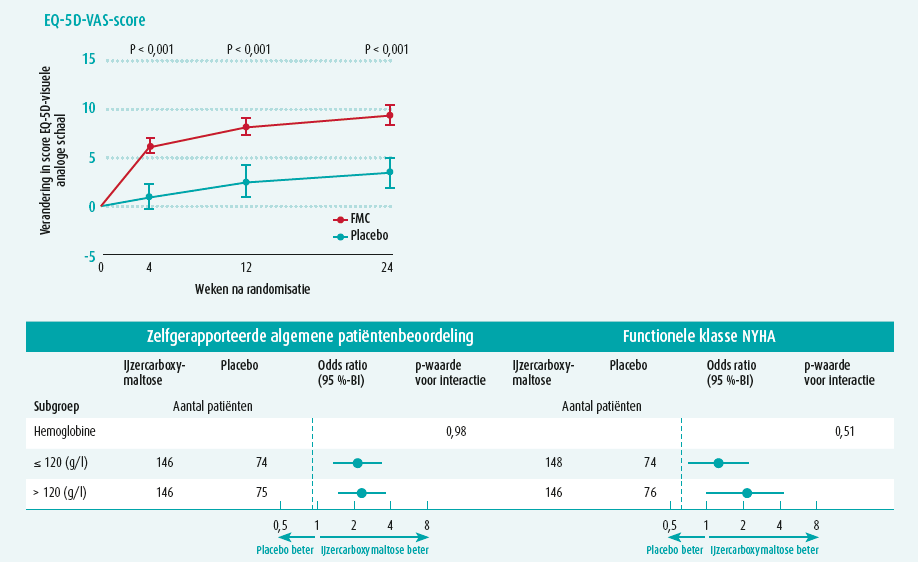
De CONFIRM-HF-trial in 2015 bevestigde deze resultaten en toonde aan dat deze gunstige effecten aanhielden tot 52 weken na toediening. Daarboven toonde deze ook voor het eerst aan dat behandeling met IV-ijzer geassocieerd was met een risicoreductie voor hartfalenhospitalisatie (HR 0,39; CI 0,19-0,82), naast de verbetering in levenskwaliteit.7
Op basis van de twee bovenstaande studies geldt in de huidige ESC-richtlijn voor hartfalen (2016) dat de toediening van IV-ijzer moet overwogen worden (klasse IIa-aanbeveling) bij HFrEF en ijzerdeficiëntie ter verbetering van symptomen, inspanningstolerantie en levenskwaliteit. Ewa Jankowska benadrukt dat in de praktijk IV-ijzersuppletie nog te vaak voorbehouden blijft voor HFrEF-patiënten met anemie in plaats van alle HFrEF-patiënten met ijzerdeficiëntie. Dit benadrukt het belang van routinematig opsporen van ijzerdeficiëntie (met o.a. serumferritine en transferrinesaturatie) bij de hartfalenpatiënt.
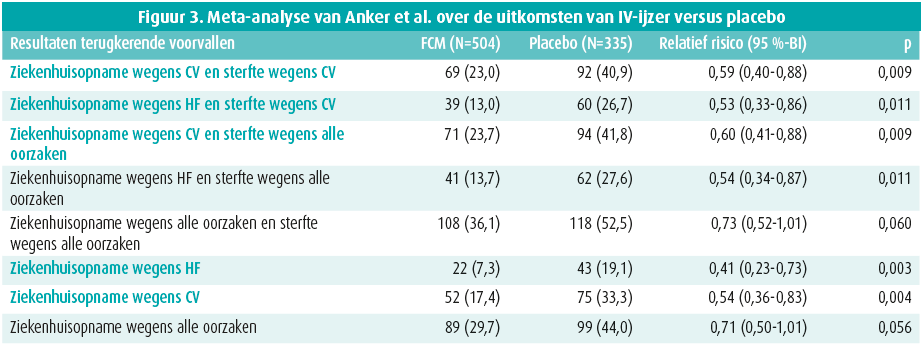
Op heden is er geen studie met voldoende bewijskracht die een gunstig effect van IV-ijzer op mortaliteit heeft kunnen aantonen. Een meta-analyse van Anker et al. in 2018 toont wel gunstige resultaten op een gecombineerd hard eindpunt van hospitalisaties en cardiovasculaire mortaliteit (figuur 3). Op heden zijn er drie grote gerandomiseerde studies lopende waar het effect van IV-ijzer op MACE (major cardiovascular adverse events) verder wordt bekeken bij chronisch hartfalenpatiënten.
Deze gunstige effecten worden niet bekomen door perorale substitutie van ijzer. Dit werd aangetoond in de IRONOUT HF-trial van 2017.10 Dit kadert in een verminderde opname van peroraal ijzer bij chronisch hartfalenpatiënten, aangezien ook ferritine en transferrinesaturatie niet verbeterden na perorale substitutie.
Naast de positieve effecten van IV-ijzer bij chronisch hartfalen zijn er ook enkele studies die aandacht vestigen op het effect hiervan bij acuut hartfalen. Een studie van Jankowska et al. in 2014 toont aan dat de 1 jaarmortaliteit van patiënten met acuut hartfalen en ijzerdeficiëntie significant gestegen is in vergelijking met patiënten met een normale ijzerstatus.11 Daarnaast is de kans op rehospitalisatie binnen de 30 dagen verhoogd bij deze patiënten (HR 1,72; CI 1,13-2,60).12 Om het effect van IV-ijzersubstitutie bij acuut hartfalen te evalueren is de AFFIRM-AHF-studie lopende, waarvan we op korte termijn de resultaten mogen verwachten.13 De sprekers hopen dat deze studie de doorbraak zal zijn naar correcte diagnose en behandeling van ijzerdeficiëntie, bij zowel acuut als chronisch hartfalen.
Deze ESC-sessie werd afgesloten met een interactieve discussie tussen de sprekers. Hierbij werd vooral gesproken over het gebrek van implementatie van bovenstaande data in de dagdagelijkse praktijk, ondanks de bestaande ESC-richtlijn. Daarvoor zijn enkele verklaringen. Ten eerste is de IV-toediening van ijzer nog niet opgenomen in het hartfalenbehandelingsalgoritme. Ten tweede is er terughoudendheid vanwege mogelijke bijwerkingen bij IV-toediening. De gezondheidswinst en veiligheid van IV-ijzercarboxymaltose werd echter herhaaldelijk en consequent in verschillende studies aangetoond, ook in ambulante setting. Als laatste factor is er de logistieke component, gezien nood tot intraveneuze toegang, waardoor nieuwe pathway (vaak via dagziekenhuis) moet aangemaakt worden. Gezien de meerwaarde naar levenskwaliteit moeten we deze factoren overwinnen om optimale zorg te kunnen bieden voor de hartfalenpatiënt.
Referenties
- Klip, I.T. et al. Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J, 2013, 165 (4), 575-582.e3.
- Jankowska, E.A. et al. Iron deficiency predicts impaired exercise capacity in patients with systolic chronic heart failure. J Card Fail, 2011, 17 (11), 899-906.
- Comín-Colet, J. et al. Iron deficiency is a key determinant of health-related quality of life in patients with chronic heart failure regardless of anaemia status. Eur J Heart Fail, 2013, 15 (10), 1164-72.
- Hoes, M.F. et al. Iron deficiency impairs contractility of human cardiomyocytes through decreased mitochondrial function. Eur J Heart Fail, 2018, 20 (5), 910-919.
- Charles-Edwards, G. et al. Effect of Iron Isomaltoside on Skeletal Muscle Energetics in Patients With Chronic Heart Failure and Iron Deficiency. Circulation, 2019, 139 (21), 2386- 2398.
- Anker, S.D. et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med, 2009, 361 (25), 2436-2448.
- Ponikowski, P. et al. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency†. Eur Heart J, 2015, 36 (11), 657-668.
- Ponikowski, P. et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail, 2016, 18 (8), 891-975.
- Anker, S.D. et al. Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data metaanalysis. Eur J Heart Fail, 2018, 20, 125-133.
- Lewis G.D. et al. Effect of Oral Iron Repletion on Exercise Capacity in Patients With Heart Failure With Reduced Ejection Fraction and Iron Deficiency: The IRONOUT HF Randomized Clinical Trial. JAMA, 2017, 317 (19), 1958-1966.
- Jankowska, E.A. et al. Iron deficiency defined as depleted iron stores accompanied by unmet cellular iron requirements identifies patients at the highest risk of death after an episode of acute heart failure. Eur Heart J, 2014, 35 (36), 2468-2476.
- Núñez, J. et al. Iron deficiency and risk of early readmission following a hospitalization for acute heart failure. Eur J Heart Fail, 2016, 18 (7), 798-802.
- Ponikowski, P. et al. Rationale and design of the AFFIRM-AHF trial: a randomised, doubleblind, placebo-controlled trial comparing the effect of intravenous ferric carboxymaltose on hospitalisations and mortality in iron-deficient patients admitted for acute heart failure. Eur J Heart Fail, 2019, 21 (12), 1651-1658.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.