BSC-sessieverslag - sessie 21
Op het recente 40ste Annual Congress of the Belgian Society of Cardiology vond een sessie plaats over recente hot topics binnen het domein van hartfalen. In het eerste deel werd de rol van ijzertherapie en de belangrijke AFFIRM-AHF-studie besproken. Daarna werd in het tweede deel de behandeling van hyperkaliëmie bij hartfalen toegelicht. Hierna volgt een verslag van deze sessie.
IJzertherapie bij hartfalen
Anne-Catherine Pouleur (Cliniques Universitaires Saint-Luc, Brussel)
IJzerdeficiëntie, gedefinieerd als een ferritine < 100 μg/dl of een ferritine 100- 299 μg/dl met een transferrinesaturatie < 20 %, is een vaak voorkomend probleem met een prevalentie van 30-50 % bij patiënten met chronisch hartfalen en 50-80 % bij patiënten met acuut hart falen1. Deze ijzerdeficiëntie is geasso cieerd met een verminderde in span ningscapaciteit, verminderde levenskwaliteit, een verhoogd risico op hospitalisatie, een toegenomen risico op mortaliteit en toegenomen gezond heidskosten. Het effect van ijzerdeficiëntie op de prognose is zowel aanwezig bij patiënten met anemie als bij diegenen zonder anemie. Het behandelen van ijzerdeficiëntie met per orale preparaten biedt echter geen verbetering op prognose op korte termijn2. Dit kan verklaard worden door de onderliggende pathofysiologie waarbij hartfalen via inflammatie en neuro hormonale activatie de intestinale absorptie van ijzer inhibeert1. Daarentegen werd de laatste jaren aangetoond dat behandeling van ijzerdeficiëntie met het intraveneuze (IV) preparaat ijzercarboxymaltose inspanningsdyspnee, inspanningscapaciteit en levenskwaliteit kan verbeteren bij patiënten met hartfalen met een verminderde linkerventrikelfunctie (HFrEF)3,4 en kreeg het ook een klasse IIa-aanbeveling in de recente Europese richtlijnen5. Of IV ijzercarboxymaltose ook het aantal hartfalenhospitalisaties en de mortaliteit kan verbeteren bij patiënten met HFrEF en ijzerdeficiëntie werd recent onderzocht in de AFFIRM-AHF studie6.
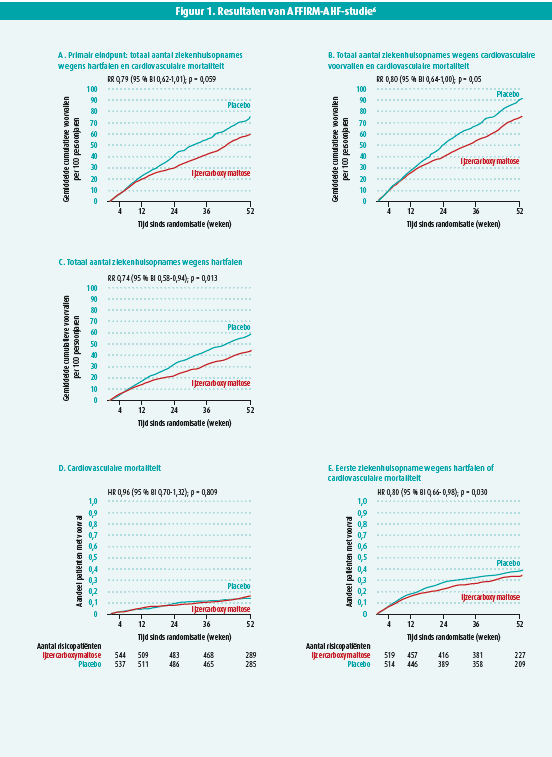
De AFFIRM-AHF-studie was een gerandomiseerde, dubbelblinde studie bij 1108 patiënten met een hartfalenhospitalisatie, een linkerventrikelejectiefractie (LVEF) < 50 %, ijzerdeficiëntie en onderzocht wat het effect was van ijzercarboxymaltose op een gecombineerd primair eindpunt van het totaal aantal hartfalenhospitalisaties en cardiovasculaire mortaliteit. De bestudeerde populatie had een hoog gebruik van hartfalenmedicatie, maar ook een hoog risico met een mediane NT-proBNP van ongeveer 4700 pg/ml Ongeveer de helft van de patiënten had ook anemie. Na één jaar was er een reductie in het primaire eindpunt met 21 % (73/100 personenjaren vs. 57/100 personenjaren), maar dit voldeed net niet aan de criteria van significantie (p = 0,059) (figuur 1). Daarnaast was er geen verschil in effect van het primaire eindpunt in verschillende subgroepen. De aanwezigheid van anemie, de LVEF, NT-proBNP titer, geslacht, nierfunctie, ferritine titer en transferrinesaturatie hadden geen invloed op het effect van ijzercarboxymaltose. Wanneer het primaire eindpunt opgesplitst werd in zijn verschillende onderdelen, was er wel een significante reductie in het totaal aantal hartfalenhospitalisatie met 26 % (43/100 personenjaren vs. 32/100 personenjaren), maar geen enkel effect op cardiovasculaire mortaliteit (16/100 personenjaren vs. 16/100 personenjaren). Het toedienen van ijzercarboxymaltose was veilig zonder een verschil in adverse events met de placebogroep. Vanwege het mogelijke effect van de COVID-19-pandemie op de resultaten, werd nog een sensitiviteitsanalyse uitgevoerd, waarbij alle patiënten al geïncludeerd waren, maar enkel de data voorafgaand aan de pandemie gebruikt werden. In deze sensitiviteitsanalyse was er wel een significante reductie van het primaire eindpunt van 25 %.
In de discussie na de presentatie werd de nadruk gelegd op het belang van screenen naar ijzerdeficiëntie in alle hartfalenpatiënten. Daarnaast is het belangrijk om ijzerdeficiëntie steeds intraveneus te behandelen.
Samengevat heeft de AFFIRM-AHF-studie voor het eerst aangetoond dat toedienen van IV ijzercarboxymaltose bij hoogrisicopatiënten met HFrEF en ijzerdeficiëntie het aantal hartfalenhospitalisaties met 26 % doet afnemen. Deze studie bevestigde dus de belangrijke rol van ijzerdeficiëntie en zijn behandeling binnen HFrEF.
Hyperkaliëmie bij hartfalen
Peter van der Meer (UMC Groningen, Nederland)
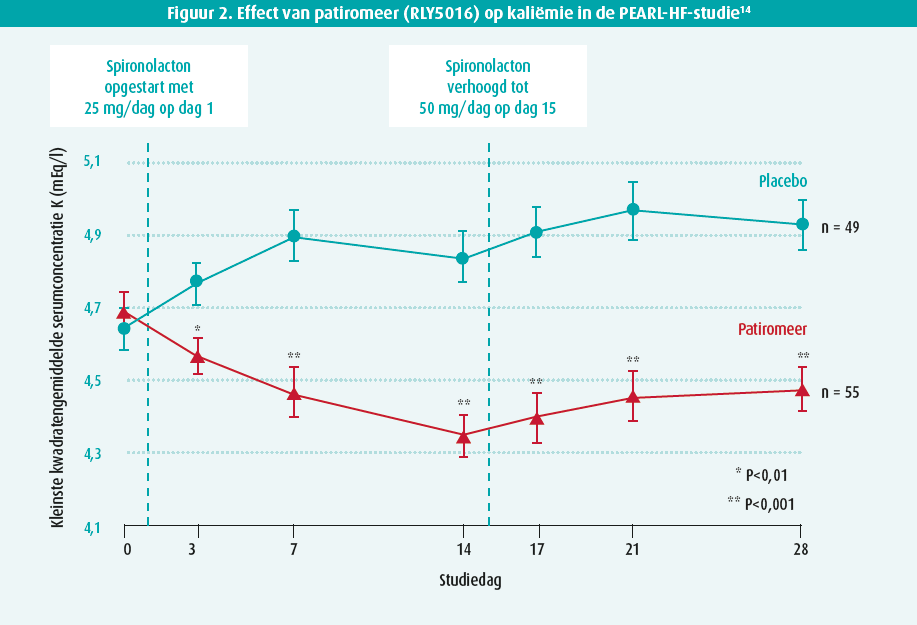
Hyperkaliëmie (> 5,5 mmol/l) komt frequent voor bij patiënten die behandeld worden met blokkers van het renineangiotensine- aldosteronsysteem (RAAS), die tot een van de hoekstenen van de hartfalentherapie behoren. Hoewel deze klassen van medicatie in meerdere studies hebben aangetoond dat ze de mortaliteit en de hartfalenhospitalisatie kunnen reduceren bij patiënten met HFrEF, wordt hun optitratie vaak bemoeilijkt door hyperkaliëmie. In recente studies waarbij ACE-inhibitoren en angiotensinereceptorblokkers (ARB) met mineralocorticoïdreceptorantagonisten (MRA) gecombineerd werden, trad hyperkaliëmie op in 12-16 % van de patiënten7-9. Verschillende factoren zijn geassocieerd met een verhoogd risico op hyperkaliëmie bij patiënten met hartfalen: hypertensie, hogere leeftijd, slechtere nierfunctie, diabetes, ernst van het hartfalen en medicatie zoals RAASinhibitoren10,11. Echter, hoewel hyperkaliëmie geassocieerd is met een hogere mortaliteit, blijft het mortaliteitsrisico lager in patiënten die behandeld worden met MRA vs. placebo12. Daarenboven hebben patiënten met een onvolledige optitratie van hun hartfalenmedicatie een hogere mortaliteit en remt hyperkaliëmie vaak de optitratie van RAAS-inhibitoren13. Recent kwamen nieuwe behandelingen voor hyperkaliëmie ter beschikking: patiromeer en natriumzirkoniumcyclosilicaat (ZS-9). Beide zijn ionenuitwisselaars die in de gastro-intestinale tractus calcium (patiromeer) en natrium (ZS-9) uitwisselen voor kalium. De vraag stelt zich of het behandelen van hyperkaliëmie met deze medicatie de optitratie van RAAS-inhibitoren zou kunnen faciliteren en zo eventueel de prognose van patiënten verbeteren. In de gerandomiseerde PEARL-HF-studie werd het gebruik van patiromeer reeds tien jaar geleden geëvalueerd in 104 hartfalenpatiënten met een voorgeschiedenis van hyperkaliëmie of een glomerulaire filtratie ratio (GFR) van < 60 ml/min/1,73 m² en kon aangetoond worden dat patiromeer de kaliumspiegels effectief kan doen dalen met -0,45 mEq/l14 (figuur 2). Opvallend genoeg werden bij patiënten die patiromeer kregen significant vaker de spironolactonedosis opgetitreerd tot 50 mg (91 % vs. 74 %). Er is tot op heden echter geen evidentie dat het gebruik van kaliumbinders de prognose kan verbeteren. Momenteel is de DIAMOND-studie (NCT03888066) aan het onderzoeken of patiromeer het gecombineerde eindpunt van cardiovasculaire hospitalisatie of cardiovasculaire mortaliteit kan verminderen bij patiënten bij 2400 HFrEFpatiënten met hyperkaliëmie (> 5 mmol) onder submaximale behandeling met RAAS-inhibitoren of die de afgelopen 12 maanden hyperkaliëmie gehad hebben waardoor de dosis RAAS-inhibitoren werd gereduceerd of gestopt. Alle patiënten zullen gedurende maximaal 12 weken patiromeer krijgen. Tijdens deze run-in periode zullen de RAAS-inhibitoren opgetitreerd worden tot de maximaal getolereerde dosis. Daarna zal via randomisatie bij de helft van de patiënten de patiromeer gestopt worden. Deze fase 3-studie is momenteel aan de gang in 439 centra wereldwijd en zal een antwoord kunnen geven op de rol van patiromeer binnen de behandeling van hartfalen.
In de discussie na de presentatie werd ingegaan op het belang van screening in de klinische praktijk. Momenteel worden ACE-inhibitoren, ARB's en MRA's vaak voorgeschreven zonder routine-opvolging van kaliëmie en nierfunctie, wat toch enige risico's inhoudt gezien de hoge prevalentie van hyperkaliëmie en de geassocieerde verhoogde mortaliteit. Daarom wordt bij het opstarten van RAASinhibitoren best steeds een opvolging van de kaliëmie in het verdere behandelplan vastgelegd.
Referenties
- Rocha, B.M.L., Cunha, G.J.L., Menezes Falcão, L.F. The Burden of Iron Deficiency in Heart Failure: Therapeutic Approach. J Am Coll Cardiol, 2018, 71 (7), 782-793.
- Lewis, G.D., Malhotra, R., Hernandez, A.F., McNulty, S.E., Smith, A., Michael Felker, G. et al. Effect of oral iron repletion on exercise capacity in patients with heart failure with reduced ejection fraction and iron deficiency the IRONOUT HF randomized clinical trial. JAMA, 2017, 317 (19), 1958-1966.
- Anker, S.D., Comin Colet, J., Filippatos, G., Willenheimer, R., Dickstein, K., Drexler, H. et al. Ferric Carboxymaltose in Patients with Heart Failure and Iron Deficiency. N Engl J Med, 2009, 361 (25), 2436-2448.
- Ponikowski, P., Van Veldhuisen, D.J., Comin-Colet, J., Ertl, G., Komajda, M., Mareev, V. et al. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J, 2015, 36 (11), 657- 668.
- Ponikowski, P., Voors, A.A., Anker, S.D., Bueno, H., Cleland, J.G.F., Coats, A.J.S. et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J, 2016, 37 (27), 2129-2200.
- Ponikowski, P., Kirwan, B.A., Anker, S.D., McDonagh, T., Dorobantu, M., Drozdz, J. et al. Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, double-blind, randomised, controlled trial. The Lancet, 2020, 396 (10266), 1895-1904.
- Pitt, B., Zannad, F., Remme, W.J., Cody, R., Castaigne, A., Perez, A. et al. The Effect of Spironolactone on Morbidity and Mortality in Patients with Severe Heart Failure. N Engl J Med, 1999, 341 (10), 709-717.
- Pitt, B., Remme, W., Zannad, F., Neaton, J., Martinez, F., Roniker, B. et al. Eplerenone, a Selective Aldosterone Blocker, in Patients with Left Ventricular Dysfunction after Myocardial Infarction. N Engl J Med, 2003, 348 (14), 1309-1321.
- Zannad, F., McMurray, J.J.V., Krum, H., van Veldhuisen, D.J., Swedberg, K., Shi, H. et al. Eplerenone in Patients with Systolic Heart Failure and Mild Symptoms. N Engl J Med, 2011, 364 (1), 11-21.
- Tromp, J., Van Der Meer, P. Hyperkalaemia: Aetiology, epidemiology, and clinical significance. Eur Hear J Suppl, 2019, 21, A6-11.
- Martens, P., Kooij, J., Maessen, L., Dauw, J., Dupont, M., Mullens, W. The importance of developing hyperkalaemia in heart failure during long-term follow-up. Acta Cardiol [Internet], 2020, 1-9. Available from: https:// doi.org/10.1080/00015385.2020.1748346
- Vardeny, O., Claggett, B., Anand, I., Rossignol, P., Desai, A.S., Zannad, F. et al. Incidence, predictors, and outcomes related to hypo- and hyperkalemia in patients with severe heart failure treated with a mineralocorticoid receptor antagonist. Circ Heart Fail. 2014, 7 (4), 573-579.
- Beusekamp, J.C., Tromp, J., van der Wal, H.H., Anker, S.D., Cleland, J.G., Dickstein, K. et al. Potassium and the use of renin- angiotensin-aldosterone system inhibitors in heart failure with reduced ejection fraction: data from BIOSTAT-CHF. Eur J Heart Fail, 2018, 20 (5), 923-930.
- Pitt, B., Anker, S.D., Bushinsky, D.A., Kitzman, D.W., Zannad, F., Huang, I.Z. Evaluation of the efficacy and safety of RLY5016, a polymeric potassium binder, in a double-blind, placebocontrolled study in patients with chronic heart failure (the PEARL-HF) trial. Eur Heart J, 2011, 32 (7), 820-828.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.