Een pseudo-aneurysma van het linkerventrikel, ook 'vals aneurysma' genoemd, komt zelden voor. Het ontstaat meestal na een scheur van het myocard die bijeengehouden wordt door pericardiale verklevingen. In tegenstelling tot een echt aneurysma heeft een vals aneurysma een rechte hals en bevat het geen myocardelementen. Het kan spontaan ontstaan of verworven zijn.
We rapporteren het geval van een volumineus pseudo-aneurysma van het linkerventrikel. De vaakst voorkomende oorzaak van die afwijking is een myocardinfarct. In zeldzamere gevallen kan de oorzaak echter ook traumatisch, iatrogeen of infectieus zijn. De diagnose is moeilijk te stellen aangezien het klinische beeld aspecifiek is en de cardiologische basisonderzoeken weinig gevoelig zijn. Als een CT-scan of MRI-scan de diagnose bevestigt, moet snel chirurgisch ingegrepen worden gezien het risico op ruptuur. Na de ingreep is de evolutie vaak gunstig.
Inleiding
Een pseudo-aneurysma van het linkerventrikel komt zelden voor. Het kan spontaan ontstaan of verworven zijn.
Dankzij de ontwikkeling van de coronarografie komen ventriculaire aneurysma's en pseudo-aneurysma's nog maar zelden voor na een infarct. Ze kunnen echter ook veroorzaakt worden door een ingreep op het hart, een trauma, een iatrogene interventie, een ontsteking of een infectie.1 De clinicus moet die complicaties goed kennen, want ze kunnen op een verschillende manier evolueren.
We rapporteren een zeldzaam geval van een volumineus pseudo-aneurysma van het linkerventrikel waarvan de oorzaak aanvankelijk onbekend was. Dankzij een snelle diagnose en een snelle en intensieve behandeling kon een fatale afloop echter vermeden worden.
Klinische casus
Een patiënte van 71 jaar met alleen hypertensie in de voorgeschiedenis komt op de dienst Spoedgevallen wegens een achteruitgang van de algemene toestand met lipothymie en inspanningsdyspneu zonder pijn in de borst.
Bij het klinisch onderzoek meten we een systolische hypotensie van 80 mmHg, een hartfrequentie van 66 slagen per minuut, een saturatie van 86 % op de pulsoxymeter bij omgevingslucht en een lichaamstemperatuur van 37,9 °C.
Het bloedbeeld toont een inflammatoir syndroom met een CRP van 70 mg/l en een hyperleukocytose van 24 950/mm3, de hartenzymen zijn verhoogd met een hoogsensitief-troponine I van 45 ng/l (norm < 39).
Het ecg toont een sinusritme zonder repolarisatiestoornissen. Op de CT-scan van de thorax is een bilaterale pleuravochtuitstorting te zien, evenals een pericarduitstorting van 15 mm dik achter het linkerventrikel (LV), met een risico op tamponnade.
Het onderzoek wordt snel aangevuld met een transthoracale echocardiografie, en die bevestigt de aanwezigheid van een compressieve pericarduitstorting van 17 mm tegenover de onderzijwand van het linkerventrikel, met een bewaarde ejectiefractie van het linkerventrikel van > 55 %.
Gezien het klinische beeld van cardiogene shock met tamponnade wordt een chirurgische drainage uitgevoerd via de subxyfoïdale toegangspoort, waarbij 300 ml sereuze vloeistof verwijderd wordt. De analyse van het vocht strookt met een virale oorzaak, maar de kiem kan niet geïdentificeerd worden.
Initieel is de klinische en hemodynamische evolutie gunstig: de postoperatieve transthoracale echocardiografie toont een bewaarde linkerventrikelfunctie en er kan geen residuele pericarduitstorting aangetoond worden. Na een opname van een week kan de patiënte weer naar huis. Twee maanden later komt de patiënte opnieuw binnen op de dienst Spoedgevallen met dyspneu en pijn in de borstkas.
Bij klinisch onderzoek is de patiënte hemodynamisch stabiel, met een systolische bloeddruk van 134 mmHg, een hartslag van 70 slagen per minuut en een zuurstofsaturatie van 90 % op de pulsoxymeter bij omgevingslucht.
Het ecg toont een sinusritme van 74 slagen per minuut, een bifasische P-top in de inferolaterale afleidingen, een volledig rechterbundeltakblok en een bifasische T-top in de hoge laterale afleidingen. Er wordt geen acute repolarisatiestoornis gezien.
Gezien de recente klinische voorgeschiedenis wordt met hoogdringendheid een transthoracale echocardiografie met dopplermeting uitgevoerd. Op basis van dat onderzoek bestaat er een sterk vermoeden van een pseudo-aneurysma van de laterale wand van het linkerventrikel. De wand van het myocard lijkt over 20 mm gescheurd te zijn (kraag), met op het doppleronderzoek uitstroom van de flow in de holte van het pseudo-aneurysma, dat een volume van meer dan 35 cm2 heeft. Die structuur strekt zich uit naar de pleuraholte, met een tegenoverliggende gesegmenteerde pleuravochtuitstorting links. Er is geen significant recidief van de pericarduitstorting en er zijn geen klinische argumenten voor tamponnade of shock (figuur 3).
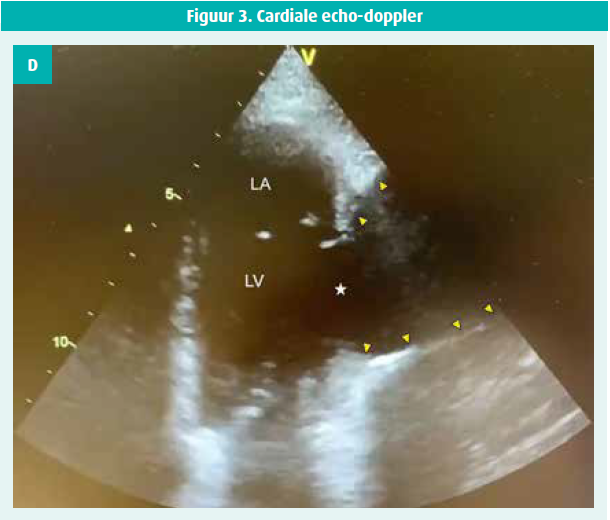
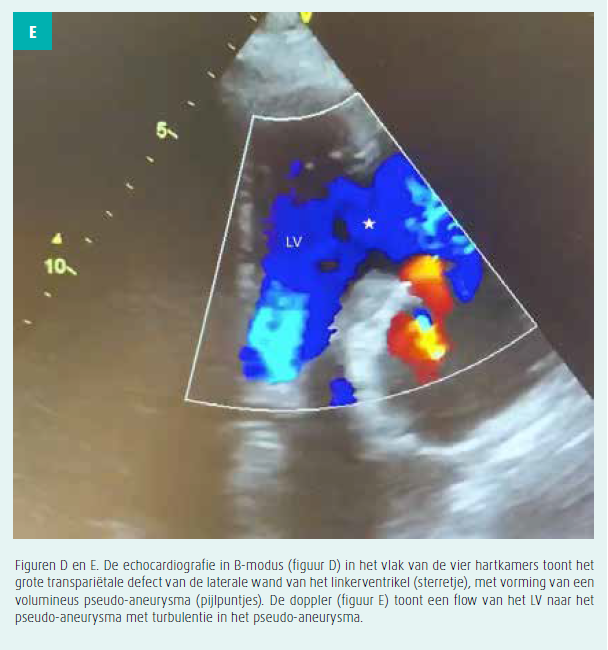
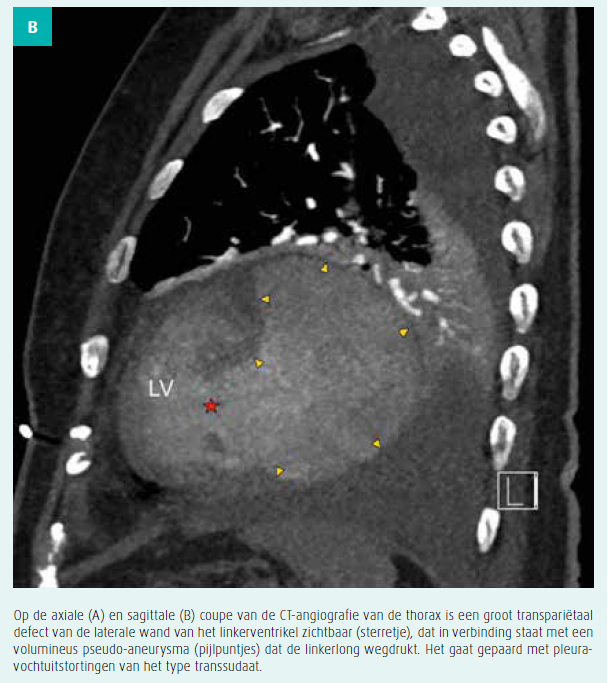
Het onderzoek wordt aangevuld met een CT-scan van de thorax die de diagnose bevestigt en een volumineuze pseudoaneurysma- holte van 11 cm diameter toont die in verbinding staat met een posterieur-pariëtale opening van 35 mm (lange as), en bilaterale pleuravochtuitstortingen (figuur 1). Op dat moment is nog niet duidelijk wat het pseudoaneurysma veroorzaakt heeft.

Er wordt uitgegaan van de hypothese van een verworven pseudo-aneurysma dat is opgetreden ten gevolge van de chirurgische pericarddrainage. Op dat moment kan de vorming van een postischemisch pseudo-aneurysma, wat vaker voorkomt, echter niet formeel uitgesloten worden.
Gezien het aanzienlijke risico op ruptuur met levensbedreigende gevolgen gebeurt er een dringende chirurgische ingreep. Daarbij wordt het defect via een mediane sternotomie onder extracorporele circulatie gesloten met een boviene pericardpatch. Na de ingreep treden er op de intensieve zorg geen complicaties op en is de evolutie gunstig. Ter controle wordt daarom een transthoracale echocardiografie uitgevoerd, die een laterale hypokinesie en een inferolaterale akinesie aan het licht brengt. De geschatte linkerventriculaire ejectiefractie is matig verlaagd (45 %), en de patch is intact.
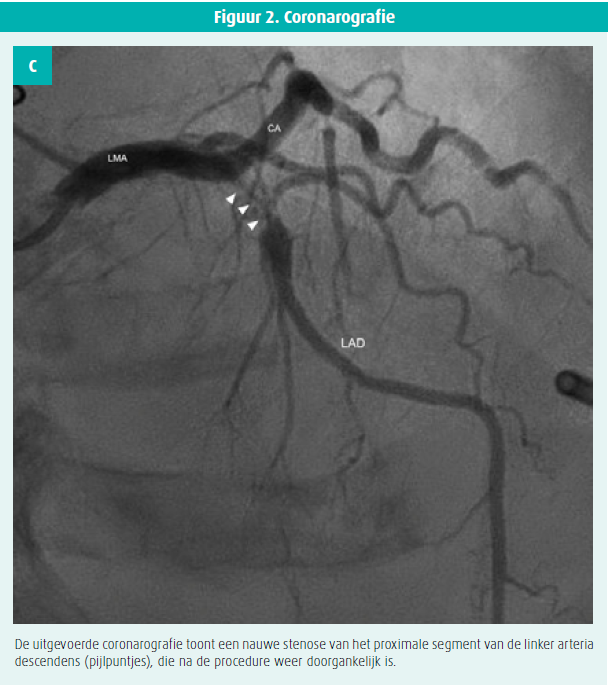
Het onderzoek wordt aangevuld met een coronarografie die een kritiek, subocclusief letsel in het proximale deel van de linker arteria descendens aantoont. Er wordt een angioplastiek met plaatsing van een DES-stent uitgevoerd, die succesvol is. Na een maand revalidatie is de evolutie gunstig en kan de patiënte ontslagen worden.
Bespreking
Een pseudo-aneurysma van het linkerventrikel of 'vals aneurysma' is een zeldzame paracardiale bloedholte die zich vormt als een scheur in het myocard bijeengehouden wordt door het tegenliggende pericard of littekenweefsel. In tegenstelling tot een echt aneurysma, waarvan de wand alle elementen bevat, bevat het pseudo-aneurysma endocard noch myocard.1, 2 Het treedt het vaakst op in de achter- of onderwand, en zeldzamer in de laterale of voorwand.
De patiënten klagen vaak over pijn in de borst, dyspneu, of vertonen hartfalen. Als de scheur niet volledig ingedamd is of als een voordien ingedamd pseudo-aneurysma scheurt, dan kan de patiënt een tamponnade, een cardiogene shock of een plotse dood vertonen. Ook embolie en aritmie komt niet zelden voor. In 10 % van de gevallen vertoont de patiënt helemaal geen symptomen.3, 4
De diagnose van een ventriculair pseudo-aneurysma is niet eenvoudig te stellen. Deze zeldzame aandoening wordt vaak gemist door clinici, terwijl de cardiale complicaties die het veroorzaakt levensbedreigend kunnen zijn voor de patiënt.5
Het klinisch beeld is vaak atypisch of aspecifiek, zoals ook uit onze casus blijkt, en de resultaten van de onderzoeken die in eerste instantie uitgevoerd worden - het ecg en de transthoracale echocardiografie - zijn vaak bedrieglijk omdat ze niet gevoelig en specifiek genoeg zijn om deze aandoening vast te stellen.5
Pseudo-aneurysmata van het linkerventrikel worden meestal veroorzaakt door ischemie die de myocardwand verzwakt, zodat die scheurt. Het pseudo-aneurysma wordt dan ingedamd door het pericard. Het vormt een complicatie bij minder dan 0,1 % van de myocardinfarcten en zonder chirurgische ingreep bedraagt de mortaliteit 50 %. Het kan echter ook veroorzaakt worden door een chirurgische ingreep op het hart (33 %), een procedure (drainage van het pericard of de pleura) (3 %), een thoraxtrauma (7 %), een infectie (5 %) of een combinatie van processen. Niet-coronaire oorzaken worden vaker gezien bij jonge mensen.6
In het gerapporteerde geval kan de iatrogene procedure (chirurgische drainage van het pericard via de subxyfoïdale toegangspoort) doen vermoeden dat de oorzaak lag in een mogelijke iatrogene scheur van het myocard (post-punctie), die een open fissuur gecreëerd zou hebben die zich vervolgens omgevormd heeft tot een pseudo-aneurysma.
Er zijn inderdaad enkele zeldzame gevallen beschreven in de literatuur waarbij een drainage van het pericard - ongeacht of die transcutaan of chirurgisch uitgevoerd wordt - aanleiding gegeven heeft tot complicaties, zoals punctie van de hartholtes, een scheur van het myocard, een letsel van een kransslagader, aritmie, pneumothorax of pneumopericard.7
Een andere mogelijke hypothese is dat de patiënte in de nasleep van de pericarddrainage een myocardinfarct gekregen heeft dat niet vastgesteld werd. Op de coronarografie was immers een kritiek letsel van de linker arteria descendens zichtbaar, dat vervolgens behandeld werd. Er is inderdaad aangetoond dat een chirurgische ingreep cardiovasculaire complicaties zoals myocardischemie kan bevorderen als gevolg van de psychische stress, de hemodynamische variaties (tachycardie, hypertensie enz.) die de behoefte aan zuurstof (O2) van het myocard verhogen en de protrombotische status.8, 9
De analyse van het pericardvocht wees ook op een virale oorsprong. Aangezien infectie ook tot een protrombotische status leidt, is het mogelijk dat de patiënte een stil infarct doorgemaakt heeft. Waarschijnlijk is het de combinatie van al die factoren die tot de vorming van een pseudo-aneurysma van de linkerventrikel geleid heeft.
Een literatuuroverzicht toont aan dat met een angiografie en meer bepaald een ventriculografie in 85 % van de gevallen de diagnose gesteld kan worden, met slechts 2 % valsnegatieven. Dat blijft echter een invasieve techniek.10
Een transthoracale echografie is een minder invasieve en minder dure techniek. De zwakke punten ervan zijn dat deze operator-afhankelijk is en niet altijd in optimale omstandigheden uitgevoerd kan worden. Het is het onderzoek dat meestal het eerst uitgevoerd wordt, maar is minder gevoelig voor de opsporing van pseudo-aneurysmata.10, 11
Met een CT-scan met 3D-reconstructie kan de diagnose op een betrouwbare manier gesteld worden. Soms is dat beeldvormingsonderzoek echter niet precies genoeg om de weefsels te onderscheiden. Als een MRI-scan uitgevoerd kan worden en daar geen contra-indicaties voor bestaan, kan die aanzienlijk bijdragen tot de diagnose. Een late aankleuring na toediening van gadolinium is een specifieke marker voor myocardfibrose, en maakt het mogelijk echte van valse aneurysmata te onderscheiden.10
De diagnose van een vals aneurysma blijft een formele indicatie voor een chirurgische ingreep, want het risico op ruptuur is hoger dan bij een echt aneurysma. In het gerapporteerde geval heeft de compressie door de gesegmenteerde pleuravochtuitstorting links de scheuring van het aneurysma waarschijnlijk vertraagd, en zo een vroegtijdige fatale afloop bij onze patiënte vermeden.3
Er zijn meerdere chirurgische ingrepen mogelijk. Bij degene die het vaakst uitgevoerd wordt, wordt het defect gesloten met een patch van bovien pericard. De ingreep gebeurt via een mediane sternotomie, onder extracorporele circulatie. Na de ingreep is het verloop vaak gunstig.12 Onbehandelde pseudo-aneurysmata kunnen complicaties veroorzaken zoals ruptuur, trombo-embolie, compressie van de aangrenzende structuren, infectie, aritmie of daling van het hartdebiet.
Conclusie
Een ventriculair pseudo-aneurysma is een zeldzame maar klinisch belangrijke complicatie van myocardinfarct. Ze kan ook andere, minder klassieke oorzaken hebben. Uit het gerapporteerde geval blijkt dat de aandoening uiteenlopende oorzaken kan hebben en dat het moeilijk is om een vroege diagnose te stellen omdat het initiële cardiologische onderzoek onterecht geruststellend kan zijn. Deze aandoening heeft een slechte prognose en het klinische beeld is weinig specifiek. Ze moet snel en intensief behandeld worden gezien het hoge risico op ruptuur en mortaliteit.
Hoewel het vaak moeilijk is om ze vroegtijdig vast te stellen, kan de vooruitgang in de niet-invasieve beeldvorming de behandeling en prognose van deze aandoening verbeteren.
Referenties
- Al-Attar, N., Alkhoder, S., Bourguignon, T. Raffoul, R., Nataf, P. Anévrisme postinfarctus du ventricule gauche masqué par une péricardite. La Lettre du Cardiologue, 2011, 449.
- Numéro Spécial. L'odyssée de la cardiologie interventionnelle. Rev Med Liege, 2019, 74, 1-114.
- Yeo, T.C., Malouf, J.F., Oh, J.K., Seward, J.B. Clinical profile and outcome in 52 patients with cardiac pseudoaneurysm. Ann Intern Med, 1998, 128 (4), 299-305.
- Cho, M.N., Mehta, S.K., Matulevicius, S., Weinstein, D., Wait, M.A., McGuire, D.K. et al. Differentiating true versus pseudo left ventricular aneurysm: a case report and review of diagnostic strategies. Cardiol Rev, 2006, 14 (6), 27-30.
- Singh, S., Puri, A., Narain, V., Sahni, V. Posttraumatic left ventricular pseudoanevrysm. Interact Cardiovasc Thorac Surg, 2012, 14 (3), 359.
- Ndiaye, M.B., Ba, F.G., Bodian, M., Diao, M., Kane, A.D. et al. Sarr. Faux anévrisme du ventricule gauche du sujet jeune : à propos de trois cas, Ann Cardiol Angeiol, 2015, 64 (4), 300-304.
- Ropraz, N., Bonjour, T., Roumy, A. Un drainage péricardique qui tourne mal Syndrome de décompression péricardique. Swiss Med Forum, 2020, 20 (4546), 658-660.
- Piriou, V. Perioperative myocardial infarction. Prat Anesth Reanim, 2014, 18 (2), 85-91.
- Lemasle, L., Gayat, E. Nouveautés dans la prise en charge cardiovasculaire en période périopératoire. Réanimation, 2014, 23, 202-210.
- Miandrisoa, R.M., Randriamihangy, N.A. Pseudoaneurysm of the left ventricle and difficulties of management through a case, Rev Anesth Réanim Med Urg Toxicol, 2018, 10 (1), 11-13.
- Zoffoli, G., Mangino, D., Venturini, A. et al. Diagnosing left ventricular aneurysm from pseudo-aneurysm: a case report and a review in literature. J Cardiothorac Surg, 2009, 4, 11.
- Abdallah, H., Farhat, F., Jegaden, O. Pseudoanévrysme du ventricule gauche post infarctus du myocarde, étiologie, diagnostic, prise en charge. Cardiologie Cardinale, 2011, 39 (5), 186-188.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.