BSC-congresverslag - S17
Welk device kiezen voor bejaarde patiënten?
Jens Cosedis Nielsen - Aarhus, Denemarken
Jens Cosedis Nielsen heeft een uiteenzetting gegeven over de belangrijkste gegevens over pacemakers, defibrillatoren in de primaire en secundaire preventie en resynchroniserende pacemakers bij oudere patiënten. Daarbij heeft hij bijzondere aandacht geschonken aan de keuze tussen een CRT-D en een CRT-P.
Pacemaker
Het Deense register van pacemakers en defibrillatoren publiceert regelmatig statistieken over inplanting van deze devices in de Deense bevolking.1 Het rapport van 2020 bevat een histogram van de frequentie van inplanting van de verschillende soorten pacemaker (AAI, VVI, DDD en CRT-P) per leeftijdsgroep. Er worden vooral DDD-pacemakers ingeplant en vooral bij 70-plussers. De meeste patiënten bij wie een pacemaker geplaatst wordt, zijn dus oud. In 2020 was 65,8 % van de patiënten in Denemarken ouder dan 75 jaar bij inplanting van een eerste pacemaker en was 42,8 % ouder dan 80 jaar. Een pacemaker is dus vooral een behandeling voor oude patiënten.
De UKPACE-studie heeft twee methoden van pacing bij bejaarde patiënten met een hooggradig atrioventriculair (AV) blok vergeleken.2 In die gerandomiseerde, gecontroleerde studie is bij 2 021 patiënten ouder dan 70 jaar bij wie een pacemaker moest worden ingeplant wegens een hooggradig AV blok, een eenkamerpacemaker (VVI-modus, n = 1 009) of een tweekamerpacemaker (DDD-modus, n = 1 012) geplaatst. 75 % van de patiënten was van het mannelijke geslacht. Ongeveer 75 % vertoonde een volledig AV blok en 25 % een tweedegraads AV blok. Tijdens de eerste vijf jaar na de inplanting is er geen verschil in totale sterfte en cardiovasculaire sterfte vastgesteld. De eerste drie jaar na de inplanting is evenmin een verschil vastgesteld in de incidentie van atriumfibrillatie, hartfalen, CVA/TIA of andere trombo-embolische accidenten. Er zijn echter vaker complicaties als gevolg van de procedure opgetreden na inplanting van een tweekamerpacemaker dan na inplanting van een eenkamerpacemaker (7,8 versus 3,5 %, p < 0,001) en ook is vaker opnieuw ingegrepen na plaatsing van een tweekamerpacemaker (4,2 % versus 2,5 %, p < 0,04). Bij bejaarde patiënten met een hooggradig AV blok heeft de wijze van pacing dus geen invloed op de sterfte of de incidentie van cardiovasculaire accidenten na inplanting.
De DANPACE-studie heeft 1 415 patiënten met een ziekesinusknoopssyndroom die waren verwezen voor inplanting van een pacemaker gerandomiseerd naar een atriale eenkamerpacemaker (AAIR-modus) of een tweekamerpacemaker (DDDR-modus).3 De gemiddelde leeftijd van de patiënten was 73 jaar. Na een gemiddelde follow-up van 5,4 jaar is er geen verschil in de totale sterfte vastgesteld tussen de twee groepen. De AAIR-modus correleerde echter met een hogere incidentie van atriumfibrillatie en een hogere frequentie van heringreep. Bij een subgroepanalyse volgens de leeftijd is bij de oudste patiënten (ouder dan 75 jaar) geen verschil in sterfte of incidentie van atriumfibrillatie vastgesteld tussen de twee methoden. In de AAIR-groep was het risico op atriumfibrillatie hoger bij de patiënten jonger dan 75 jaar.
Er is weinig onderzoek naar pacing zonder elektrode en pacing van het geleidingsstelsel uitgevoerd bij bejaarden terwijl zij evenwel het meeste baat vinden bij die technieken.
De richtlijnen van de Europese Vereniging voor Cardiologie die in 2021 gepubliceerd zijn, stellen een evaluatie voor bij alle patiënten ongeacht de leeftijd vóór inplanting van een pacemaker.4 Die evaluatie omvat een anamnese van de symptomen en de klinische geschiedenis (antecedenten, cardiovasculair risico, familiaire voorgeschiedenis, medische behandeling), een klinisch onderzoek, een ecg en beeldvorming van het hart (hoofdzakelijk echocardiografie). Beeldvorming van het hart wordt aanbevolen (klasse IC) bij patiënten met een vermoeden van of bewezen symptomatische bradycardie om structurele letsels op te sporen, de linkerventrikelfunctie te meten en mogelijke oorzaken van geleidingsstoornissen te diagnosticeren. Multimodale beeldvorming (MRI, CT-scan of PET-scan) zou moeten worden overwogen (IIa, C) om het myocardweefsel te onderzoeken bij de diagnose van specifieke aandoeningen die gepaard gaan met afwijkingen van het geleidingssysteem, vooral bij patiënten jonger dan 60 jaar. Bij fragiele bejaarde patiënten met een syncope en een bifasciculair blok wordt aangeraden (klasse IIa, B) om empirisch een pacemaker in te planten in plaats van andere onderzoeken, zoals een elektrofysiologisch onderzoek, uit te voeren.
Samengevat: een pacemaker wordt vooral ingeplant bij bejaarde patiënten. Bij de keuze van de pacemakermodus moet rekening worden gehouden met de richtlijnen en het klinische oordeel van de arts. Bij oudere patiënten met een hooggradig AV blok geniet een eenkamerpacemaker in VVIR-modus de voorkeur op een tweekamerpacemaker in DDDR-modus. Het risico op complicaties is dan kleiner en het effect op de sterfte is hetzelfde. Empirische inplanting van een pacemaker kan worden overwogen bij fragiele bejaarden met een syncope en een bifasciculair blok.
Defibrillator
Het Deense register van inplanting van een device geeft ook een overzicht van de distributie van defibrillatoren volgens de leeftijd. Die verschilt van de distributie van pacemakers.1 Defibrillatoren worden vooral ingeplant tussen de leeftijd van 55 en 75 jaar, met een piek rond 65 jaar. In 2020 was 16,2 % van de patiënten in Denemarken ouder dan 75 jaar bij inplanting van een eerste defibrillator en was slechts 4,1 % van de patiënten ouder dan 80 jaar. Een defibrillator maakt dus ook deel uit van het therapeutisch arsenaal bij oudere patiënten, maar minder bij hoogbejaarde patiënten.
In een prospectieve studie van het effect van inplanting van een defibrillator in de primaire en de secundaire preventie op de sterfte bij 5 399 patiënten (3 939 in de primaire preventie en 1 460 in de secundaire preventie)5 waren 7 % van de patiënten in de primaire preventiegroep en 11 % van de patiënten in de secundaire preventiegroep ouder dan 80 jaar. In geen van beide groepen was er een verschil in het aantal gepaste schokken volgens de leeftijd van de patiënt. Het aantal afgeleverde schokken was evenwel hoger in de secundaire preventie. De sterfte steeg significant met en in verhouding tot de leeftijd op het ogenblik van inplanting. De leeftijd predisponeert dus niet tot een hoger aantal ongepaste ontladingen, maar heeft wel een belangrijke invloed op de sterfte. Oude patiënten kunnen evenveel baat vinden bij een geschikte behandeling, maar bij die patiënten moet stelselmatig worden gezocht naar comorbiditeiten verhogen immers het risico op overlijden aan andere oorzaken dan ritmestoornissen.
De DANISH-studie heeft de gunstige effecten van inplanting van een defibrillator op de sterfte in de primaire preventie onderzocht bij 556 patiënten met een niet-ischemisch systolisch hartfalen.6 De overleving was niet beter na inplanting van een defibrillator. Bij een subgroepanalyse is een verschil in sterfte vastgesteld volgens de leeftijd. Bij de patiënten jonger dan 70 jaar was de sterfte lager dan bij de standaardbehandeling (HR 0,70, 95 % BI 0,51 - 0,96, p = 0,03). Dat verschil is niet teruggevonden bij de patiënten ouder dan 70 jaar (HR 1,05, 95 % BI 0,68 - 1,62, p = 0,84). Bij een tweede analyse van die studie is het verband tussen inplanting van een defibrillator en de sterfte per leeftijdsgroep en de doodsoorzaak (plotselinge versus niet-plotselinge dood) geëvalueerd.7 De incidentie van niet-plotselinge dood daalde minder bij bejaarde dan bij jonge patiënten. Het overlijdensrisico hangt dus sterk af van de leeftijd. Bij die tweede analyse is vastgesteld dat de correlatie tussen de overleving en inplanting van een defibrillator lineair afneemt met de leeftijd. Na de leeftijd van 70 jaar is er geen verschil in overleving meer vastgesteld. De oudste patiënten stierven dus vaker een niet-plotselinge dood dan de jonge patiënten. Dat kan verklaren waarom een verschil in overleving hoofdzakelijk wordt teruggevonden bij patiënten jonger dan 70 jaar.
De Charlson Comorbidity Index-score (CCI-score) is een eenvoudige, gestandaardiseerde score die gebruikt wordt om de sterfte volgens de comorbiditeiten bij verschillende aandoeningen te voorspellen. Een retrospectieve studie heeft de waarde van de CCI-score vóór inplanting van een defibrillator bij het voorspellen van het effect op de overleving en het afleveren van ongepaste schokken bij 75-plussers geëvalueerd.8 De score is gebaseerd op de leeftijd, een voorgeschiedenis van myocardinfarct, hartfalen, perifeer arterieel lijden, CVA of TIA, dementie, COPD, een bindweefselziekte, een maag- of duodenumulcus, leverlijden (cirrose), diabetes, hemiplegie, een vaste tumor (plaatselijk of gemetastaseerd), leukemie of lymfoom en hiv-infectie. De studie is uitgevoerd bij 121 75-plussers en 242 jongere controlepersonen (van gemiddeld 66 jaar) na matching voor het geslacht, het type preventie (primaire of secundaire preventie) en het type toestel (met of zonder resynchronisatietherapie). De patiënten werden volgens de CCI-score in drie groepen ingedeeld (0-1, 2-3 of ≥ 4 punten). De 5 jaarsoverleving was 78 % bij de 75-plussers met een CCI-score van 0-1, 57 % in geval van een CCI-score van 2-3 en 29 % in geval van een CCI-score ≥ 4 punten. Er was geen significant verschil in geschikte behandeling tussen de drie subgroepen. De mediane potentiële winst in levensverwachting na een geschikte behandeling was respectievelijk meer dan 5 jaar, 4,7 jaar en 1,4 jaar. De overleving na inplanting van een defibrillator was dus minder goed bij de patiënten met een CCI-score van ≥ 4 en de winst in overleving was klein in geval van een geschikte plaatsing van een defibrillator. Bij de selectie van de patiënten die in aanmerking komen voor inplanting van een defibrillator zijn de comorbiditeiten dus belangrijker dan louter de leeftijd.
Een andere retrospectieve studie heeft de werkzaamheid en de veiligheid van inplanting van een defibrillator in de secundaire preventie onderzocht bij 519 patiënten ouder dan 80 jaar, van wie er 34 ouder waren dan 80 jaar.9 De sterfte was veel hoger bij de 80-plussers. Ongeveer 30 % van de patiënten had een ongepaste schok gekregen, zonder significant verschil tussen de leeftijdsgroepen.
Hoewel nog altijd vaak een defibrillator wordt ingeplant bij hoogbejaarde patiënten, zijn de gegevens over hun klinische werkzaamheid en de invloed op de overleving vaak tegenstrijdig. De voorschrijvende artsen stoten op meerdere dilemma's.10 Mogen de resultaten van studies uitgevoerd bij jonge patiënten geëxtrapoleerd worden naar oudere patiënten? Is het aantal complicaties aanvaardbaar en verbetert de overleving significant? Is er een groep patiënten die meer baat zal vinden bij inplanting van een defibrillator?
Het met de procedure samenhangende risico is wat hoger bij bejaarde patiënten, maar is nog aanvaardbaar. Inplanting van een defibrillator is vrij veilig, ook op hoge leeftijd. Wat de behandeling van dodelijke ritmestoornissen betreft, is een defibrillator even effectief bij jonge als bij oude patiënten. Maar gezien het hoge risico op overlijden aan andere oorzaken dan ritmestoornissen is het nut van een geschikte behandeling vrij laag en neemt de levensverwachting maar weinig toe. De totale sterfte bij patiënten ouder dan 70 of 80 jaar is zeer hoog, maar inplanting van een defibrillator kan doeltreffend zijn bij zeer geselecteerde patiënten die een hoog risico op overlijden door ritmestoornissen lopen en die ondanks een hoge leeftijd maar weinig comorbiditeiten vertonen. De biologische leeftijd is dan ook belangrijker dan de chronologische bij de selectie van patiënten die in aanmerking komen voor een defibrillator. Inplanting van een defibrillator bij bejaarden is over het algemeen niet kosteneffectief, maar kan dat wel zijn bij geselecteerde bejaarden met een levensverwachting van meer dan 5-7 jaar (figuur 1).

Samengevat: inplanting van een defibrillator is geïndiceerd bij geselecteerde bejaarde patiënten. Het effect van een defibrillator op de sterfte bij bejaarden wordt ter discussie gesteld, maar bij een aantal patiënten zal de overleving wel verbeteren. Het is dus belangrijk om de patiënten goed te selecteren op grond van de comorbiditeiten, om niet nodeloos een defibrillator in te planten bij patiënten bij wie de klinische waarde beperkt is (vooral in de primaire preventie). De beslissing moet altijd in overleg met de patiënt worden genomen.
Cardiale resynchronisatietherapie (CRT)
Cardiale resynchronisatietherapie is een erkende behandeling bij patiënten met een symptomatisch hartfalen en een geleidingsstoornis (hoofdzakelijk een volledig linkerbundeltakblok, VLBTB) ondanks een optimale medische behandeling. CRT kan bestaan uit een resynchroniserende pacemaker (CRT-P) of een combinatie met een defibrillator (CRT-D).
Er is nog veel discussie over het effect van een defibrillator op de prognose bij patiënten die CRT krijgen. De RESET-CRT-studie, die is uitgevoerd bij 847 patiënten met een CRT-P en 2 722 patiënten met een CRT-D afkomstig uit de gegevensbank van de Duitse ziekteverzekering, heeft de overleving in die twee groepen vergeleken.11 De gemiddelde leeftijd was 76,7 jaar in de CRT-P-groep en 69,9 jaar in de CRT-D-groep. In beide groepen had ongeveer 26 % van de patiënten ischemisch hartfalen. Volgens een niet-gecorrigeerde Kaplan-Meieranalyse was CRT-D beter dan CRT-P (HR 1,63, 95 % BI 1,38 - 1,92, p < 0,001). Na correctie voor de leeftijd en de comorbiditeiten is er echter geen verschil tussen de groepen teruggevonden (HR 0,99, 95 % BI 0,81 - 1,20, p = 0,89). Bij analyse volgens de leeftijd (< 65 jaar, 65-75 jaar en > 75 jaar) is er geen verschil vastgesteld. Het verschil in overleving in het voordeel van CRT-D bij de niet-gecorrigeerde analyse was hoofdzakelijk toe te schrijven aan de jonge leeftijd van de patiënten in de CRT-D-groep. De auteurs van deze observatiestudie stellen dat een gerandomiseerde studie wenselijk is om het effect van CRT-P op de sterfte te vergelijken met dat van CRT-D.
Er zijn nog andere observatiestudies uitgevoerd bij oudere patiënten met een CRT. In een retrospectieve studie bij 728 patiënten (van wie er 90 ouder waren dan 80 jaar) die CRT kregen, waren de klinische effecten (verbetering van de symptomen en de systolische linkerventrikelfunctie) bij de tachtigers die een CRT (P of D) kregen wegens gevorderd hartfalen, vergelijkbaar met die bij jongere patiënten.12 Een post-hocanalyse van de MADIT-CRT-studie heeft het effect van de leeftijd op hartfalen en sterfte geëvalueerd.13 In die studie zijn 1 281 patiënten met lichte tot matige symptomen, een gedaalde LVEF en een VLBTB gerandomiseerd naar CRT-D of enkel een defibrillator. De behandeling met CRT-D verlaagde significant de incidentie van met hartfalen samenhangende evenementen en het samengestelde eindpunt van overlijden en hartfalen in alle leeftijdsgroepen. Men mag bejaarde patiënten dus niet uitsluiten van een resynchronisatietherapie. Die blijft doeltreffend in deze leeftijdsgroep.
De keuze tussen CRT-P en CRT-D is moeilijk, vooral bij bejaarde patiënten. Bij patiënten die in aanmerking komen voor inplanting van een defibrillator en bij wie er een indicatie is voor inplanting van een CRT, wordt inplanting van een CRT-D aanbevolen (klasse IA).4 Bij patiënten die in aanmerking komen voor CRT, zou inplanting van een CRT-D moeten worden overwogen na een individuele evaluatie van het risico en moet de patiënt actief worden betrokken bij het nemen van de beslissing (klasse IIa, B). Hoe ouder en hoe meer comorbiditeiten (en hoe minder myocardfibrose bij MRI), des te makkelijker zal men een CRT-P inplanten in plaats van een CRT-D. Andere factoren pleiten veeleer voor CRT-P dan voor CRT-D: niet-ischemisch hartlijden, korte levensverwachting, belangrijke comorbiditeit, nierinsufficiëntie en voorkeur van de patiënt.
Een praktisch voorbeeld: een 82-jarige man die een hartstilstand op ventrikelfibrillatie buiten het ziekenhuis heeft overleefd en een LVEF van 30 %, gezonde kransslagaders en een VLBTB heeft, zal zeker baat vinden bij een CRT-D in de secundaire preventie (indicatie voor een defibrillator en een CRT, dus klasse IA). Een 80-jarige man met hartfalen en persisterende symptomen (NYHA-klasse III) ondanks een optimale behandeling, met een voorgeschiedenis van myocardinfarct, waarvoor PTCA, een LVEF van 28 %, een VLBTB en chronische nierinsufficiëntie stadium 3 daarentegen, zal een betere kandidaat zijn voor inplanting van een CRT-P (klasse I voor inplanting van een CRT, maar onvoldoende argumenten voor inplanting van een defibrillator, gezien de leeftijd en de comorbiditeit).
Samengevat: een behandeling met een resynchroniserende pacemaker verbetert de levenskwaliteit en vermindert de symptomen en het aantal ziekenhuisopnames wegens hartfalen, ongeacht de leeftijd van de patiënt. Men moet de richtlijnen volgen ongeacht de leeftijd van de patiënt. Of de overleving bij bejaarde patiënten beter is met CRT-D dan met CRT-P is niet duidelijk, vooral in de primaire preventie. Het verdient aanbeveling om niet alleen rekening te houden met de leeftijd, maar ook met de comorbiditeit van de patiënt, en om de keuze tussen CRT-P en CRT-D te overleggen met de patiënt.
Ablatie voor atriumfibrillatie bij patiënten met een hoog cardiovasculair risico
Sébastien Knecht - AZ Sint-Jan Brugge
Inleiding
Atriumfibrillatie (AF) is de frequentste ritmestoornis. 2-4 % van de wereldbevolking vertoont een atriumfibrillatie (43,6 miljoen patiënten in 2016). De prevalentie is het hoogst in de Verenigde Staten en Noord-Europa (meer dan 900 gevallen per 100 000 inwoners).14 AF veroorzaakt veel complicaties en verhoogt het overlijdensrisico met een factor 1,5 tot 3,5, hoofdzakelijk door hartfalen en CVA. AF is goed voor 20-30 % van de gevallen van ischemisch CVA, hartfalen en depressie (met inbegrip van zelfdodingsgedachten). Bij meer dan 60 % van de patiënten heeft AF negatieve invloed op de levenskwaliteit en jaarlijks wordt 10-40 % van de patiënten met AF in het ziekenhuis opgenomen voor behandeling van hartfalen als gevolg van AF of van met de behandeling samenhangende complicaties. De prevalentie van AF stijgt met de leeftijd en wordt beïnvloed door het risicoprofiel van de patiënten. Rond de leeftijd van 70 jaar zou het risico op AF ongeveer 5 % bedragen bij patiënten met een laag risico en meer dan 10 % bij patiënten die een hoog risico lopen.
Aanpak van de risicofactoren
risicofactoren (hypertensie, sedentair leven, slaapapneu, roken, dyslipidemie, obesitas) maakt integraal deel uit van het therapeutisch beleid en verbetert de resultaten van ablatie voor AF. Lichaamsbeweging en programma's om de lichamelijke conditie te herstellen verbeteren de cardiorespiratoire capaciteit van de patiënten. De CARDIO-FIT-studie heeft bij 308 patiënten met AF en een BMI van meer dan 27 kg/m² een programma van aanpak van de cardiovasculaire risicofactoren en cardiorespiratoire training geëvalueerd: 3-5 dagen per week, 60-200 minuten lichte of matig intense lichaamsbeweging per week (aerobe en spierversterkende oefeningen).15 De ernst van de symptomen en de AF-last namen af naarmate de lichamelijke conditie van de patiënten verbeterde (met meer dan 2 MET in vergelijking met de beginwaarde). Patiënten met een betere lichamelijke capaciteit (vermagering met 10 % en winst van 2 MET) vertonen ook minder ritmestoornissen met of zonder strategie voor ritmecontrole. Zwaarlijvige patiënten zouden moeten vermageren (aanbeveling klasse IB, vroeger klasse IIa), vooral patiënten die geselecteerd zijn voor een AF-ablatie.
Ritmecontrole versus controle van het kamerantwoord
Recent zijn meerdere studies gepubliceerd over de behandeling van AF. De CABANA-studie is een gerandomiseerde, gecontroleerde, multicentrische studie die het nut van katheterablatie heeft vergeleken met een klassieke behandeling (126 centra in 10 landen).16 De studie is uitgevoerd bij 2 204 patiënten met symptomatische AF (van wie 43 % paroxismale AF), die gedurende ongeveer 4 jaar zijn gevolgd. De patiënten waren ouder dan 65 jaar of jonger dan 65 jaar, met minstens één risicofactor voor CVA (hypertensie, hartfalen, voorgeschiedenis van CVA, diabetes). Het primaire eindpunt was een samengesteld eindpunt van overlijden, CVA, ernstige bloeding en hartstilstand. Ook zijn 12 secundaire eindpunten geëvalueerd, waaronder de totale sterfte, recidief van AF en het aantal ziekenhuisopnames. De patiënten werden gerandomiseerd naar ablatie (n = 1 108, minstens isolatie van de longaders) of een medische behandeling (n = 1 096). Bij 301 van de patiënten die waren gerandomiseerd naar een medische behandeling is toch een katheterablatie uitgevoerd. Die hoge cross-over heeft uiteraard een negatieve invloed gehad op de kracht van de studie. Bij een analyse volgens het principe van intentie tot behandelen kon door de hoge cross-over geen verschil in het primaire eindpunt worden aangetoond tussen de groepen. Wel is een daling van de sterfte en het aantal ziekenhuisopnames vastgesteld na katheterablatie in vergelijking met de medische behandeling (HR 0,83, 95 % BI 0,74 - 0,93, p = 0,001). Bij een perprotocolanalyse (1 400 patiënten bij wie een ablatie was uitgevoerd en 800 patiënten die een medische behandeling hadden gekregen) bedroeg het percentage recidief van AF over een periode van 4 jaar ongeveer 65 % in de medisch behandelde groep en 45 % in de ablatiegroep (HR 0,52, 95 % BI 0,45 - 0,60, p < 0,001). Het primaire eindpunt is bereikt bij 10 % van de patiënten van de ablatiegroep en 13 % van de patiënten van de medisch behandelde groep (HR 0,73, 95 % BI 0,54 - 0,99, p = 0,046). Ook de levenskwaliteit was significant beter na katheterablatie dan bij een medische behandeling.17
De multicentrische EAST-AFNET 4-studie is uitgevoerd bij 2 789 patiënten met comorbiditeiten en een recente (minder dan een jaar) AF, die waren gerandomiseerd naar een vroege strategie voor ritmecontrole (antiaritmicum en/of ablatie) of een standaardbehandeling, zijnde controle van het kamerantwoord (hoofdzakelijk met een bètablokker).18 Het betrof patiënten met een hoog cardiovasculair risico: ouder dan 75 jaar en voorgeschiedenis van TIA/CVA of twee van de volgende criteria: ouder dan 65 jaar, vrouwelijk geslacht, hartfalen, hypertensie, diabetes, ernstig coronairlijden, nierinsufficiëntie stadium 3 of 4 en linkerventrikelhypertrofie. Circa 30 % van de patiënten had geen symptomen. Het primaire eindpunt was een samengesteld eindpunt van cardiovasculaire sterfte, CVA en ziekenhuisopname wegens verergering van hartfalen of een acuut coronair syndroom. 86,8 % van de patiënten in de groep waarin werd gestreefd naar een vroeg herstel van het sinusritme, is in het begin van de studie behandeld met een antiaritmicum (van wie 35,9 % flecaïnide) en 8 % met ablatie. Na een follow-up van 2 jaar werd 45,7 % behandeld met een antiaritmicum (van wie 21 % flecaïnide) en was bij 19,4 % een ablatie uitgevoerd. In de groep waarin werd geprobeerd het kamerantwoord onder controle te brengen, kreeg 85,4 % van de patiënten na twee jaar nog altijd de initiële strategie en was bij 7 % een ablatie uitgevoerd. De cumulatieve incidentie van optreden van het primaire eindpunt was 5 % per jaar in de groep die een standaardbehandeling kreeg en 3,9 % per jaar in de ritmecontrolegroep, een daling van het primaire eindpunt met 21 % (HR 0,79, 95 % BI 0,66 - 0,94, p = 0,005). De incidentie van CVA was 35 % lager en de cardiovasculaire sterfte 28 % lager in de ritmecontrolegroep, en die verschillen waren significant (HR 0,72, 95 % BI 0,52 - 0,98, en HR 0,65, 95 % BI 0,44 - 0,97). De uitkomstmaten waren beter bij een vroege ritmecontrolestrategie, ook bij de patiënten die geen symptomen hadden. Er was geen verschil in het eindpunt van veiligheid, een samengesteld eindpunt van overlijden, CVA en bijwerkingen.
Onlangs is een subanalyse van de EAST-AFNET 4-studie gepresenteerd (Angelika Leute, HRS 2022, Late Breaking Trial). Die analyse heeft patiënten met veel comorbiditeiten vergeleken met patiënten met minder comorbiditeiten: 1 093 patiënten met veel comorbiditeiten (CHA2DS2-VASc ≥ 4), die ongeveer 75 jaar waren, en 1 696 patiënten met weinig comorbiditeiten (CHA2DS2-VASc < 4), die ongeveer 67 jaar waren. Met een strategie waarbij vroeg is geprobeerd het sinusritme te herstellen, verminderde het primaire eindpunt (een samengesteld eindpunt van overlijden, CVA en ziekenhuisopname wegens verergering van hartfalen of acuut coronair syndroom) bij de patiënten met een CHA2DS2-VASc-score ≥ 4, maar niet bij de patiënten met een score < 4. Er was geen verschil in het eindpunt van veiligheid (een samengesteld eindpunt van overlijden, CVA en bijwerkingen) tussen de groepen, ongeacht de CHA2DS2-VASc-score. Volgens deze studie zouden patiënten met veel comorbiditeiten bij wie onlangs een diagnose van AF is gesteld, prioritair moeten worden behandeld met een ritmecontrolestrategie om de incidentie van cardiovasculaire accidenten na 2 jaar te verlagen.
Katheterablatie versus chirurgische ablatie
In de CASA-AF-studie zijn 120 patiënten met een persisterende AF gerandomiseerd naar katheterablatie of chirurgische ablatie via thoracoscopie.19 Bij alle patiënten is tijdens de ablatie een internal loop recorder ingeplant. Na 12 maanden was er geen verschil in het aantal patiënten zonder AF of atriale tachycardie langer dan 30 seconden zonder antiaritmica tussen de groepen. Het aantal patiënten waarbij het aantal aanvallen van AF met meer dan 75 % was gedaald, was echter lager na katheterablatie (77 % versus 67 %, p = 0,03). Het aantal complicaties was vergelijkbaar in de twee groepen. In de chirurgisch behandelde groep is één patiënt overleden. De symptomen waren sterker verbeterd in de katheterablatiegroep. Na 12 maanden waren de kosten van chirurgie hoger dan die van een katheterablatie en was de levenskwaliteit minder verbeterd na chirurgie dan na katheterablatie (p = 0,02).
Ablatietechniek
De laatste jaren zijn er verschillende ablatieprotocollen ontwikkeld om de duur van isolatie van de longaders te verlengen. Het CLOSE-protocol bijvoorbeeld is een strategie van radiofrequentieablatie, die in Brugge is ontwikkeld, waarbij een stabiele en contigue ablatie punt per punt (maximale afstand 6 mm) wordt uitgevoerd over de hele omtrek van de longaders. Daardoor daalt het recidiefpercentage drastisch (succes circa 85 % na 1 jaar). De risico's van thermoablatie zijn beperkt en de procedure duurt 40 tot 80 minuten. Multicentrische studies hebben de waarde van deze techniek bevestigd, hoofdzakelijk bij de behandeling van paroxismale AF.20,21
Persisterende AF is moeilijker te behandelen. De behandeling bestaat uit nieuwe technieken, naast isolatie van de longaders. Door ethanolisatie van de ader van Marshall kan een diepe isolatie van de inferolaterale wand van het linker hartoortje worden bewerkstelligd. Het ligament van Marshall speelt mee bij de pathogenese van de AF (aanwezigheid van aritmogene haarden en van het sympathisch zenuwstelsel). Met deze techniek kunnen ook atriale tachycardieën rond de mitralisklep makkelijker worden behandeld (ablatie van de mitralislijn en isolatie van de aders van de linkerlong). De multicentrische VENUS-studie heeft 350 patiënten met een persisterende AF (van wie meer dan 50 % met een al lang bestaande AF) die tal van risicofactoren vertoonden, gevolgd gedurende 1 jaar. De patiënten werden gerandomiseerd naar enkel ablatie (n = 158) of ablatie + ethanolisatie van de ader van Marshall (n = 185).22 Ethanolisatie van de ader van Marshall verlaagde het risico op recidief van atriale tachycardie of AF na 12 maanden met 33 % in vergelijking met enkel ablatie (HR 0,67, 95 % BI 0,47 - 0,93, p = 0,02). Een perimitralisblok is belangrijk voor het risico op recidief van atriumfibrillatie of atriale tachycardie. Zonder perimitralisblok was er geen verschil tussen ablatie alleen en ablatie plus ethanolisatie van de ader van Marshall (p = 0,92). Na uitvoering van een perimitralisblok was het aantal gevallen van recidief van tachycardie of AF 48 % lager, een significant verschil, dankzij de combinatie met ethanolisatie van de ader van Marshall (HR 0,52, 95 % BI 0,33 - 0,82, p = 0,04). Het is bewezen dat een ethanolinfuus in de ader van Marshal in 94 % van de gevallen een mitralisblok bewerkstelligt na de eerste passage tegen 43 % zonder ethanolisatie.23
Richtlijnen van de Europese Vereniging voor Cardiologie (gepubliceerd in 2020) over de indicatie voor ablatie bij AF (figuur 2)
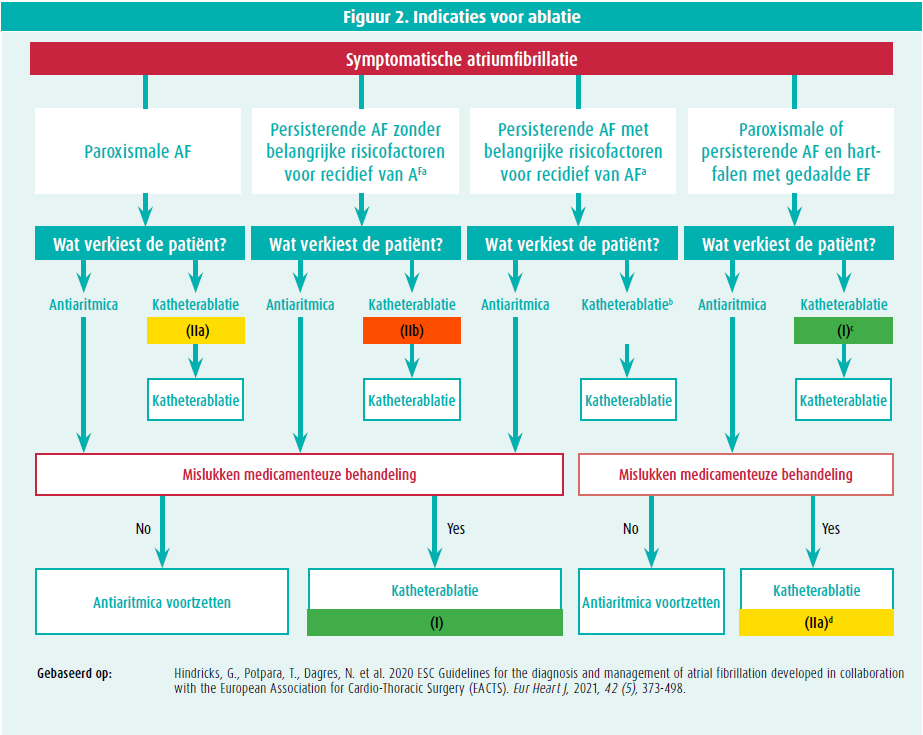
Bij patiënten met een symptomatische paroxismale AF is katheterablatie geïndiceerd na mislukken van een behandeling met antiaritmica, ongeacht de risicofactoren (klasse I).14 Als de patiënt dat wenst, kan een katheterablatie ook worden uitgevoerd als eerstelijnstherapie (klasse IIa). Bij patiënten met persisterende AF maken we een onderscheid tussen patiënten met en patiënten zonder risicofactoren voor recidief (verwijd linkerhartoortje, hogere leeftijd, lang bestaande AF, nierinsufficiëntie en andere cardiovasculaire risicofactoren). Bij patiënten zonder risicofactoren wordt een ablatie aanbevolen na mislukken van antiaritmica (klasse I) en bètablokkers (klasse IIa), maar kan een ablatie ook als eerstelijnstherapie worden overwogen (klasse IIb). Patiënten met een persisterende AF met risicofactoren voor recidief worden eerst behandeld met antiaritmica en daarna met ablatie. Belangrijk is evenwel dat die richtlijnen nog geen rekening houden met de resultaten van de EAST-AFNET 4-studie (met name patiënten zonder symptomen).
Speciale klinische situaties
Patiënten met hartfalen met gedaalde LVEF
Bij patiënten met hartfalen met gedaalde LVEF en (paroxismale of persisterende) AF wordt ablatie als eerstelijnstherapie aanbevolen (klasse I).14 Een ablatie is ook geïndiceerd na mislukken van antiaritmica (klasse IIa). De AATAC-studie is een gerandomiseerde studie die katheterablatie heeft vergeleken met amiodaron bij de behandeling van persisterende AF bij patiënten met hartfalen.24 203 patiënten met AF en een LVEF lager dan 40 % met een defibrillator of CRT werden gerandomiseerd naar ablatie (n = 102) of een behandeling met amiodaron (n = 101). De gemiddelde LVEF was in beide groepen 30 %. Na een follow-up van 24 maanden was het aantal recidieven van AF significant lager na ablatie dan bij behandeling met amiodaron (70 % vs. 34 %, p < 0,001). In de ablatiegroep waren ook de sterfte (8 % vs. 18 % met een NNT van 10) en het aantal ziekenhuisopnames (NNT 3,8) lager en waren de levenskwaliteit, de linkerventrikelfunctie en de afstand die in 6 minuten afgelegd kon worden beter. Ook de CASTLE-AF-studie heeft het effect van katheterablatie vergeleken met dat van een medische behandeling bij patiënten met hartfalen én een paroxismale of persisterende AF die niet hadden gereageerd op de medische behandeling, bijwerkingen hadden vertoond of geen geneesmiddelen meer door de mond wilden innemen.23 363 patiënten met een LVEF < 35 %, een AF en een defibrillator werden gerandomiseerd naar ablatie (n = 179) of een medische behandeling: controle van het kamerantwoord of controle van het ritme (n = 184) en werden gedurende 38 maanden gevolgd. 30-35 % van de patiënten vertoonde een paroxismale AF en 65-70 % een persisterende. De mediane LVEF was 32 %. 45 % van de patiënten had niet gereageerd op amiodaron en 12-14 % had bijwerkingen ontwikkeld. Katheterablatie verminderde het primaire eindpunt, een samengesteld eindpunt van overlijden en ziekenhuisopname wegens hartfalen, met 38 % (HR 0,62, 95 % BI 0,43 - 0,87, p = 0,007) in vergelijking met de medische behandeling. De sterfte was 47 % lager, het aantal ziekenhuisopnames wegens hartfalen was 44 % lager en de cardiovasculaire sterfte was 51 % lager in de ablatiegroep (p telkens < 0,01). Het sinusritme bleef vaker gehandhaafd in de ablatiegroep en de tijd in AF daalde drastisch.
Ablatie bij bejaarden
Er zijn geen gerandomiseerde studies van ablatie specifiek uitgevoerd bij bejaarde patiënten. Er is dan ook geen restrictie bij de aanbevelingen, ook al moet rekening gehouden worden met de frailty en de levensverwachting van die patiënten. In een subgroepanalyse van de CABANA-studie waren de uitkomsten bij de 75-plussers veeleer beter bij de medische behandeling dan bij ablatie.16 Een recente studie heeft de werkzaamheid en de veiligheid van ablatie volgens een nieuwe techniek vergeleken bij 75-plussers en jongere patiënten.26 Die retrospectieve analyse is uitgevoerd bij 540 patiënten met een paroxismale of persisterende AF (47 % had een paroxismale AF). Het aantal complicaties was hoger bij de bejaarde patiënten, hoofdzakelijk door een 'ontmaskering' van een ziekesinusknoopsyndroom (p = 0,003). Het relapspercentage was vergelijkbaar in de twee groepen (p = 0,087), behalve in de subgroep van patiënten met een paroxismale AF. In die subgroep was het relapspercentage hoger bij de oudere patiënten (31 % vs. 18 %, p = 0,04). Bij multivariate analyse correleerde een leeftijd hoger dan 75 jaar echter niet met een hoger risico op recidief van AF. De volgende factoren wel: persisterende AF, vrouwelijk geslacht, diabetes en zone met laag voltage. Katheterablatie bij bejaarde patiënten is dus een doeltreffende en veilige optie die geen belangrijke complicaties veroorzaakt, en het slaagpercentage is vergelijkbaar met dat bij jonge patiënten.14
Toekomst van ablatie
'Pulse field ablation' is een nieuwe ablatietechniek die gebaseerd is op een andere vorm van energie, elektroporatie. Tijdens de ablatie geeft de katheter ultrasnelle (micro- tot nanoseconden) elektrische impulsen af om de celmembranen te destabiliseren met vorming van irreversibele poriën, waardoor de cellen vanaf een zeker niveau van energie afsterven. Dat niveau is weefselspecifiek. Toevallig is de drempel het laagst in het myocard. Theoretisch zal die behandeling dan ook geen letsels veroorzaken van andere organen zoals de slokdarm, de nervus phrenicus en de vaatweefsels. Er is dan ook geen risico op stenose van de longaders. In de IMPULSE-studie heeft de ablatietechniek geen significante complicaties veroorzaakt.27 De isolatie van de longaders blijkt lang aan te houden. Nagenoeg alle patiënten vertoonden 3 maanden na de initiële interventie nog altijd een isolatie van de 4 longaders. Het slaagpercentage na een jaar bedroeg circa 85 %.
Conclusie
Bij patiënten met symptomatische paroxismale AF is ablatie geïndiceerd (klasse I) na mislukken van antiaritmica (klasse Ic) of als eerstelijnstherapie (klasse IIa), ongeacht het risicoprofiel. Bij patiënten met een symptomatische persisterende AF is een ablatie geïndiceerd na mislukken van antiaritmica (klasse I) (klasse IIa na mislukken van een bètablokker), ongeacht het risicoprofiel, of als eerstelijnstherapie als er geen belangrijke risicofactoren voor recidief van AF zijn (klasse IIb). Bij patiënten met AF en hartfalen met gedaalde EF is ablatie geïndiceerd als eerstelijnstherapie (klasse I) en moet ablatie de voorkeur krijgen boven amiodaron.
De risicofactoren moeten altijd conform de richtlijnen worden aangepakt. Een vroege strategie voor herstel van het sinusritme (inclusief ablatie van AF) bij patiënten met sterke comorbiditeiten correleert met een lagere cardiovasculaire sterfte en een lagere incidentie van cerebrovasculair accident en ziekenhuisopname.
Bij bejaarde patiënten moeten dezelfde richtlijnen worden gevolgd als bij jongere patiënten, maar moet rekening worden gehouden met de 'frailty' en de levensverwachting van de patiënt. Een kortere procedure is te verkiezen, gezien het hogere risico op complicaties.
Referenties
- Johansen, J.B. Danish pacemaker and ICD register. Annual Report 2020, 2020. Available from: http://www.ncbi.nlm.nih.gov/ pubmed/11758538
- Toff, W.D., Camm, A.J., Skehan, J.D. Single- Chamber versus Dual-Chamber Pacing for High-Grade Atrioventricular Block. N Engl J Med, 2005, 353 (2), 145-155.
- Nielsen, J.C., Thomsen, P.E.B., Højberg, S. et al. A comparison of single-lead atrial pacing with dual-chamber pacing in sick sinus syndrome. Eur Heart J, 2011, 32 (6), 686-696.
- Glikson, M., Nielsen, J.C., Kronborg, M.B. et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J, 2021, 42 (35), 3427-3520.
- Yung, D., Birnie, D., Dorian, P. et al. Survival after implantable cardioverter-defibrillator implantation in the elderly. Circulation, 2013, 127 (24), 2383-2392.
- Køber, L., Thune, J.J., Nielsen, J.C. et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med, 2016, 375 (13), 1221-1230.
- Elming, M.B., Nielsen, J.C., Haarbo, J. et al. Age and outcomes of primary prevention implantable cardioverter-defibrillators in patients with nonischemic systolic heart failure. Circulation, 2017, 136 (19), 1772-1780.
- Poupin, P., Bouleti, C., Degand, B. et al. Prognostic value of Charlson Comorbidity Index in the elderly with a cardioverter defibrillator implantation. Int J Cardiol, 2020, 314, 64-69.
- Hauck, C., Schober, A., Schober, A. et al. Secondary prevention implantable cardioverter-defibrillator (ICD) therapy: value in octogenarians. Aging Clin Exp Res, 2021, 34 (5), 1073-1080. Doi: 10.1007/s40520-021- 02019-2.
- Barra, S., Providência, R., Paiva, L., Heck, P., Agarwal, S. Implantable cardioverterdefibrillators in the elderly: Rationale and specific age-related considerations. Europace, 2014, 17 (2), 174-186.
- Hadwiger, M., Dagres, N., Haug, J. et al. Survival of patients undergoing cardiac resynchronization therapy with or without de fibrillator: the RESET-CRT project. Eur Heart J, 2022, 00, 1-9.
- Killu, A.M., Wu, J.H., Friedman, P.A. et al. Outcomes of cardiac resynchronization therapy in the elderly. Pacing Clin Electrophysiol, 2013, 36 (6), 664-672.
- Thomas, S., Moss, A.J., Zareba, W. et al. Cardiac Resynchronization in Different Age Groups: A MADIT-CRT Long-Term Follow-Up Substudy. J Card Fail, 2016, 22 (2), 143-149. Available from: http://dx.doi.org/10.1016/j. cardfail.2015.09.015
- Hindricks, G., Potpara, T., Dagres, N. et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J, 2021, 42 (5), 373-498.
- Pathak, R.K., Elliott, A., Middeldorp, M.E. et al. Impact of CARDIOrespiratory FITness on Arrhythmia Recurrence in Obese Individuals With Atrial Fibrillation The CARDIO-FIT Study. J Am Coll Cardiol, 2015, 66 (9), 985-996.
- Packer, D.L., Mark, D.B., Robb, R.A. et al. Effect of Catheter Ablation vs. Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest among Patients with Atrial Fibrillation: The CABANA Randomized Clinical Trial. JAMA, 2019, 321 (13), 1261-1274.
- Mark, D.B., Anstrom, K.J., Sheng, S. et al. Effect of Catheter Ablation vs. Medical Therapy on Quality of Life among Patients with Atrial Fibrillation: The CABANA Randomized Clinical Trial. JAMA, 2019, 321 (13), 1275-1285.
- Kirchhof, P., Camm, A.J., Goette, A. et al. Early Rhythm-Control Therapy in Patients with Atrial Fibrillation. N Engl J Med, 2020, 383 (14), 1305-1316.
- Haldar, S., Khan, H.R., Boyalla, V. et al. Catheter ablation vs. thoracoscopic surgical ablation in long-standing persistent atrial fibrillation: CASA-AF randomized controlled trial. Eur Heart J, 2020, 41 (47), 4471-4480.
- Duytschaever, M., De Pooter, J., Demolder, A. et al. Long-term impact of catheter ablation on arrhythmia burden in low-risk patients with paroxysmal atrial fibrillation: The CLOSE to CURE study. Heart Rhythm, 2020, 17 (4), 535-543. Available from: https://doi. org/10.1016/j.hrthm.2019.11.004
- Duytschaever, M., Vijgen, J., De Potter, T. et al. Standardized pulmonary vein isolation workflow to enclose veins with contiguous lesions: The multicentre VISTAX trial. Europace, 2020, 22 (11), 1645-1652.
- Valderrábano, M., Peterson, L.E., Swarup, V. et al. Effect of Catheter Ablation with Vein of Marshall Ethanol Infusion vs. Catheter Ablation Alone on Persistent Atrial Fibrillation: The VENUS Randomized Clinical Trial. JAMA, 2020, 324 (16), 1620-1628.
- Gillis, K., O'Neill, L., Wielandts, J. et al. Vein of Marshall Ethanol Infusion as First Step for Mitral Isthmus Linear Ablation. JACC Clin Electrophysiol, 2022, 8 (3), 367-376.
- Di Biase, L., Mohanty, P., Mohanty, S. et al. Ablation Versus Amiodarone for Treatment of Persistent Atrial Fibrillation in Patients With Congestive Heart Failure and an Implanted Device: Results From the AATAC Multicenter Randomized Trial. Circulation, 2016, 133 (17), 1637-1644.
- Marrouche, N.F., Brachmann, J., Andresen, D. et al. Catheter Ablation for Atrial Fibrillation with Heart Failure. N Engl J Med, 2018, 378 (5), 417-427.
- Müller, J., Nentwich, K., Berkovitz, A. et al. Efficacy and safety of high-power short duration atrial fibrillation ablation in elderly patients. J Cardiovasc Electrophysiol, 2022.
- Reddy, V.Y., Neuzil, P., Koruth, J.S. et al. Pulsed Field Ablation for Pulmonary Vein Isolation in Atrial Fibrillation. J Am Coll Cardiol, 2019, 74 (3), 315-326.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.