ESC-congresverslag
Deze sessie bestond uit drie interessante presentaties. De eerste presentatie met als titel 'Atrial mitral regurgitation: Fact or fiction?' werd gegeven door Pierre Vandervoort (Genk, België). Lars Lund (Stockholm, Zweden) gaf vervolgens een presentatie over 'Regurgitation, atrial fibrillation, and HFpEF: A three-headed dragon'. Tot slot was er Anna Sonia Petronio (Pisa, Italië), die een presentatie gaf over 'Mitral regurgitation in heart failure: When and how should we intervene?'.
Atriale functionele mitralisinsufficiëntie, atriumfibrillatie, HFpEF
Atriale functionele mitralisinsufficiëntie (AFMR) wordt veroorzaakt door een sterke verwijding van het linkeratrium, waardoor de druk in het atrium stijgt. Ook de sluitingskrachten verminderen door een geringere systolische contractie van de mitralisannulus zelf. De verwijding en de afplatting van de annulus (verdwijnen van de zadelvorm), een onvoldoende verlenging (normale compensatie) van de klepblaadjes1 en een smaller coaptatieniveau veroorzaken een centrale, symmetrische MI type I van Carpentier.
Bij atriale functionele mitralisinsufficiëntie (AFMR) is de systolische functie van het linkerventrikel (LV) normaal, behoudens eventueel een lichte daling van de longitudinale strain van 16-18 %. Daarin verschilt AFMR van MI als gevolg van systolisch falen met dilatatie van het LV, waarbij de volgende mechanismen meespelen: hogere tractiekrachten (tethering) door de dilatatie van het LV en verplaatsing of disfunctie van de papillaire spieren enerzijds en zwakkere sluitingskrachten als gevolg van de zwakke contractiekracht van het LV anderzijds. Bij secundaire mitralisinsufficiëntie (MI) met systolische LV-disfunctie (VFMR) verloopt de terugstroom veeleer excentrisch. Die MI als gevolg van een systolische LV-disfunctie wordt Carpentier IIIB genoemd gezien de 'restrictieve' beweging van de klep.
Als er wordt gesproken van 'secundaire MI' zonder verdere verduidelijking, MI met systolische LV-disfunctie wordt bedoeld.
Functionele MI door verwijding van de linkervoorkamer (LA) hangt vaak samen met atriumfibrillatie (AF) en is omkeerbaar als het lukt het sinusritme te herstellen en te handhaven (AF-ablatie) (figuur 1).2
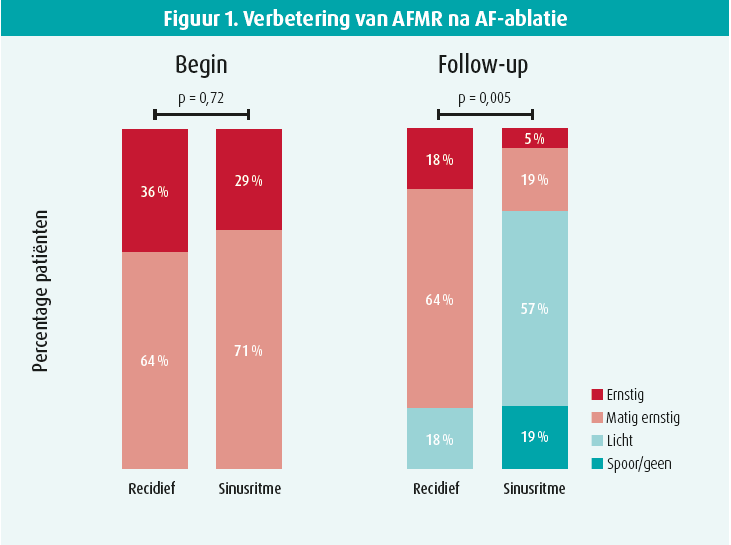
Die verbetering van een (matig ernstige of ernstige) MI is een extra argument voor een strategie van ritmecontrole. AFMR is goed voor ongeveer 7 % van de indicaties voor ablatie van AF. Deferm, Bertrand et al.3 hebben aangetoond dat de dynamiek van de mitralisannulus (presystolische contractie) niet meteen verbetert, maar pas zes weken na herstel van het sinusritme.
Er bestaat een sterke correlatie tussen AFMR, AF en hartfalen met gevrijwaarde ejectiefractie (HFpEF): 1/3 van de patiënten met een HFpEF vertoont AF bij presentatie en 2/3 zal ooit AF ontwikkelen.3
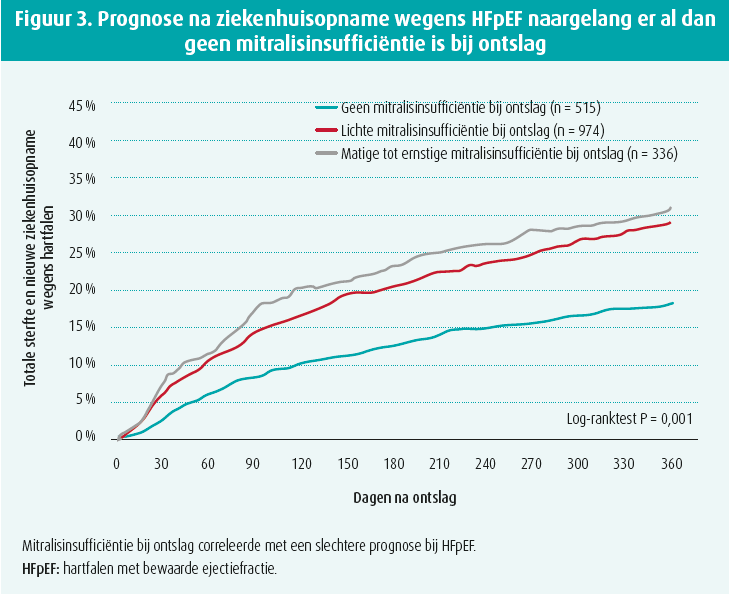
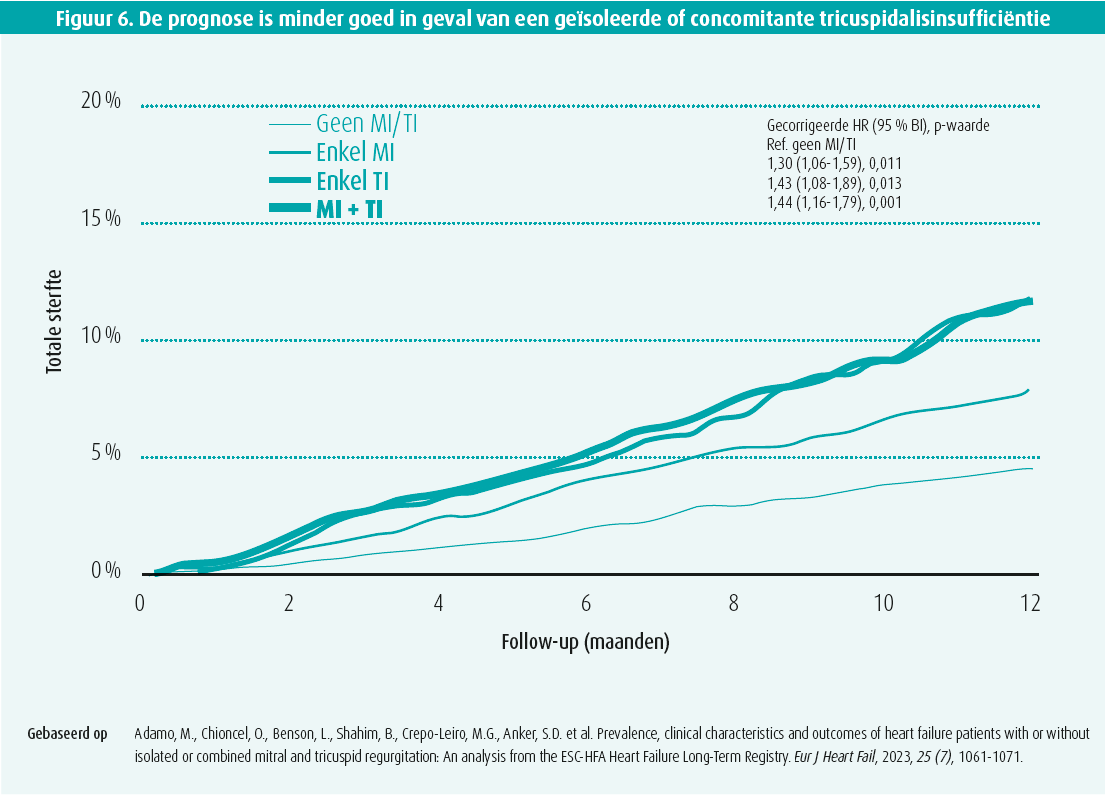
Bij patiënten met HFpEF die in het ziekenhuis worden opgenomen wegens hartdecompensatie (ATTEND-register), is de prognose significant slechter als de patiënt bij ontslag uit het ziekenhuis een matig ernstige tot ernstige MI (18 % van de patiënten) of zelfs maar een lichte MI (53 %) vertoont.
Wat de behandeling betreft (figuur 2), is het belangrijk het sinusritme te herstellen.
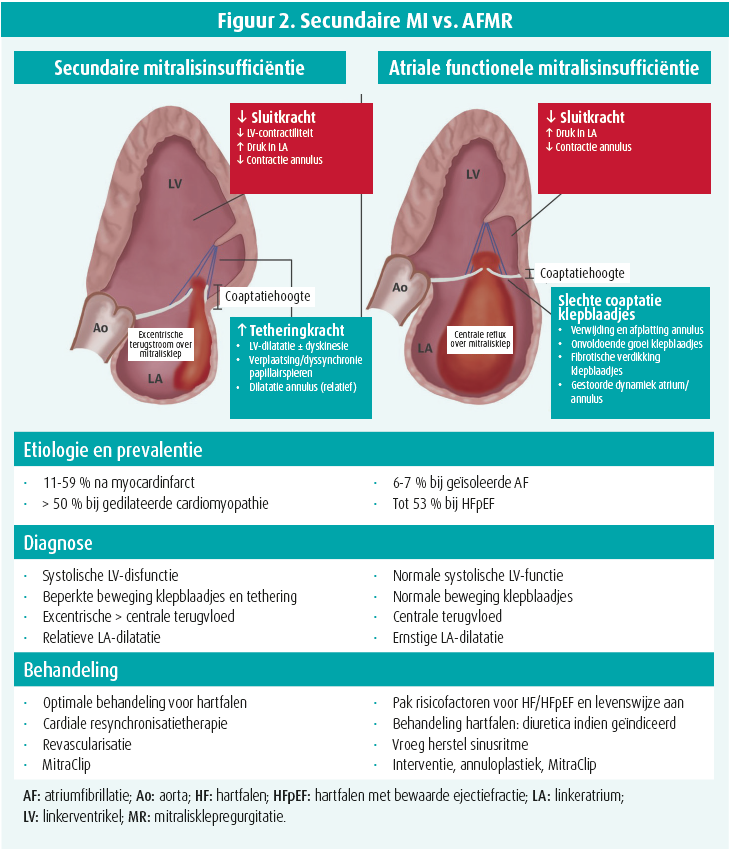
De geneesmiddelen die worden gebruikt bij HFrEF werken niet even goed bij HFpEF, maar sartanen (losartan en valsartan) verminderen de fibrose en de verdikking van de mitralisklep en gaan de nodige verlenging van de mitraalklepblaadjes niet tegen.
Theoretisch gezien zijn een MitraClip en reductie van de mitralisannulus effectiever op lange termijn dan bij HFrEF. Daar is een toename van de ventrikeldilatatie (en dus van de 'tethering') prognostisch ongunstig. Er is dus nood aan specifieke studies op grond waarvan dan nieuwe richtlijnen kunnen worden opgesteld.
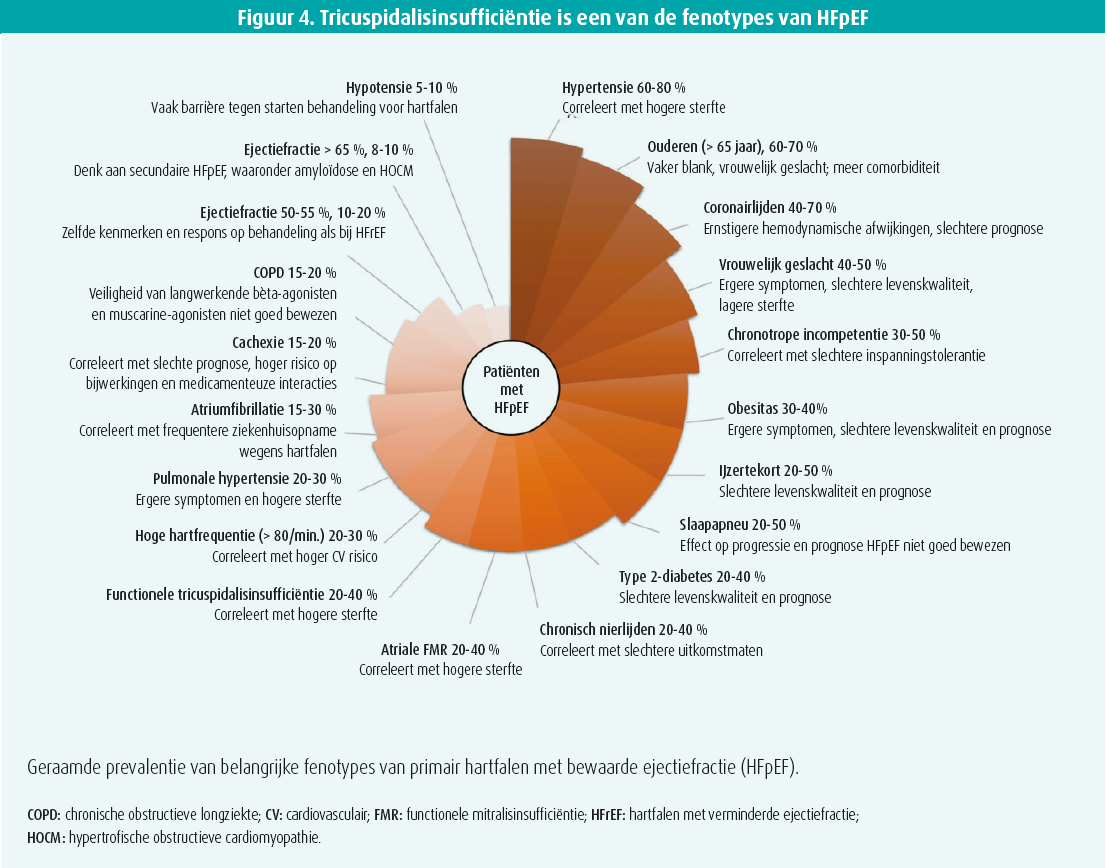
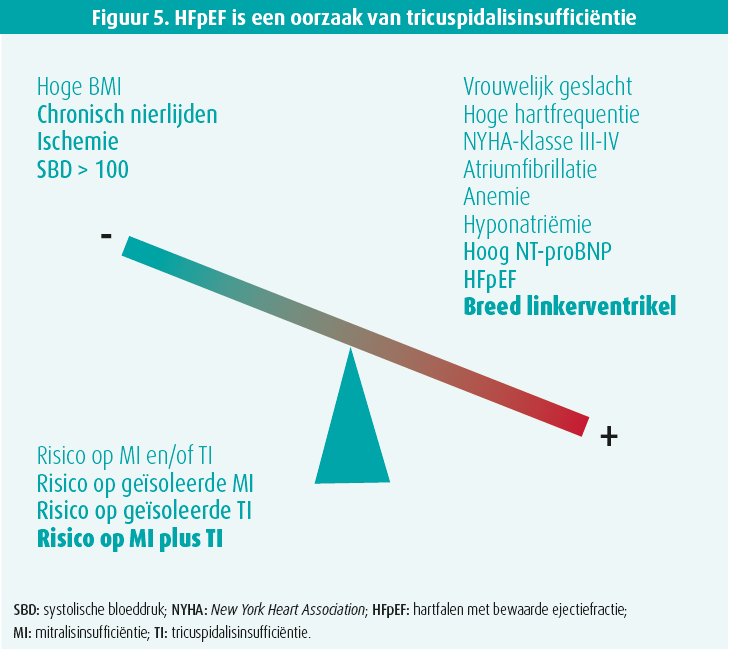
Lund benadrukte dat gemeenschappelijke factoren (ontsteking, diabetes, hypertensie, leeftijd) een HFpEF en fibrose van de voorkamers veroorzaken (en dus een auriculaire myopathie naast aantasting van het spierweefsel van het ventrikel), wat kan leiden tot AF (frequenter bij HFpEF dan bij HFrEF). Patiënten met een HFpEF ontwikkelen vaak een MI (AFMR) en ook tricuspidalisinsufficiëntie (TI) (20-40 %), wat een van de fenotypes van HFpEF is.4 Die FTR (functional tricuspid regurgitation) is toe te schrijven aan postcapillaire pulmonale hypertensie en ontstekingsverschijnselen.
Behandeling van secundaire mitralisinsufficiëntie (HFrEF)
De huidige behandeling van secundaire MI is gebaseerd op de criteria van de COAPT-studie zoals vermeld in de stellingname van de ESC.6 Petronio heeft het belang van overleg ('hartteam') benadrukt. De ESC-richtlijnen7 laten immers de deur open voor een transkatheter edge-to-edge repair (TEER), ook al is succes niet verzekerd (IIb-indicatie).
Vervanging van de mitralisklep via een katheter (TMVR) is een mogelijkheid, maar veel kandidaten worden geweigerd na een anatomische evaluatie. Na 12 maanden is het resultaat van een TMVR vergelijkbaar met dat van een TEER.8 Het medische hulpmiddel moet worden aangepast aan de anatomie van de klep. De COAPT-criteria voor een TEER zijn9: ernstige secundaire MI met een systolische LV-diameter < 70 mm, PAPS < 70; TAPSE > 15; het hartfalen reageert op een optimale medische behandeling (GDMT). De drie criteria (LV, RV, stabiliteit) zijn vereist om een betere prognose te verkrijgen na een TEER.10
Dit jaar is de vijfjarige follow-up van de COAPT-studie gepubliceerd. Niet alleen is een GDMT nodig, maar ook een optimale aanpassing ervan na TEER. TEER was nog altijd beter dan een medische behandeling (ziekenhuisopname wegens hartfalen per jaar respectievelijk 33 % en 57 %).11
Ondanks de problemen van TEER/TMVR zijn de resultaten bij een secundaire MI na 12 maanden beter (50 % sterfte of ziekenhuisopname wegens hartdecompensatie) dan met een medische behandeling op geleide van de richtlijnen (GDMT) (75 % negatieve resultaten). Een TEER bij functionele TI moet worden uitgevoerd voordat het RV-falen significant is geworden.12
Bij een secundaire TI (HFpEF) met gedilateerd RV blijkt een TEER ook gunstige effecten te hebben bij patiënten met een ernstige TI, en zelfs bij de helft van de patiënten met een massale of torrentiale TI (TRILUMINATE-studie).
Conclusie
Deze sessie vult de beschikbare gegevens over transkathetertherapie aan, maar opent ook nieuwe perspectieven bij TI, wat zeer belangrijk is bij HFpEF. De medische behandeling verbetert stilaan (ook voor HFpEF) en moet worden voortgezet en opgedreven, zelfs na een TEER of een TMVR.


Referenties
- Dae-Hee, K., Heo, R., Handschumacher, M.D., Lee, S., Choi, Y-S., Kim, K-R. et al. Mitral Valve Adaptation to Isolated Annular Dilation: Insights Into the Mechanism of Atrial Functional Mitral Regurgitation. J Am Coll Cardiol Img, 2019, 12 (4), 665-677.
- Gertz, Z.M., Raina, A., Saghy, L., Zado, E.S., Callans, D.J., Marchlinski, F.E., Keane, M.G. et al. Evidence of atrial functional mitral regurgitation due to atrial fibrillation: reversal with arrythmia control. J Am Coll Cardiol, 2011, 58 (14), 1474-1481.
- Deferm, S., Bertrand, P., Verbrugge, F.H., Verhaert, D., Rega, F., Thomas, J.D., et al. Atrial Functional Mitral Regurgitation: JACC Review Topic of the Week. J Am Coll Cardiol, 2019, 73 (19), 2465-2476.
- Anker, S.D., Usman, M.S., Anker, M.S., Butler, J., Böhm, M. Abraham, W.T. et al. Patient phenotype profiling in heart failure with preserved ejection fraction to guide therapeutic decision making. A scientific statement of the Heart Failure Association, the European Heart Rhythm Association of the European Society of Cardiology, and the European Society of Hypertension. Eur J Heart Fail, 2023, 25 (7), 936-955.
- Adamo, M., Chioncel, O., Benson, L., Shahim, B., Crepo-Leiro, M.G., Anker, S.D. et al. Prevalence, clinical characteristics and outcomes of heart failure patients with or without isolated or combined mitral and tricuspid regurgitation: An analysis from the ESC-HFA Heart Failure Long-Term Registry. Eur J Heart Fail, 2023, 25 (7), 1061-1071.
- Coats, A.J.S., Anker, S.D., Baumbach, A., Alfieri, O., von Bardeleben, R.S., Bauersachs, J. et al. The management of secondary mitral regurgitation in patients with heart failure: a joint position statement from the Heart Failure Association (HFA), European Association of Cardiovascular Imaging (EACVI), European Heart Rhythm Association (EHRA), and European Association of Percutaneous Cardiovascular Interventions (EAPCI) of the ESC. Eur Heart J, 2021, 42 (13), 1254-1269.
- Vahanian, A., Beyersdorf, F., Praz, F., Milojevic, M., Baldus, S., Bauersachs, J. et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J, 2022, 43 (7), 561-632.
- Scotti, A., Leone, P.P., Sturla, M., Curio, J., Spring, A.M., Ressa, G. et al. Prophylactic intra-aortic balloon pump in transfemoral transcatheter aortic valve implantation. EuroIntervention, 2023, 19 (2), 188-190.
- Hausleiter, J., Stocker, T.J., Adamo, M., Karam, N., Swaans, M.J. Praz, F. et al. Mitral valve transcatheter edge-to-edge repair. EuroIntervention, 2023, 18 (12), 957-976.
- Adamo, M., Fiorelli, F., Melica, B., D'Ortona, R., Lupi, L., Giannini, C. et al. COAPT-Like Profile Predicts Long-Term Outcomes in Patients With Secondary Mitral Regurgitation Undergoing MitraClip Implantation. JACC Cardiovasc Interv, 2021, 14 (1), 15-25.
- Stone, G.W., Abraham, W.T., Lindenfeld, J., Kar, S., Grayburn, P.A., Lim, D.S. et al. Five-Year Follow-up after Transcatheter Repair of Secondary Mitral Regurgitation. N Engl J Med, 2023, 388 (22), 2037-2048.
- Doldi, P., Stolz, L., Orban, M., Karam, N., Praz, F., Kalbacher, D. et al. Transcatheter Mitral Valve Repair in Patiens With Atrial Functional Mitral Regurgitation. JACC Cardiovasc Imaging, 2022, 15 (11), 1843-1851.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.