Compte rendu de la session thématique organisée par le BWGACHD à l'occasion du congrès de la SBC 2016
Le profil des patients porteurs de cardiopathies congénitales (CHD, congenital heart disease) s'est profondément modifié au cours des vingt dernières années. De plus en plus d'enfants opérés atteignent l'âge adulte (entre 56 et 98 %, en fonction de la complexité de la cardiopathie).1 Les affections que présentent ces adultes congénitaux (ACHD, adult congenital heart disease) ont un décours clinique particulier, sont parfois plus difficiles à traiter et nécessitent une prise en charge particulière. Aussi, les interventions proposées sont de moins en moins invasives. Depuis quelques années, on voit même émerger un groupe de patients de plus de 60 ans. Les cardiopathies congénitales peuvent donc être considérées comme des 'affections de la vie entière'.2 Lors de cette session, organisée par le BWGACHD, quelques thèmes spécifiques autour de la prise en charge de ces patients ACHD ont été abordés, en particulier la transition, la prise en charge périopératoire et l'insuffisance cardiaque terminale.
Transition depuis la cardiologie pédiatrique: 'mind the gap'!
Exposé présenté par le Dr Eva Goossens, Academisch Centrum voor Verpleeg- en Vroedkunde, KU Leuven
Une bonne continuité des soins entre les services pédiatriques et adultes est capitale pour les patients porteurs de cardiopathies congénitales, et cette étape importante de la vie nécessite une vigilance accrue.1, 3
Transition et transfert des soins - La distinction
La transition se rapporte au processus entourant le passage de la pédiatrie aux soins adultes, et s'étale sur plusieurs années (figure 1). Durant cette période, les jeunes sont préparés à régir leur vie eux-mêmes, ainsi que leurs soins de santé.4 Ce processus ne peut être une rupture et doit débuter précocement au cours de l'adolescence, avec un accompagnement assuré par le cardiologue pédiatre au début, qui se prolonge ensuite par la prise en charge par le cardiologue adulte.
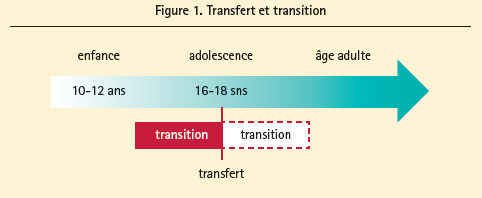
Le transfert constitue en revanche le moment effectif lors duquel les soins sont confiés aux différents services adultes, au départ de la pédiatrie (figure 1).4
Un bon suivi est capital durant le processus de transition, afin de continuer à offrir des soins corrects. Si ce suivi est insuffisant, il existe un risque que les patients souffrant de cardiopathie congénitale soient 'perdus de vue', et ne reçoivent ainsi pas les soins adéquats à l'âge adulte.
Care gaps
Un 'care gap' ou 'défaut de soin' correspond soit à une interruption du processus de soins, soit à un allongement de l'intervalle entre deux contrôles médicaux.2, 3, 5, 6 Il existe d'importantes différences régionales en ce qui concerne la survenue de 'care gaps' (p. ex. Allemagne 76 %, états-Unis 63 % et Belgique 7 %).7-9 Dans les études, les facteurs associés à la survenue de 'care gap' sont une complexité moindre de la cardiopathie, l'absence d'intervention chirurgicale cardiaque dans les antécédents, un suivi moins intensif, le sexe masculin et un statut socioéconomique inférieur. En outre, des facteurs tels que une information inadéquate au sujet de la nécessité du suivi, l'absence de symptômes, la crainte de mauvaises nouvelles et la perception que la responsabilité du suivi incombe aux soignants, constituent des obstacles importants menant à ces 'care gaps'.
Il existe également des facteurs capables de prévenir la survenue de 'care gaps'. A l'inverse, les facteurs prédisant un transfert réussi sont la confiance dans les soins adultes, l'autonomie lors des consultations, un bon comportement préventif en matière de santé et l'existence d'autres comorbidités.10
L'existence d'un 'care gap' triple la probabilité d'une intervention urgente.On note également un risque accru de symptômes et de problèmes cardiaques lors d'une consultation (urgente) ou d'une hospitalisation.7, 11 Entre-temps, une étude a également révélé que des programmes de transition adéquats, relatifs au suivi des enfants et des adultes souffrant d'une cardiopathie congénitale, sont associés à une meilleure survie.12
La chirurgie non cardiaque chez les patients souffrant d'une cardiopathie congénitale: que faut-il faire, que faut-il éviter?
Exposé présenté par le Dr Stefaan Bouchez, service d'Anesthésie, UZ Gent
De manière générale, les soins périopératoires ont beaucoup évolué ces dernières années. On a recours de plus en plus à des interventions ambulatoires plus courtes, moins invasives, malgré des pathologies plus complexes. Chez les patients souffrant d'une ACHD, la stratégie anesthésique doit également être adaptée. Dix-huit pour cent des patients souffrant d'une ACHD décèdent d'une complication périopératoire.13 A côté de l'insuffisance cardiaque et des problèmes rythmiques menant parfois à des morts subites, ces complications périopératoires sont donc une importante cause de mortalité. Les anomalies cardiovasculaires sous-jacentes chez les patients souffrant d'une ACHD sont très complexes et hétérogènes. Ces patients présentent un risque accru d'arythmies, de lésions vasculaires, de shunts, d'anomalies valvulaires et d'hypertension pulmonaire.
La mise au point périopératoire d'un patient souffrant d'une ACHD nécessite de mettre en relation la pathologie sousjacente, le type de chirurgie et l'influence hémodynamique de l'anesthésie. Une erreur fréquente consiste à penser qu'une chirurgie mini-invasive a un impact moins important sur l'hémodynamique (par ex une inflation abdominale pour une célioscopie).
L'approche '4 step'
Pour préparer l'anesthésie d'un patient souffrant d'une ACHD, on utilise l'approche dite '4 step':
- définition de la pathologie sousjacente
- prédiction de la physiopathologie
- définition des objectifs hémodynamiques
- élaboration d'un plan de sauvetage
Il est essentiel de bien préparer l'anesthésie. à cet égard, il faut dresser avant l'intervention la carte des paramètres cardiaques impliqués, tels que la fonction cardiaque, la fonction valvulaire, les shunts résiduels et la physiologie (mono) ventriculaire. La connaissance des interventions cardiovasculaires précédentes est essentielle sur ce plan. En outre, il est important d'évaluer la capacité à l'effort ainsi que le fonctionnement des dispositifs implantés (pacemakers et défibrillateurs). Une bonne préparation permettra d'anticiper les problèmes durant la chirurgie (arythmies, hypotension, cyanose). Une consultation pré-anesthésie est dès lors toujours indiquée. En fin de compte, les résultats sont analysés en concertation pluridisciplinaire, après quoi on peut définir un plan individuel.
En pratique
Le Dr Bouchez a présenté deux exemples pour illustrer l'approche '4 step'.
Cas 1: Une patiente de 30 ans souffrant d'une communication interventriculaire (CIV) non corrigée et d'hypertension pulmonaire (HTP) se présente aux urgences en raison d'un abcès cérébral. Chez cette patiente souffrant d'HTP, il est important de garder une pression systémique élevée et une pression pulmonaire basse pendant la chirurgie. Ceci permet d'éviter un shunt droite-gauche à travers la CIV, avec une cyanose et un risque d'embolisation paradoxale. Pour atteindre cet objectif, on peut envisager l'utilisation d'agents inotropes, et on donnera la préférence à une ventilation en pression contrôlée. Il faut prévoir un bon monitoring hémodynamique avec une ligne artérielle et l'utilisation de filtres à air.
Cas 2: Un patient âgé de 30 ans présentant une circulation de type Fontan (avec une atrésie sous-jacente de la valve tricuspide) s'est rendu aux urgences en raison d'un tableau d'appendicite. Chez les patients présentant une circulation de Fontan, il faut tenir compte de la nécessité d'une pression intrapulmonaire basse afin de pouvoir garantir un flux adéquat vers les poumons. La prudence est dès lors de rigueur lors d'interventions susceptibles d'augmenter la pression intrapulmonaire (p. ex. PEEP, élévation du CO2). Il peut dès lors être nécessaire d'administrer du NO lors de la ventilation et/ou de la Milrinone. En cas de circulation de Fontan, il faut également se montrer prudent lors d'interventions qui augmentent la pression intra-abdominale, comme une laparoscopie. Ces interventions entraînent une compression de la veine cave inférieure, ce qui réduit le retour veineux. Si nécessaire, on peut évaluer la précharge au moyen d'une ETO peropératoire.
Après l'anesthésie, il va de soi qu'il est important de continuer à surveiller les fonctions vitales, idéalement au moyen de valeurs établies au préalable. Il ne faut pas non plus oublier de contrôler et de réinitialiser d'éventuels dispositifs implantés (pace, AICD,…).
Jusqu'à présent, il n'existe pas de recommandations officielles consacrées spécifiquement à l'anesthésie chez les patients souffrant d'une ACHD. S'agissant d'une prise en charge complexe et spécifique, il est conseillé que cette anesthésie soit toujours pratiquée sous la supervision d'un anesthésiste ayant l'expérience des ACHD, ou en concertation avec celui-ci. Le rôle des centres experts est de ce point de vue important.
Le traitement de l'insuffisance cardiaque terminale en cas d'ACHD - quelles sont les options?
Exposé présenté par le Prof. Dr Asif Hasan, département de Chirurgie cardiaque, Newcastle upon Tyne, Royaume-Uni
L'insuffisance cardiaque est un problème majeur pour les patients porteurs de cardiopathie congénitale, et une source importante de morbidité et de mortalité. Après la mort subite d'origine rythmique, elle constitue la deuxième cause de mortalité chez les patients souffrant d'une ACHD. Le Prof. Hasan illustre les options thérapeutiques pour l'insuffisance cardiaque terminale à travers deux cas cliniques.
Le premier cas concerne un jeune homme présentant une circulation de Fontan (consécutive à une atrésie de la valve tricuspide), qui souffrait d'insuffisance cardiaque terminale, à l'âge de 28 ans. Au bout d'une longue hospitalisation grevée de plusieurs complications (dont un AVC), il a bénéficié avec succès d'une transplantation cardiaque. Le deuxième cas concerne une jeune femme souffrant d'une transposition des gros vaisseaux, pour laquelle une intervention de switch atrial avait été réalisée durant l'enfance. Par le suite, elle a développé une cardiomyopathie du péripartum, ayant mené à l'implantation d'un dispositif d'assistance (Heartware) pour soutenir son ventricule droit systémique, dans l'attente d'une transplantation cardiaque. Par le suite cette patiente a pu bénéficier d'une transplantation cardiaque.
L'assistance ventriculaire et la transplantation cardiaque sont des options thérapeutiques à envisager chez des patients sélectionnés souffrant d'une ACHD. Bien que la transplantation cardiaque chez ces patients soit grevée d'une mortalité comparativement plus élevée en phase initiale (20-30 %), le devenir au long cours de ces patients est excellent (74 % de survie à 20 ans), un résultat meilleur que pour d'autres groupes de patients transplantés. 14, 15 Cette observation est probablement liée à l'âge plus jeune des patients congénitaux transplantés. Il existe néanmoins de nombreux obstacles à la réalisation d'une transplantation chez eux, dont anatomiques ou immunologiques, étant souvent déjà multiopérés et transfusés. Chez les patients présentant une circulation de Fontan, le score MELDXi (Model for End stage Liver Disease eXcluding INR) reflétant la fonction hépatique semble un paramètre fiable pour évaluer le risque de décès au cours de la phase initiale après transplantation cardiaque.16, 17 On considère qu'un score égal ou supérieur à 12 est associé à un risque élevé.
Conclusion
La prise en charge des patients souffrant d'une ACHD est complexe et nécessite une attention particulière tout au long de leur vie. Bien qu'il existe de nombreux obstacles, les résultats de techniques de support circulatoire et de transplantation semblent excellents à long terme chez ces patients. Pour assurer une prise en charge optimale de ces patient, et en l'absence de recommandations claires à ce jour, nous soulignons qu'une étroite collaboration entre les différentes disciplines tant pédiatriques que adultes est nécessaire. Une prise en charge spécialisée pour cette population spécifique de patients doit être proposée.
Références
- Moons, P., Bovijn, L., Budts, W., Belmans, A., and Gewillig, M. Temporal trends in survival to adulthood among patients born with congenital heart disease from 1970 to 1992 in Belgium. Circulation, 2010, 122 (22), 2264-2272.
- Baumgartner, H. Geriatric congenital heart disease: a new challenge in the care of adults with congenital heart disease? Eur Heart J, 2014, 36 (11), 683-685.
- Warnes, C. A., Williams, R. G., Bashore, T. M., Child, J. S., Connolly, H. M., Dearani, J. A. et al. ACC/AHA 2008 Guidelines for the Management of AdultsWith Congenital Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Develop Guidelines on the Management of AdultsWith Congenital Heart Disease): Developed in Collaboration With the American Society of Echocardiography, Heart Rhythm Society, International Society for Adult Congenital Heart Disease, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Circulation, 2008, 118 (23), e714-e833.
- Knauth, A., Verstappen, A., Reiss, J., Webb, G.D. Transition and Transfer from Pediatric to Adult Care of the Young Adult with Complex Congenital Heart Disease. Cardiol Clin, 2006, 24, 619-629.
- Deanfield, J. Management of Grown Up Congenital Heart Disease. Eur Heart J, 2003, 24 (11), 1035-1084.
- Sable, C., Foster, E., Uzark, K., Bjornsen, K., Canobbio, M.M., Connolly, H.M. et al. on behalf of the American Heart Association Congenital Heart Defects Committee of the Council on Cardiovascular Disease in the Young, Council on Cardiovascular Nursing, Council on Clinical Cardiology, and Council on Peripheral Vascular Disease. Best Practices in Managing Transition to Adulthood for Adolescents With Congenital Heart Disease: The Transition Process andMedical and Psychosocial Issues: A Scientific Statement From the American Heart Association. Circulation, 2011, 123 (13), 1454-1485.
- Goossens, E. Predictors of care gaps in adolescents with complex chronic condition transitioning to adulthood. Pediatrics, 2016, doi: 10.1542/ peds.2008-1536.
- Yeung, E., Kay, J., Roosevelt, G.E., Brandon, M., Yetman, A.T. Lapse of care as a predictor for morbidity in adults with congenital heart disease. Int J Cardioli>, 2008, 125 (1), 62-65.
- Wacker, A., Kaemmerer, H., Hollweck, R., Hauser, M., Deutsch, M.R., Brodherr-Heberlein, S. et al. Outcome of operated and unoperated adults with congenital cardiac disease lost to follow-up for more than five years. Am J Cardiol, 2015, 95 (6), 76-779.
- Goossens, E., Stephani, I., Hilderson, D., Gewillig, M., Budts,W., Van Deyk,W.,Moons, P. Transfer of Adolescents With Congenital Heart Disease From Pediatric Cardiology to Adult Health Care. J Am Coll Cardiol, 2011, 57 (23), 2368-2374.
- Iversen, K., Vejlstrup, N., Sondergaard, L., Nielsen, O. Screening of adults with congenital cardiac disease lost for follow-up. Cardiol Young, 2015, 17 (6), 601-808.
- Mylotte, D., Pilote, L., Ionescu-Ittu, R., Abrahamowicz, M., Khairy, P., Therrien, J. et al. Specialized Adult Congenital Heart Disease Care: The Impact of Policy on Mortality. Circulation, 2014, 129 (18), 1804-1812.
- Oechslin, E. N., Harrison, D. A., Connelly, M. S., Webb, G. D., Siu, S.C. Mode of death in adultswith congenital heart disease. Am J Cardiol, 2000, 86 (10), 1111-1116.
- Irving, C., Parry, G., O'Sullivan, J., Dark, J.H., Kirk, R., Crossland, D.S. et al. Cardiac transplantation in adults with congenital heart disease. Heart, 2010, 96 (15), 1217-1222.
- Lund, L.H., Edwards, L.B., Kucheryavaya, A.Y., Benden, C., Christie, J.D., Dipchand, A.I., et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-first Official Adult Heart Transplant Report—2014; Focus Theme: Retransplantation. J Heart Lung Transplant, 2014, 33 (10), 996-1008.
- Assenza, G.E., Graham, D.A., Landzberg,M.J., Valente, A.M., Singh, M.N., Bashir, A. et al. MELD-XI score and cardiac mortality or transplantation in patients after Fontan surgery. Heart, 2013, 99 (7), 491-496.
- Grimm, J.C., Magruder, J., Valero, V., Kilic, A., Whitman, G.J., Tedford, R.J. et al. MELD-XI Score Predicts Early and Late Mortality in Patients Following Heart Transplantation. J Heart Lung Transplant, 2015, 34 (4), S62.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.