Cas clinique
Une patiente de 77 ans nous a été adressée pour chirurgie cardiaque urgente. Son principal antécédent médical date de 2004, lorsqu'elle avait subi une chirurgie cardiaque consistant en l'implantation d'une prothèse valvulaire aortique mécanique (St. Jude 21 Regent) pour sténose valvulaire aortique critique, et en un CABG réalisé au moyen d'un greffon veineux sur la coronaire droite. On avait instauré un traitement d'entretien par phenprocoumone (INR cible 2,5-3,5), bisoprolol, ramipril et atorvastatine.
L'histoire actuelle de la maladie commence par une fracture traumatique du condyle fémoral latéral droit, traitée par réduction ouverte et fixation interne (ORIF) dans l'hôpital référent. L'évaluation cardiaque préopératoire était favorable avec, à l'échocardiographie, une hypertrophie ventriculaire gauche avec préservation de la fonction systolique et une fonction normale de la valve aortique artificielle. Le traitement par phenprocoumone a été interrompu, et remplacé par une héparine à bas poids moléculaire (HBPM) (énoxaparine, 2 x 60 mg/jour).
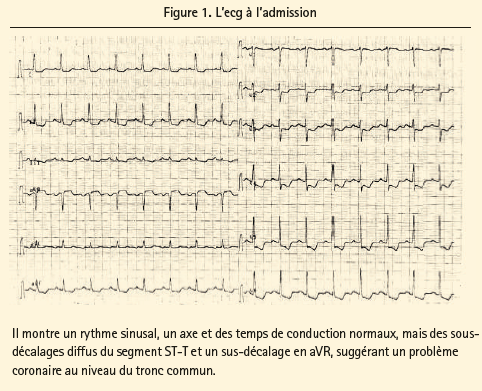
Durant sa revalidation, 6 semaines après la chirurgie de la hanche, la patiente a développé des plaintes angineuses, associées à une modification de l'ecg avec sus-décalage du segment ST en aVR et par ailleurs un sous-décalage diffus du segment ST avec négativation des ondes T (figure 1). L'analyse de sang montrait une légère élévation de la troponine I ultrasensible, à 0,259 ng/ml (norme < 0,019). À la coronarographie, on a observé une athéromatose du tronc commun, une occlusion de la coronaire droite avec un pontage veineux perméable, une sténose à 50 % de la portion médiane de l'IVA et une sténose à 70-90 % de la portion médiane de la circonflexe. À l'échocardiographie, la fonction systolique restait préservée, mais on a visualisé une sténose de la valve aortique artificielle avec un gradient maximal/moyen de 105/58 mmHg et une insuffisance valvulaire aortique de grade 2/4.
On a posé le diagnostic de maladie tritronculaire avec sévère calcification de la prothèse valvulaire aortique, et la patiente a été réorientée pour une reprise urgente de la chirurgie valvulaire aortique et du CABG.
Lors de son arrivée dans notre centre, la patiente présentait une récidive de ses plaintes angineuses, sa tension artérielle était normale-haute, et elle était afébrile. Les bruits cardiaques étaient assourdis, sans clics clairs, et on auscultait un souffle systolique au niveau du trajet de l'aorte.
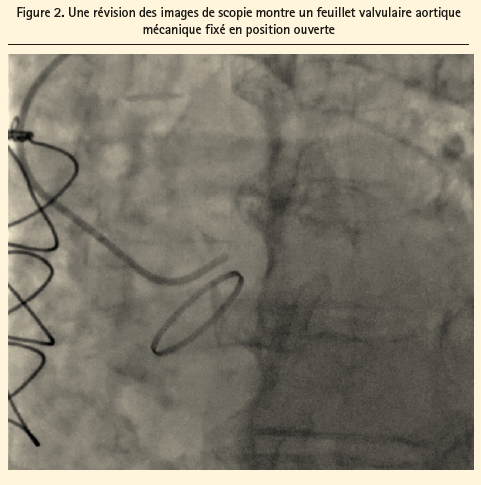
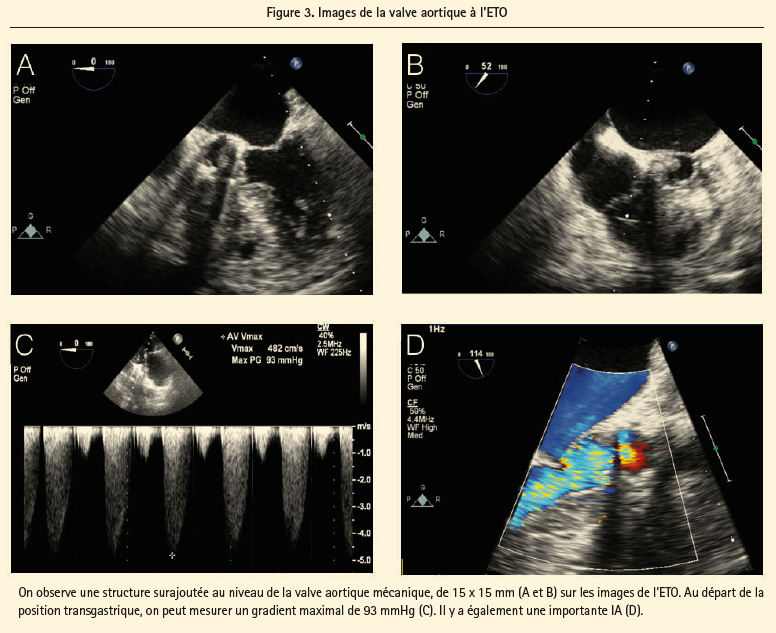
On a procédé à une nouvelle analyse de l'angiographie du centre référent, qui a révélé qu'un des deux feuillets valvulaires aortiques mécaniques était pratiquement fixé en position ouverte (figure 2). Une échocardiographie transoesophagienne (ETO) complémentaire a montré un thrombus sur un feuillet immobile de la valve aortique artificielle avec, secondairement, une forte élévation du gradient maximal, mesuré à 93 mmHg, ainsi qu'une fuite modérée à sévère (figure 3). Par ailleurs, on notait des fuites modérées à sévères au niveau des valves mitrale et tricuspide.
Après une concertation pluridisciplinaire entre les cardiologues, les chirurgiens cardiaques, les intensivistes et la patiente elle-même, on a décidé d'administrer une thrombolyse (altéplase), suivie d'un traitement d'entretien par héparine intraveineuse. La thrombolyse a été compliquée d'un important saignement au niveau de l'artère fémorale superficielle droite (la voie d'accès de la coronarographie de la veille). Les radiologues interventionnels et les chirurgiens vasculaires ont pratiqué un coiling, avec un bon résultat.
Après la thrombolyse, les plaintes angineuses ont rapidement régressé, et l'ecg s'est normalisé. L'ETO de contrôle a montré un bon fonctionnement de la prothèse valvulaire aortique mécanique, avec deux feuillets valvulaires mobiles et un gradient maximal de 24 mmHg. Par ailleurs, on ne notait plus qu'une insuffisance valvulaire légère, et les fuites (vraisemblablement secondaires) au niveau des valves mitrale et tricuspide étaient aussi nettement améliorées après la thrombolyse. Les clics caractéristiques de la prothèse valvulaire mécanique étaient à nouveau audibles.
Le traitement par phenprocoumone a pu être repris et, après la poursuite de sa revalidation, la patiente a pu quitter l'hôpital en bon état général.
Thrombose d'une prothèse valvulaire
Introduction
La thrombose d'une prothèse valvulaire cardiaque est une complication rare, mais sévère, grevée d'une morbi-mortalité significative.1 En cas de prothèses valvulaires mécaniques, l'incidence est estimée à 0,3 % à 1,3 % par année-patient.2 De manière générale, on considère que la thrombose d'une prothèse valvulaire biologique est encore plus rare, bien que des données plus récentes suggèrent qu'elle se produit plus fréquemment que ce qu'on avait supposé initialement.3 La nouvelle catégorie des prothèses valvulaires, les remplacements valvulaires aortiques transcathéter (TAVR), peut également être sujette aux thromboses, mais des études ultérieures devront apporter davantage de clarté à ce sujet.4
La survenue d'une thrombose est déterminée par différents facteurs. Avant tout, la biocompatibilité de la prothèse et l'interaction avec le site d'insertion jouent un rôle. La vitesse d'endothélialisation de la valve est également importante. Enfin, un flux turbulent et la stase constituent aussi des facteurs prédisposants. De ce fait, les thromboses valvulaires droites sont plus fréquentes que les thromboses gauches, et une thrombose d'une valve mitrale artificielle est plus fréquente qu'une thrombose d'une valve aortique. Les situations associées à une hypercoagulabilité (p. ex. infection, déshydratation, grossesse, FA) et l'interruption des anticoagulants (p. ex. pour la réalisation d'une chirurgie non cardiaque) impliquent un risque élevé pour les patients porteurs de prothèses valvulaires, et nécessitent une attention et un suivi particuliers.5-7 Dans le cas clinique présent, la patiente avait reçu une anticoagulation insuffisante au cours de la phase périopératoire (voir ci-dessous).
Clinique
Le tableau clinique est très variable, allant d'un état asymptomatique à l'insuffisance cardiaque aiguë ou à des symptômes emboligènes. La clinique est également déterminée par le degré d'obstruction provoquée par le thrombus. En cas d'obstruction partielle, on observe souvent des plaintes de fatigue, d'angor ou de dyspnée, tandis qu'une obstruction complète peut être associée à une instabilité hémodynamique.6
Lors de l'examen clinique, il est important d'être attentif à la présence - ou non - des 'clics' typiques d'une prothèse mécanique et à l'apparition de nouveaux souffles.
Dans le cas clinique présent, la patiente avait développé des plaintes angineuses et, cliniquement, on n'auscultait plus de bruits valvulaires nets.
Diagnostic
Il est important de penser à ce diagnostic chez tout patient porteur d'une prothèse valvulaire (quelle qu'en soit la nature) qui développe des plaintes de dyspnée, d'angor, ou des problèmes emboligènes. La mise au point diagnostique englobe une fluoroscopie ainsi qu'une échocardiographie transthoracique et transoesophagienne.
En cas de prothèses valvulaires mécaniques, la fluoroscopie permet de visualiser la mobilité des feuillets valvulaires. L'échocardiographie transthoracique permet de visualiser le thrombus, d'évaluer la mobilité valvulaire, de calculer les gradients transvalvulaires et de rechercher des insuffisances valvulaires. Toutefois, l'évaluation échocardiographique des valves mécaniques n'est pas toujours facile et nécessite de l'expérience. L'échocardiographie transoesophagienne permet souvent d'obtenir une image plus détaillée de la valve artificielle, et de mesurer la taille du thrombus. Ceci est également déterminant pour la stratégie thérapeutique: la tendance est plutôt au traitement chirurgical de grands thrombi, et au traitement de plus petits thrombi par fibrinolyse.1, 6, 8 Par ailleurs, il est important de faire la distinction entre des thrombi et un pannus fibreux, surtout en position aortique. La formation d'un pannus s'observe typiquement au niveau de l'anneau, et l'évolution clinique est plus progressive.9
Prévention
Un traitement d'entretien par anticoagulants oraux est indiqué, et la valeur cible de l'INR atteint 2,5-3,5 pour les patients à risque faible à intermédiaire. Il est nécessaire d'interrompre les anticoagulants en cas de chirurgie impliquant un risque hémorragique élevé et, dans ce cas, un relais par héparine est indiqué.8 Sur ce plan, l'administration intraveineuse d'héparine non fractionnée emporte la préférence. L'administration sous-cutanée d'HBPM à dose thérapeutique constitue une alternative, mais son utilisation est toutefois peu étayée scientifiquement et repose surtout sur des études observationnelles. Si on utilise des HBPM, il faut, si possible, suivre l'activité anti-Xa, avec une valeur cible comprise entre 0,5 et 1,0 UI/ml.8
Traitement
Le traitement d'une thrombose valvulaire doit être évalué individuellement. Parmi les options thérapeutiques possibles, citons la chirurgie, la fibrinolyse, l'héparine ou l'optimisation des anticoagulants. Chaque possibilité implique des risques. Le choix est déterminé par la présence d'une obstruction valvulaire, sa localisation, la taille du thrombus, la clinique et le patient lui-même.1, 6, 8
En cas de thrombus obstructif, il y a une indication de chirurgie urgente ou de thrombolyse. Le choix de la stratégie thérapeutique reste controversé: il n'existe pas de RCT prospectives ayant comparé la chirurgie et la thrombolyse.6 La fibrinolyse est associée à un risque élevé d'hémorragies, d'embolies systémiques et de récidive de thrombose.1
Les recommandations de la European Society of Cardiology préconisent une nouvelle intervention chirurgicale si l'état du patient est critique, en l'absence de comorbidités importantes.8 La thrombolyse est indiquée en cas de comorbidités importantes ou si le patient présentait déjà une importante diminution de la fonction cardiaque avant la thrombose.8 Le succès de la thrombolyse est plus large en cas de thrombi droits, de thromboses aiguës et en l'absence de pannus. On conseille de suivre le résultat au moyen d'ETO.6, 8, 10
En cas de thrombose non obstructive, le choix du traitement dépend de la taille du thrombus et de la présence - ou non - d'événements thrombo-emboliques. On donne la préférence à un traitement médicamenteux en cas de petits thrombi. En cas de thrombus non obstructif supérieur à 10 mm avec embolisations, il faut envisager la chirurgie.8
Conclusion
Ce cas illustre la diversité de la clinique d'une thrombose valvulaire, surtout s'il existe également une atteinte coronarienne et si l'ecg suggère une ischémie. En phase périopératoire, la prévention des thromboses valvulaires au moyen d'un traitement adéquat par héparine non fractionnée emporte la préférence. Par ailleurs, ce cas nous apprend qu'il faut toujours songer à une thrombose d'une valve artificielle en cas de modifications importantes de la symptomatologie. Le traitement reste pluridisciplinaire et implique en outre une évaluation des stratégies à haut risque, pour laquelle le patient a certainement aussi son mot à dire.
Références
- Roudaut, R., Serri, K., Lafitte, S. Thrombosis of prosthetic heart valves: diagnosis and therapeutic considerations. Heart, 2007, 93 (1), 137-142.
- Horstkotte, D., Burckardt, D. Prosthetic valve thrombosis. J Heart Valve Dis, 1995, 4, 141-153.
- Egbe, A.C., Pislaru, S.V., Pellikka, P.A., Poterucha, J.T., Schaff, H.V., Maleszewski J.J. et al. Bioprosthetic Valve Thrombosis Versus Structural Failure: Clinical and Echocardiographic Predictors. Am Coll Cardiol, 2015, 66 (21), 2285-2294.
- Miljoen, H., Van Herck, P., Paelinck, B. Possible Subclinical Leaflet Thrombosis in Bioprosthetic Aortic Valves. N Engl J Med, 2016, 374, 1590-1592.
- Gohlke-Bärwolf, C., Anticoagulation in valvar heart disease: new aspects and management during noncardiac surgery. Heart, 2000, 84 (5), 567-572.
- Biteker, M.., Altun, I., Basaran, O., Dogan, V., Yildirim, B., Erguna, G. Treatment of Prosthetic Valve Thrombosis: Current Evidence and Future Directions. J Clin Med Res, 2015, 7 (12), 932-936.
- Alshawabkeh, L., Economy, K.E., Valente, A.M. Anticoagulation during pregnancy: evolving strategies with a focus on mechanical valves. J Am Coll Cardiol, 2016, 68 (16), 1804-1813.
- The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Guidelines on the management of valvular heart disease (version 2012). Eur Heart J, 2012, 33, 2451-2496.
- Barbetseas, J., Nagueh, S.F., Pitsavos, C., Toutouzas, P.K., Quiñones, M.A., Zoghbi, W.A. Differentiating thrombus from pannus formation in obstructed mechanical prosthetic valves: an evaluation of clinical, transthoracic and transesophageal echocardiographic parameters. J Am Coll Cardiol, 1998, 32 (5), 1410-1417.
- Özkan, M., Kaymaz, C., Kirma, C., Sönmez, K., Özdemir, N., Balkanay, M. et al. Intravenous thrombolytic treatment of mechanical prosthetic valve thrombosis: a study using serial transesophageal echocardiography. J Am Coll Cardiol, 2000, 35 (7), 1881-1889.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.