Le foramen ovale perméable (FOP) est une entité clinique fréquente. La perméabilité de ce foramen permet une communication interauriculaire inhabituelle, qui est rarement associée à une embolie paradoxale, dont la physiopathologie peut s'expliquer par la survenue d'un shunt droit-gauche intracardiaque. Le diagnostic repose sur la réalisation d'une échographie transoesophagienne (ETO) de contraste avec injection de microbulles. Le traitement consiste si nécessaire en une fermeture du shunt par voie percutanée ou par chirurgie, en cas de situation complexe. Un traitement médicamenteux par anticoagulants est également envisageable. Le patient doit être éclairé sur les bénéfices et risques de chaque méthode, et le choix thérapeutique doit être posé en accord avec lui.
Introduction
La dyspnée est une cause fréquente de présentation aux urgences et repose souvent sur des pathologies chroniques, récidivantes (insuffisance cardiaque, crise d'asthme, déstabilisation de bronchopneumopathie chronique obstructive...). Mais lorsqu'elle est associée à des symptômes suggestifs d'ischémie artérielle, le diagnostic de foramen ovale perméable (FOP) doit être évoqué. Partir à la recherche de la cause de l'embolie paradoxale (le plus fréquemment une thrombose veineuse profonde) fait partie de la prise en charge, tout comme la confirmation du diagnostic par échographie transoesophagienne avec réalisation d'un test aux microbulles. Ce cas clinique a pour but de réviser une entité clinique fréquente, provoquant parfois des symptômes atypiques. Sa physiopathologie, prévalence ainsi que les moyens diagnostiques et thérapeutiques disponibles pour sa prise en charge seront évoqués.
Cas clinique
En décembre 2016, une patiente de 62 ans se présente au service des urgences pour dyspnée et douleur des deux membres inférieurs (d'abord à droite, puis à gauche), de plus en plus invalidante.
Elle avait été hospitalisée la semaine précédente pour douleurs précordiales atypiques et suspicion d'infarctus de type NSTEMI. L'électrocardiogramme 12 dérivations (ECG) réalisé à ce momentlà était suspect (onde T négative dans les dérivations V1 à V3) et la biologie sanguine attestait une élévation significative du taux de troponine (93 pg/ mL). La coronarographie était normale et l'échocardiographie transthoracique (ETT) sans particularité. La patiente était donc rentrée à domicile.
Elle présente les antécédents médicaux notables suivants: oesophagite de grade II, syndrome pulmonaire restrictif, syndrome des apnées du sommeil, phlébites superficielles et sclérose de varices ainsi qu'un diabète de type II et une hypothyroïdie. Son traitement actuel se compose de L-thyroxine®, Fluoxétine®, Xanax®, Pantomed® et Metformax®. Nous voyons cette patiente avec un examen clinique sans particularité. Il n'y a pas de signes de thrombose veineuse profonde et l'auscultation pulmonaire décrit un murmure vésiculaire symétrique. La patiente, dyspnéique mais non polypnéique, ne rapporte pas de fièvre, de toux, de crachats ou de douleur thoracique. La saturation en O2 est mesurée à 90 %. Aucune gazométrie n'a été réalisée. À la biologie sanguine, nous retenons un taux de D-dimères augmentés à 17,218 ng/mL (N: 19-440) et des troponines à 128,5 pg/mL (N <16).
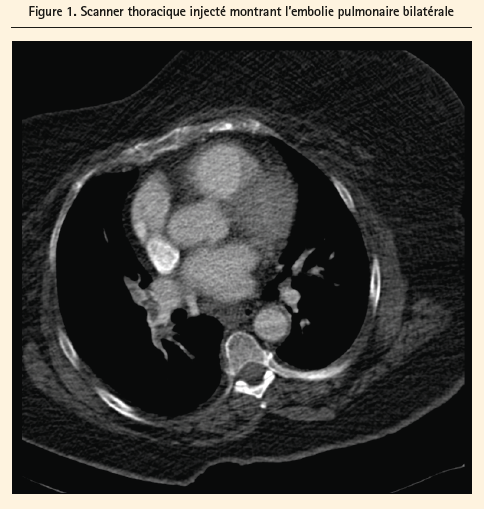
Un angioscanner thoracique, complété par le corps entier confirme la présence d'une embolie pulmonaire bilatérale massive ainsi que, du coté droit, une thrombose artérielle de l'artère poplitée distalement, de l'artère tibiale antérieure ainsi que du tronc tibio-fibulaire (figure 1). Du côté gauche, nous notons la présence d'une thrombose artérielle de l'artère iliaque externe et artère fémorale commune avec extension proximale vers l'artère fémorale superficielle, l'artère poplitée ainsi que le tronc tibio-fibulaire. L'ECG est sans particularité. Une radiographie de thorax est réalisée, ne montrant qu'une cardiomégalie. L'ETT est banale; l'examen ne permet pas d'objectiver des cavités droites dilatées, une insuffisance tricuspide, des signes d'hypertension artérielle pulmonaire ou la présence d'un shunt droit-gauche significatif. L'échographie des deux membres inférieurs ne montre pas de signe de thrombose veineuse profonde.
La suite de la prise en charge est chirurgicale, à savoir la réalisation d'une thrombectomie de l'artère iliaque externe gauche, de l'artère fémorale commune ainsi que de l'artère fémorale superficielle, selon la méthode de Fogarty. Une thrombectomie poplitée droite est également réalisée. La patiente séjourne alors quelques jours dans le service des soins intensifs pour traitement médical de l'embolie pulmonaire bilatérale et suivi post-opératoire.
Compte tenu du tableau d'embolie pulmonaire bilatérale massive ainsi que de la thrombose artérielle des deux membres inférieurs associée, l'hypothèse d'un FOP expliquant une embolie paradoxale vers les artères des membres inférieurs est avancée et confirmée par la réalisation d'une échographie transoesophagienne (ETO) qui objective un shunt atrial droit-gauche à hauteur du foramen ovale avec anévrysme du septum interauriculaire. Le test aux microbulles confirme l'existence du shunt spontané.
La question du traitement est alors évoquée. Les différents examens réalisés et le tableau clinique posent-ils l'indication de fermeture chirurgicale du foramen ou un traitement médical est-il suffisant? Nous opterons pour un traitement médical avec anticoagulants.
Discussion
Synthèse / management
Le diagnostic d'une embolie pulmonaire associé à celui d'une thrombose artérielle bilatérale au niveau des membres inférieurs confirmé par un scanner injecté permet de poser le diagnostic d'embolie paradoxale. Une ETO avec injection de microbulles met en évidence l'existence d'un FOP associé à un shunt droit-gauche, expliquant la symptomatologie clinique. Le FOP ne sera pas fermé de manière chirurgicale puisque minime, mais un traitement médical sera retenu.
Physiopathologie
Durant la vie embryonnaire, le foramen ovale permet le passage de sang oxygéné du coeur droit au coeur gauche. Il pourrait être décrit comme une fenêtre formée par la fusion partielle du septum primum et secundum. Au moment de la naissance, deux phénomènes se produisent: les alvéoles pulmonaires s'emplissent d'oxygène et les artérioles pulmonaires s'ouvrent, entrainant une diminution de la pression au sein du coeur droit. De plus, le volume de sang ramené par les veines pulmonaires au coeur gauche augmente, ce qui occasionne une augmentation de la pression du coeur gauche. Ces deux mécanismes entrainent la fermeture du flap au contact du septum secundum.
Cette fusion est complète à l'âge de deux ans chez 75 % des individus, alors que ce foramen reste perméable chez 25% des individus. Aucun facteur causal n'est à l'heure d'aujourd'hui identifié, mais des facteurs familiaux et génétiques pourraient jouer un rôle.1
Prévalence
Le foramen ovale perméable représente le defect structurel cardiaque le plus commun, à savoir qu'il est présent chez 25 % des individus. La prévalence ainsi que la taille de ce foramen (de 1 à 19 mm, en moyenne 4,9 mm) sont similaires chez l'homme et chez la femme.2 La plupart des patients porteurs d'un FOP sont asymptomatiques.
Manifestations cliniques
Même si la majorité des patients sont asymptomatiques, différentes manifestations cliniques sont possibles. Le patient pourrait présenter une embolie paradoxale ainsi qu'un accident vasculaire cérébral (AVC) cryptogénique. Un AVC est décrit comme cryptogénique lorsqu'il apparait en l'absence d'une source embolique artérielle identifiée. Quarante pourcent des AVC ischémiques sont classés comme cryptogéniques.
Le lien entre la migraine et la perméabilité du foramen ovale a été établi par différentes études.3 Même si un screening systématique à la recherche d'un FOP chez des patients migraineux n'est pas recommandé, la fermeture de ce FOP a été évoquée comme traitement contre la migraine. La seule étude randomisée réalisée à ce sujet n'a démontré aucun bénéfice de la fermeture percutanée du FOP sur le nombre de crises de migraines.4
Le patient pourrait également être victime d'une embolie gazeuse, surtout dans le cadre d'un accident de décompression. Celui-ci survenant notamment à l'occasion d'une plongée sous-marine, ou encore lors de décompressions des aviateurs en altitude. Il est lié à une baisse de la pression ambiante subie par le corps (à la suite d'une forte compression antérieure) et est expliqué par la dissolution d'un gaz inerte dans l'organisme, en l'occurence l'azote ou l'hélium dans le sang. Le passage d'un embole gazeux au travers d'un défect au niveau du septum atrial a été décrit pour la première fois chez un plongeur en 1986.5
Le syndrome de platypnée-orthodéoxie, une forme particulière (et rarissime) de dyspnée, a également été décrit comme ayant un lien avec un FOP.6 Cette entité clinique est caractérisée par la survenue en position debout d'une hypoxémie artérielle et d'une dyspnée qui s'amendent en décubitus. La physiopathologie de ce syndrome n'est pas complètement élucidée mais repose sur deux critères. Premièrement, la survenue d'un shunt droitgauche en général au niveau cardiaque via une communication interatriale, comme un FOP par exemple, et deuxièmement une implantation particulière de la veine cave inférieure présentant un flux vers le foramen ovale à cause du changement positionnel du septum interauriculaire en position debout.
Diagnostic
Différentes techniques peuvent détecter un shunt droit-gauche associé à un FOP: l'ETO, l'échographie intracardiaque (ICE), ainsi que l'IRM. Cette dernière technique étant peu utilisée compte tenu de son coût ainsi que de son manque de disponibilité. L'ETO est aujourd'hui considérée comme l'examen 'gold standard' pour aboutir au diagnostic et est habituellement pratiquée après l'injection veineuse de produit de contraste salin dans lequel on a préalablement provoqué une cavitation. C'est ce qu'on appelle le 'test aux microbulles'. Il permet de visualiser l'arrivage de microbulles dans l'oreillette gauche, attestant une communication interauriculaire. Le test est positif si plus de 5 bulles sont visibles rapidement dans l'oreillette gauche. Afin d'augmenter ce shunt, il peut être demandé au patient de tousser ou de réaliser une manoeuvre de Valsalva (qui augmenteront le retour veineux vers le coeur droit en élevant la pression intra-abdominale).
Au contraire de l'ETT, l'ETO permet de poser le diagnostic dans tous les cas, mais permet également une vision anatomique pré-interventionelle du foramen ovale. Elle permet par ailleurs le diagnostic d'autres anomalies souvent associées au FOP, comme par exemple un anévrysme du septum interauriculaire, un réseau de Chiari, un défaut septal auriculaire et l'anomalie d'Ebstein (atrésie tricuspide). La prudence est de mise lorsqu'il s'agit de traiter un FOP chez un patient ayant présenté un évènement ischémique, puisque le FOP n'en est pas toujours la cause. Connaissant la prévalence élevée d'un FOP au sein de la population générale, il est possible qu'il ne soit que spectateur (bystander) et que d'autres mécanismes soient responsables de l'AVC.
Traitement
Premièrement, il est important d'insister sur le fait que la découverte d'un FOP chez un patient asymptomatique n'est pas une indication de traitement spécifique. Toute prévention primaire doit donc absolument être évitée.
Afin de traiter un FOP chez un patient symptomatique, différentes options sont possibles.
Elles vont du traitement médicamenteux par anticoagulants et antiplaquettaires jusqu'à la fermeture percutanée ou chirurgicale du FOP. Les mesures hygiéno-diététiques comme la modification du régime alimentaire, l'exercice physique, l'usage de statines et le contrôle de l'hypertension artérielle ne peuvent être négligées.
En pratique, la plupart des patients sont traités par anticoagulants.
En ce qui concerne la réparation chirurgicale, elle peut s'effectuer à l'aide d'un patch de péricarde ou patch en dacron, mais une suture manuelle peut également être réalisée. La suture manuelle n'est généralement pas recommandée, à l'exception d'un patient présentant un tout petit défaut.7 La chirurgie reste utile dans les situations complexes où des défauts coexistent avec le FOP (anévrysme du septum interauriculaire, myxome de l'oreillette, anévrysme de l'aorte, péricardite constrictive) ou lorsque le défaut excède 25 mm.
Généralement, l'abord percutané se fait par voie veineuse fémorale et est indiqué en cas de deuxième épisode d'AVC cryptogénique, en cas de premier épisode d'embolie paradoxale ou lorsque l'anticoagulation est contre-indiquée chez le patient (par exemple en cas de grossesse, d'insuffisance rénale ou d'intolérance à un des excipients). De rares complications d'embolisation, infection, thrombose de matériel ou shunt persistant sont décrites. Afin de prévenir la formation d'un thrombus, un traitement antiplaquettaire est administré pendant minimum 6 mois.8, 9
Depuis quelques années, la fermeture du FOP par voie percutanée supplante la prise en charge chirurgicale en raison des résultats thérapeutiques équivalents avec un rapport morbi-mortalité et un coût nettement diminués (figure 2). Seules deux grandes études randomisées ont à ce jour été menées. L'étude 'PC trial' a échoué à prouver la supériorité de la fermeture percutanée du FOP par rapport au traitement médical unique.10 Contrairement à celle-ci, l'étude RESPECT, menée sur plus de 10 ans, a démontré une réduction de 54 % du risque relatif de présenter un nouvel AVC cryptogénique en faveur d'une prise en charge percutanée.11

La comparaison des différentes prises en charge et leur efficacité est à l'heure d'aujourd'hui toujours une source de débat. Nous pensons donc qu'il est pertinent d'engager une discussion avec le patient et de prendre la décision en accord avec celui-ci, après l'avoir éclairé sur les bénéfices et les risques de chaque prise en charge thérapeutique, qu'elle soit médicamenteuse, percutanée ou chirurgicale.
Conclusion
Le FOP est une entité clinique fréquente puisqu'elle est présente chez 25 % des individus. La plupart du temps, les patients porteurs de cette anomalie sont asymptomatiques. Néanmoins, il est important d'évoquer sa présence devant toute dyspnée accompagnée de signes d'ischémie artérielle (qu'elle soit périphérique ou de type AVC), attestant une embolie paradoxale. Sa physiopathologie repose sur un shunt droit-gauche persistant, intracardiaque. Il peut être mis en évidence à l'aide d'une ETO avec réalisation d'un test aux microbulles. La prise en charge se base soit sur un traitement médicamenteux, soit sur la fermeture du shunt intracardiaque via la mise en place d'une prothèse synthétique, par chirurgie ou par voie percutanée.
Références
- Arziquan, C., Coste, J., Touboul, P.J., Mas, J.L. Is patent foramen ovale a family trait? A transcranial Doppler sonographic study. Stroke, 2001, 32,1563-6.
- Hagen, P.T., Scholz, D.G., Edwards, D.W. Incidence and size of patent foramen ovale during the first 10 decades of life: an autopsy study of 965 normal hearts. Mayo Clin Proc, 1984, 59, 17-20.
- Anzola, G.P., Magoni, M., Guindani, M., Rozzini, L., Dalla Volta, G. Potential source of cerebral embolism in migraine with aura: a transcranial Doppler study. Neurology, 1999, 52, 1622-5.
- Dowson, A., Mullen, M.J., Peatfield, R. et al. Migraine Intervention With STARFlex Technology (MIST) trial: a prospective, multicenter, double-blind, sham-controlled trial to evaluate the effectiveness of patent foramen ovale closure with STARFlex septal repair implant to resolve refractory migraine headache. Circulation, 2008, 117, 1397-404.
- Wilmshurst, P.T., Ellis, B.G., Jenkins, B.S. Paradoxical gas embolism in a scuba diver with an atrial septal defect. Br Med J (Clin Res Ed), 1986, 293, 1277.
- Pierman, G., Marcovitch, O., Petit, P.-F., Doyen, M., Berghmans, M., de Meester, A. Une cause rare de dyspnée. VCP, 2016, 21, 14-8.
- Hopkins, R.A., Bert, A.A., Buchholz, B. et al. Surgical patch closure of atrial septal defects. Ann Thorac Surg, 2004, 77, 2144-9.
- Krumsdorf, U., Ostermayer, S., Billinger, K. et al. Incidence and clinical course of thrombus formation on atrial septal defect and patent foramen ovale closure devices in 1,000 consecutive patients. J Am Coll Cardiol, 2004, 43, 302-9.
- Brandt, R.R., Neumann, T., Neuzner, J. et al. Transcatheter closure of atrial septal defect and patent foramen ovale in adult patients using the Amplatzer occlusion device: no evidence for thrombus deposition with antiplatelet agents. J Am Soc Echocardiogr, 2002, 15, 1094-8.
- Meier, B., Kalesan, B., Mattle, H.P. et al., for the PC Trial Investigators. Percutaneous Closure of Patent Foramen Ovale in Cryptogenic Embolism. N Engl J Med, 2013, 368, 1083-1091
- Carroll, J.D., Saver, J.L., Thaler, D.E. et al. Closure of Patent Foramen Ovale versus Medical Therapy after Cryptogenic Stroke. N Engl J Med, 2013, 368, 1092- 1100.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.