La resynchronisation biventriculaire est une option majeure dans l'arsenal thérapeutique de l'insuffisance cardiaque, par dysfonction systolique (FEVG ≤ 35 %) et bloc de branche gauche, à l'origine d'un asynchronisme ventriculaire gauche. La technique est connue depuis 1994 et a fait l'objet de nombreuses publications, montrant que cette resynchronisation entraînait un bénéfice clinique en termes de qualité de vie, améliorait la fonction ventriculaire gauche par remodelage inverse et augmentait la survie de ces patients. L'évaluation de l'asynchronisme mécanique et l'optimalisation de la programmation biventriculaire par échographie n'a jamais pu bénéficier aux nombreux patients dits 'non répondeurs'. Les avancées technologiques récentes devraient permettre dans un futur proche de diminuer la proportion des patients 'non répondeurs' à ce mode de stimulation. Nous discutons dans cet article de certaines de ces avancées concernant les sondes de resynchronisation.
Malgré les innovations des dernières années (matériel, sonde IS4, stimulation quadripolaire, optimalisation de stimulation échographique), la resynchronisation reste un échec pour un groupe important de patients non-répondeurs (30-45 %).1 Différentes pistes ont été étudiés afin d'améliorer la technique: amélioration de la programmation par échographie, optimalisation de la position de la sonde VG, choix d'un vecteur optimal (unipolaire, bipolaire ou bipolaire étendu), mesure d'un délai AV efficace, stimulation multi- sites ...
Récemment, Brugada a publié les résultats de l'étude RESPOND avec le capteur SonR™ (LivaNova), micro-accéléromètre intégré dans l'extrémité de la sonde atriale SonRtip™ qui détecte les vibrations du muscle cardiaque, elles même corrélées à la dP/dt max du ventricule gauche.2 A partir du signal SonR™, un algorithme détermine les DAV et VV optimaux. Son efficacité est déterminée 'non inférieure' à une optimalisation du délai AV guidée par échocardiographie. Cette optimalisation est cependant automatique et individualisée, ce qui lui confère un bénéfice certain. Aucune méthode n'est efficace à 100 %.
Une approche multiple pourrait être proposée aussi comme celle suggérée avec la triade 'Where, When, How to pace?'.
1 'Where to pace?' Il faut pouvoir stimuler au site d'activation le plus tardif.
L'apport de sonde quadripolaire est une avancée majeure permettant avec les modèles plus récents une compatibilité IRM, des options de programmation multiples, une courbe spiralée pour la stabilisation, une fixation possible par un filetage en silicone, l'élution de stéroïdes (pour un meilleur seuil de stimulation) …
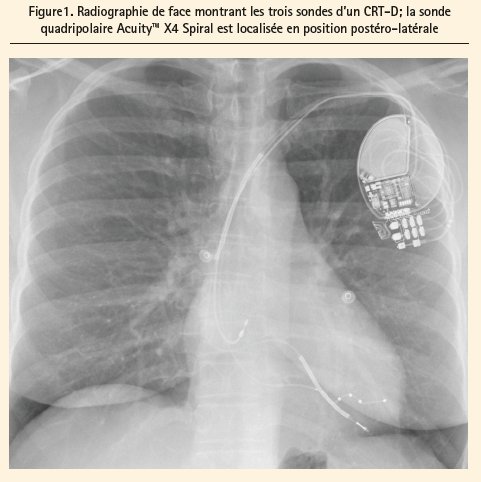
De plus, nous savons que la stimulation apicale n'est pas efficace contrairement aux positions latérales ou postéro-latérales, 3 qui sont à rechercher activement (figures 1 et 2). Les échecs de placement optimal sont dus à l'anatomie du sinus coronaire fort variable d'un patient à l'autre, ou l'absence de branche latérale, nécessitant une implantation épicardique. La stimulation phrénique est également responsable d'échec dans certains cas (surtout lors de stimulation avec les anciennes sondes bipolaires). Des études ont montré que le bénéfice d'une stimulation basale et optimale permettait une amélioration de la qualité de vie des patients et leur évolution.3, 4

La possibilité d'avoir différentes courbures et configurations des sondes est également capitale pour une stimulation optimale, comme illustré dans la figure 3. Philippon montre l'intérêt des différentes configurations (espacements entre électrodes) qui augmente encore les possibilités d'avoir un seuil de capture bas et l'efficacité de la stimulation.5
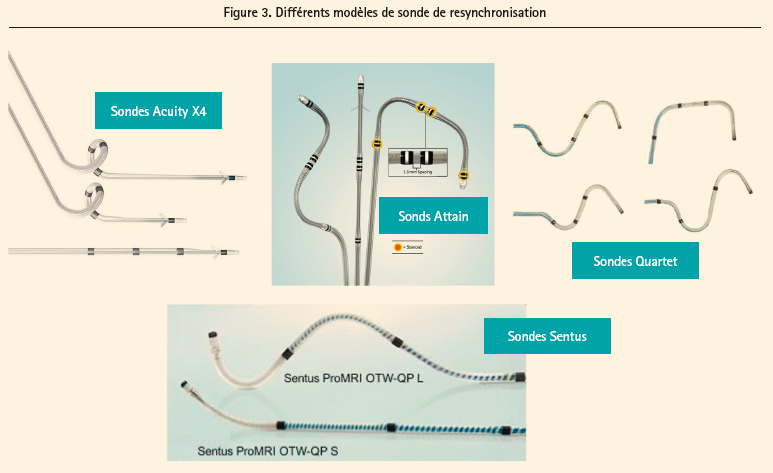
Certaines sondes avec différentes courbures, avec un faible écartement bipolaire (1,3 mm) sur VG2-VG3 permettent de réduire les stimulations phréniques La présence de stéroïdes sur toutes les électrodes peuvent améliorer les seuils de stimulation, augmenter la longévité de la pile et permettre plus de stimulation basale. Les courbures spiralées des sondes permettent une stabilité et évitent des déplacements de sondes.
Comme dit plus haut, la stimulation phrénique et un seuil de stimulation élevé sont associés avec un échec de la resynchronisation. La possibilité d'avoir plusieurs possibilités de vecteurs (jusqu'à 17 vecteurs) et de choisir le meilleur vecteur de stimulation (avec délai VD-VG maximal) est également une avancée technique importante.
Un délai VD-VG plus long est associé à 30 % de réduction de risque d'hospitalisation pour décompensation cardiaque ou de décès, ou sur des critères cliniques: taux de NT-proBNP, fraction d'éjection du VG, et évolution clinique.6, 7
2 'When to pace?' Choix du meilleur moment pour une contractilité globale maximale
L'optimalisation du délai AV rapide et automatique est recommandée pour tout patient, voire personnalisée (cf. guide par échographie, ou possibilité des firmes). L'idéal est ne plus avoir de monitoring échographique, … qui n'a pas montré de bénéfice clinique. D'autre part, nous savons que la stimulation ventriculaire droite peut être délétère. La firme Boston, avec son programme SmartDelay™, recommande la stimulation AV intrinsèque si la conduction de la branche droite est intacte ('If it's not broken, don't fix it.').
Ellenbogen a publié dans Circulation les données avec ce programme SmartDelay ™ montrant que cette programmation n'est pas inférieure à un délai AV fixe ou modifié selon l'échographie (au repos). La programmation est évidemment plus rapide et plus aisée (pour tout cardiologue clinique) en l'absence d'examen échographique.8 Ce système tient compte automatiquement des intervalles AV, du timing interventriculaire et de la position de la sonde VG.
Les guidelines ESC montrent par ailleurs une équivalence entre stimulation biventriculaire et stimulation VG unique. Dans les études PATH-CHF, CRTAVO, DECREASE HF et RENEWAL AVT, la stimulation VG seule est efficace. 9-12 Cette stimulation biventriculaire ou stimulation VG seule est documentée et optimalisée. Des modifications ou décalages de timing entre stimulation VD et VG sont aussi possibles (Timing Offsets); ces décalages vont de 0 à 100 msec selon les firmes.
Gold a récemment montré que les patients avec long délai VD-VG et sous la programmation SmartDelay™ ont un taux de réponse de la resynchronisation de 82 %, soit > 40 % de mieux que les données actuelles.13
3 'How to pace?' Optimaliser pour augmenter la réponse à la CRT
Comme discuté plus haut, la réponse à la CRT est de 70 % en moyenne. Une stimulation de 2 vecteurs de VG augmente ce taux de succès à 90 %.14 La possibilité de multiplier les vecteurs avec de nombreuses configurations de stimulation multi-sites permet une optimalisation thérapeutique et le fait d'éviter de devoir repositionner votre sonde VG. Comme la figure 4 le montre, les sondes actuellement disponibles sur le marché ont toutes des caractéristiques différents.

Plusieurs auteurs, dont Zanon, ont montré que la stimulation multi-sites (Multi- Point Pacing) diminuait les temps d'activation et la durée du QRS resynchronisé, diminuait de > 20 % l'asynchronisme mécanique, et augmentait de 84 % la contractilité du VG en aigu.
L'étude de Zanon, publiée dans Heart Rhythm 2016, confirme que les patients traités avec une optimalisation du délai AV et une stimulation multi-sites du VG ont une réponse de CRT favorable dans plus de 90 % des cas.15 On note une amélioration du remodeling du VG et une réponse clinique significative à un an de follow-up.
Tomassi a également montré l'importance de la stimulation multi-sites … avec la possibilité de stimulation espacée des électrodes (> 30 mm), décalage de 5 msec et de court délai AV, permettant une réponse clinique de plus de 87 %. D'autres études confirment également le bénéfice de la stimulation multi-sites (IRON-MPP 2016 et Pappone, Heart Rhythm 2015).
Conclusion
Les innovations récentes concernant une optimalisation de la resynchronisation cardiaque chez des patients avec dysfonction VG sévère, méritent la lecture de cet article. Les avancées techniques décrites plus haut permettent d'améliorer significativement le taux de patients 'répondeurs' à la resynchronisation.
Références
- Daubert, J.C., Saxon, L., Adamson, P.B. et al. Heart Rhythm 2012. 2012 EHRA/HRS expert consensus statement on cardiac resynchronization therapy in heart failure: implant and follow-up recommendations and management. Europace, 2012, 14, 1236-1286.
- Brugada, J., Delnoy, P.P., Brachmann, J. et al. Contractility sensor-guided optimization of cardiac resynchronization therapy: results from the RESPOND-CRT trial. Eur Heart J, 2017, 38, 730-738.
- Singh, J.P., Klein, H.U., Huang, D.T. et al. Left Ventricular Lead Position and Clinical Outcome in the Multicenter Automatic Defibrillator Implantation MADIT-CRT Trial. Circulation, 2011, 123, 1159-1166.
- Mittal, S., Nair, D., Padanilam, B. et al. Performance of Anatomically Designed Quadripolar Left Ventricular Leads: Results from the NAVIGATE X4 Clinical Trial. J Cardiovasc Electrophysiol, 2016, 27, 1199-1205.
- Philippon, F., Liu, L., Fung, J.W. et al. Left ventricular three-dimensional quadripolar lead acute clinical study: The LILAC study. Pacing Clin Electrophysiol, 2015, 38, 438-447.
- Gold, M., Day, J.D., Yu, Y. et al. The Role RV-LV Delay to Predict Time to First Heart Failure Hospitalization and Mortality with Cardiac Resynchronization Therapy. Results from the SMART-AV Trial. ESC 2014. Poster P3662.
- Kozlin, A., Kutyifa, V., Nagy, V.K. et al. Longer right to left ventricular activation delay at cardiac resynchronization therapy implantation is associated with improved clinical outcome in left bundle branch block patients. Europace, 2016, 18, 550-559.
- Ellenbogen K, Gold M, Meyer TE, et al. Primary Results from the SMART-AV Trial: A Randomized Trial Comparing Empiric, Echocardiographic Guided and Algorithmic AV Delay Programming in Cardiac Resynchronization Therapy (CRT). Circulation, 2010, 122, 2660-2668.
- Auricchio, A., Stellbrinck, C., Sack, S. et al. The Pacing Therapies for Congestive Heart Failure (PATH-CHF) Study, rationale design, and endpoints of a prospective randomized multicenter study. Am J Card, 1999, 83, 130-135.
- Gold, M.R., Niazi, I., Giudici, M. et al. A prospective comparison of AV delay programming methods for hemodynamic optimization during cardiac resynchronization therapy. J Cardiovasc Electrophysiol, 2007, 18, 490-496.
- Rao, R.K., Kumar, U.N., Schafer, J. et al. Reduced Ventricular Volumes and Improved Systolic Function With Cardiac Resynchronization Therapy: A Randomized Trial Comparing Simultaneous Biventricular Pacing, Sequential Biventricular Pacing, and Left Ventricular Pacing. Circulation, 2007, 115, 2136- 2144.
- Saxon, L.A., Greenfield, R.A., Crandall, B.G. et al. Results of the Multicenter RENEWAL 3 AVT Clinical Study of Cardiac Resynchronization Defibrillator Therapy in Patients With Paroxysmal Atrial Fibrillation. J Cardiovasc Electrophysiol, 2006, 17, 520-525
- Gold, M., Yu, Y., Singh, J.P. et al. The effect of left ventricular electrical delay on AV optimization for cardiac resynchronization therapy. Heart Rhythm, 2013, 10, 988-993.
- Zanon, F., Baracca, E., Pastore, G. et al. Multipoint pacing by a left ventricular quadripolar lead improves the acute hemodynamic response to CRT compared with conventional biventricular pacing at any site. Heart Rhythm, 2015, 12, 975-981.
- Zanon, F., Marcantoni, L., Baracca, E. et al. Optimization of left ventricular pacing site plus multipoint pacing improves remodeling and clinical response to cardiac resynchronization therapy at 1 year. Heart Rhythm, 2016, 13, 1644-1651.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.