Compte rendu de la session organisée par le Belgian Interdisciplinay Working Group on Acute Cardiology (BIWAC)
Ce 9 février 2018, la session organisée par le BIWAC a débuté par l'exposé du Prof. Stefan James (Uppasala University, SE) sur les nouvelles recommandations de l'European Society of Cardiology (ESC) pour la prise en charge de l'infarctus STEMI. Ensuite le Prof. Marc Claeys (UZ Antwerp, BE) a introduit comment les recommandations sont appliquées en Belgique par l'intermédiaire du rapport annuel de registre du STEMI. Finalement, le Prof. Christophe Beauloye (Cliniques Universitaires Saint-Luc, Brussels, BE) a mis en évidence certains points particuliers non-résolus dans les recommandation de l'ESC (gaps in evidence) en commentant un cas clinique de STEMI compliqué de choc cardiogénique (CC) présenté par le Dr Stijn Lochi (UZ Brussels, BE).
Top ten messages from the 2017 ESC STEMI guidelines
Le Prof. Stefan James est le chairman du comité de rédaction des recommandations pour la prise en charge de l'infarctus STEMI à l'ESC1. Il rappelle que le document comporte 159 recommandations basées sur 477 références. Il regrette que 49 % de ces recommandations aient un niveau d'évidence de classe C. Il insiste donc sur l'importance de réaliser plus de recherche et de produire plus d'évidence pour les recommandations futures.
De nouveaux concepts sont introduits dans ces recommandations 2017 (figure 1).


Ainsi, les différents délais du trajet de soin sont redéfinis. Le concept de 'door-to-balloon' a totalement disparu des recommandations. Il est remplacé par le 'time from STEMI diagnosis to treatment'. On distingue le 'patient delay' (délai entre l'apparition des symptômes et l'appel des services de secours) et le 'system delay' (délai inhérent au trajet de soins). Le 'first medical contact' est défini comme le contact du patient avec tout professionnel (médecin, infirmier, paramedic) capable de réaliser et d'interpréter un ECG pour le diagnostic de STEMI. Le temps '0' orientant la stratégie de reperfusion correspond à l'interprétation de l'ECG montrant une élévation du segment ST. Parmi les recommandations visant à réduire le 'system delay', on note l'importance d'un diagnostic préhospitalier, le transfert immédiat vers un centre d'angioplastie et le passage direct de l'ambulance vers la salle d'angioplastie. Si les patients se présentent dans un centre ne pratiquant pas l'angioplastie, le délai recommandé entre l'admission et le transfert du patient ('door-in to door-out time') est de 30 min.
L'angioplastie primaire est privilégiée par rapport à la fibrinolyse. Elle est recommandée dans tous les cas ou le délai anticipé entre le diagnostic de STEMI et le passage du filament dans la coronaire est estimé à moins de 120 min. Pour les patients présentant des symptômes d'infarctus avec une présentation ECG atypique (bloc de branche gauche ou droit, sus-décalage du segment ST en AVR et sous-décalage diffus, ondes T amples et symétriques …), une stratégie invasive immédiate est également recommandée. Il en va de même pour les patients avec des symptômes ischémiques et une instabilité hémodynamique (choc cardiogénique, TV/FV, insuffisance cardiaque aiguë, arrêt cardiaque) malgré l'absence de sus-décalage du segment ST. Compte tenu d'une réduction des complications vasculaires et hémorragiques, la voie d'accès radiale est recommandée. Les stents DES doivent être privilégiés par rapport aux BMS vu le risque moindre de thrombose aiguë. La thromboaspiration n'est plus recommandée vu l'effet neutre sur la mortalité. Dans les cas d'atteinte multitronculaire, le Prof. James souligne le débat concernant la stratégie de revascularisation des lésions 'non-culprit'. Les Guidelines proposent une revascularisation complète au cours d'une deuxième procédure pendant la même hospitalisation (staged revascularisation). Il reconnaît que le niveau d'évidence est faible et rappelle encore l'importance de réaliser de nouvelles études sur le sujet. Ce point sera plus tard développé par le Prof. Beauloye dans le cas particulier du choc cardiogénique.
Concernant le traitement antiplaquettaire, associés à l'acide acétylsalicylique, le prasugrel ou le ticagrelor sont préférés au clopidogrel. Le cangrelor est une alternative à la phase aiguë si les patients ne peuvent recevoir de traitement oral.
Dans les cas où la fibrinolyse est indiquée, le délai entre le diagnostic et le bolus de l'agent fibrinolytique doit être inférieur à 10 min. Le traitement est recommandé jusque 12 heures après le début des symptômes. Un traitement par clopidogrel est indiqué à partir de la 48ème heure.
La démarche diagnostique pour des patients avec un tableau clinique d'infarctus STEMI, sans sténose significative sur les artères épicardiques est décrite sous le nom MINOCA (Myocardial Infarctions with Non-Obstructive Coronary Arteries). Ces patients nécessitent une mise au point complémentaire (échographie cardiaque, lRM, CT-scan, biopsie endomyocardique, IVUS ou test à l'ergonovine) afin d'exclure des diagnostics différentiels, tels que infarctus de type II, atteinte microvasculaire, myocardite ou embolie pulmonaire.
Enfin, l'accent est mis sur l'importance d'un traitement hypolipémiant agressif en cas de LDL-c > 70 mg/dl associant une statine à la dose maximale à l'ézétimibe si nécessaire.
Ten years STEMI registry in Belgium
Le registre du STEMI du BIWAC a été initié il y a 10 ans par le Prof. Claeys, actuel Président de la BSC. Depuis le 01/01/2008, 24 272 patients ont été enregistrés dans 110 hôpitaux belges. Malheureusement, seuls 50 hôpitaux enrôlent plus de 10 patients par an. C'est une formidable banque de données reflétant le paysage cardiologique belge. Le Prof. Claeys insiste toutefois sur l'interprétation nuancée des résultats, la participation des hôpitaux se faisant sur base volontaire et non obligatoire.
Depuis 2008, plusieurs tendances ont été notées.
On remarque une diminution du score TIMI de 4,3 à 4, expliqué par une moindre proportion de CC et d'artérite périphérique. Le nombre total de STEMI traités par reperfusion a augmenté de 2008 à 2017. En particulier, le nombre d'angioplasties primaires a augmenté de 92 % à 98% dans les centres 'PCI' et de 64 % à 97 % dans les centres 'non-PCI'. La proportion de cas où le 'door-to-ballon time' excède 90 min. a malheureusement augmenté de 22 % en 2008 à 31 % en 2017. Cette augmentation est expliquée par la croissance du nombre de transfert des centres 'non-PCI' vers les centres 'PCI'. L'implémentation des nouvelles recommandations de l'ESC sur la prise en charge précoce des STEMI (diagnostic préhospitalier, réseau de soins et admission dans un centre PCI, transfert précoce …) devrait réduire ce délai. Approximativement 60 % des patients sont admis directement dans un centre 'PCI'. Les patients qui sont admis via le SMUR (2/3 cas) bénéficient d'une reperfusion plus précoce.
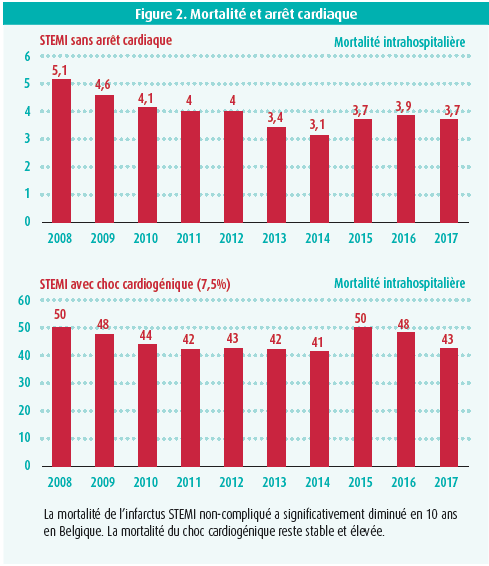
Après exclusion des CC et des arrêts cardiaques extrahospitaliers, la mortalité des STEMI a diminué de 5,5 % à 3,7 %, ce qui est conforme aux données de la littérature. Les facteurs de risque liés à la mortalité sont la classe Killip, une réanimation cardiopulmonaire, l'âge, l'absence de reperfusion, une durée d'ischémie supérieure à 12 heures et la présence d'une une artérite ou d'un diabète. Le pronostic du CC et de l'arrêt cardiaques reste très réservé avec des mortalités avoisinant les 40-50 % (figure 2).
How to manage the gaps in evidence in STEMI
Le Dr St. Lochi introduit la dernière présentation par la présentation d'un cas clinique complexe de STEMI compliqué d'un arrêt cardiaque extrahospitalier réfractaire.
Le Prof. Chr. Beauloye entame la discussion sur l'intérêt de l'ECPR (extra-corporeal corporeal resuscitation) dans ces situations d'arrêts cardiaques réfractaires. Compte tenu du pronostic neurologique très réservé, de la complexité technique, de l'utilisation de ressources médicales, du coût et de l'absence de données robustes dans la littérature soutenant l'ECPR, les indications devraient être très sélectives. Les candidats potentiels sont les patients jeunes (< 55 ans) présentant un arrêt cardiaque devant témoin, avec une réanimation cardiopulmonaire immédiate (No-flow < 3 min), dont le rythme initial est défibrillable (TV/FV) et une période de low-flow < 60 min.
Les Guidelines recommandent une angioplastie primaire en cas d'arrêt cardiaque avec une image de STEMI, et une stratégie invasive précoce 'primary-PCI like' en cas de haute suspicion d'ischémie myocardique même en l'absence de STEMI. Le Prof. Beauloye nuance cette stratégie à la lueur du pronostic de ces patients qui est très largement limité par les dégâts cérébraux. Les données de la littérature montre en effet une survie avec un bon status cérébral inférieure à 10 %. Il est donc accepté dans les recommandations 2017 de l'ESC que des éléments défavorables tels que un arrêt cardiaque sans témoin, une période de no-flow > 10 minutes, un rythme initial non-défibrillable et une période de lowflow > 20 minutes justifient le report de l'angiographie.
La voie d'accès radiale semble la meilleure approche dans de nombreuses études qui démontrent une diminution de la mortalité et des complications hémorragiques dans les ACS, et particulièrement dans le CC. à noter qu'en cas d'ECPR, les accès vasculaires sont restreints par la présence des canules fémorales, et que les complications hémorragiques sont particulièrement élevées compte tenu de la nécessité de maintenir une anticoagulation systémique et de la thrombopathie induite par le circuit extracorporel.
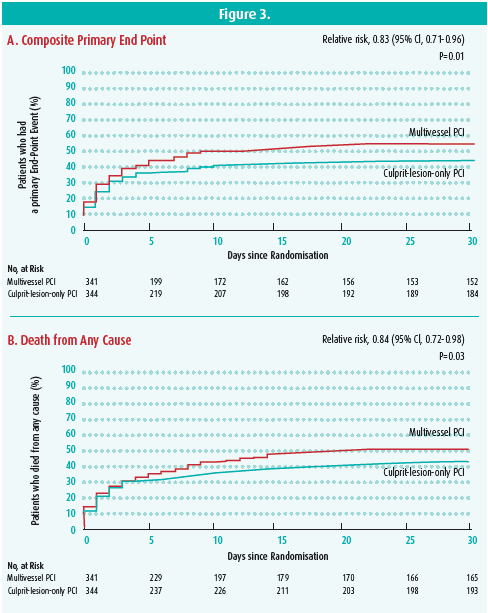
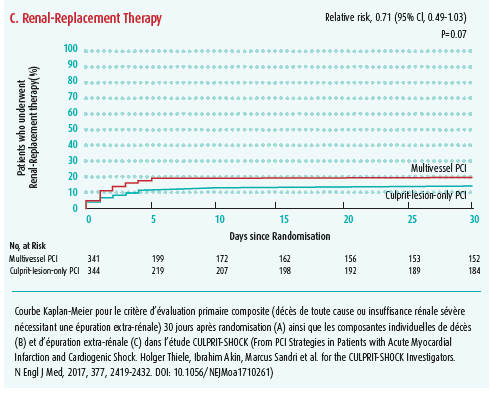
Un point particulièrement débattu dans les Guidelines de l'ESC concerne la stratégie revascularisation en cas de STEMI avec une maladie pluritronculaire. Pour rappel, il est recommandé de réaliser une revascularisation complète au cours d'une deuxième procédure durant la même hospitalisation. Cependant, cette proposition repose sur des études comprenant un nombre limité de sujets (PRAMI, CvLPRIT, DANAMI et Compare-Acute) montrant une réduction des récidives ischémiques mais pas de la mortalité. Par ailleurs, la revascularisation de toutes les lésions sténosantes est recommandée par l'ESC en cas de CC, ce qui est en opposition avec les résultats de l'étude CULPRIT-SCHOCK2 publiée récemment. Dans cette étude randomisée de plus de 700 patients, les patients chez qui une revascularisation complète était réalisée au cours de l'angiographie d'admission avaient un excès de mortalité à 30 jours par rapport à ceux chez qui était réalisée une revascularisation limitée à la lésion culprit (figure 3). Le Prof. Beauloye explique cette différence par un risque de thrombose de stent accru dans le CC lié à l'état pro-infammatoire et prothrombotique inhérent au choc, à la difficulté de traiter des lésions coronaires dans un contexte de bas débit cardiaque et d'hypotension artérielle ou encore à l'excès d'insuffisance rénale lié au produit de contraste.
Enfin, compte tenu du risque accru de d'hémorragie et de thrombose de stent dans le CC, une attention particulière doit être portée aux traitements antiagrégants plaquettaires et anticoagulants. L'administration orale des inhibiteurs des récepteurs P2Y12 est compliquée chez des patients sous sédation et ventilation mécanique. Elle requiert l'utilisation d'une sonde gastrique. L'absorption est retardée dans un tableau de choc et d'hypotension artérielle. Le ticagrelor et le prasugrel semblent offrir un avantage par rapport au clopidogrel. Ce dernier nécessite une métabolisation hépatique qui peut être compromise en cas d'hépatite hypoxique. Le cangrelor, un inhibiteur des récepteurs P2Y12 administré par voie parentérale, est efficace dans les ACS mais il n'existe pas de données dans le CC. Les antagonistes des récepteurs GPIIBIIIa par voie parentérale sont également une alternative efficace mais entraînent un risque hémorragique accru. L'anticoagulation par bivaluridine n'a pas démontré de supériorité par rapport à l'héparine. Dans le contexte particulier d'ECPR, le risque d'insuffisance rénale aiguë et la nécessité d'anticoagulation systémique soutiennent l'utilisation de l'héparine non-fractionnée.
Références
- Ibanez, B., James, S., Agewall, S., et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J, 2018, 39, 119-177.
- Thiele, H., Akin, I., Sandri, M., et al. PCI Strategies in Patients with Acute Myocardial Infarction and Cardiogenic Shock. N Engl J Med, 2017, 377, 2419-2432.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.