D'après un exposé présenté devant la Société belge de Cardiologie
Implantation percutanée d'une valve aortique (TAVI) : évolution de la technique
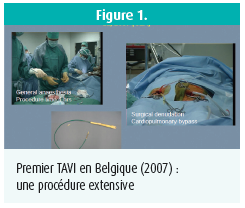
Comparé à la première procédure TAVI réalisée par Alain Cribier en 2002, la technique d'implantation s'est considérablement simplifiée au fil des ans. Le TAVI était à l'origine une procédure extensive, réalisée sous anesthésie générale, durant plusieurs heures, impliquant la dénudation chirurgicale du lit vasculaire iliaque et ayant encore souvent recours à un coeur-poumon artificiel lors de l'implantation valvulaire. Les cadres de valve utilisés étaient eux aussi volumineux, nécessitant même l'utilisation de 24 feuillets artériels français (figure 1). Toutefois, le TAVI peut aujourd'hui être réalisé au moyen d'une procédure purement percutanée relativement courte, sous sédation, voire sous anesthésie locale, grâce à une technique d'implantation fortement simplifiée et moyennant une brève période d'hospitalisation. à ce jour, on dénombre une demi-douzaine de valves transcathéter sur le marché belge (Edwards Sapien 3, Medtronic CoreValve Evolut et Evolut PRO, Lotus, Acurate neo, Portico et Direct flow Medical) ; ces valves disposent toutes de données probantes cliniques appropriées, tout au moins pendant une période de quelques années suivant le TAVI.
Parallèlement à l'évolution technique, les preuves scientifiques sont devenues nettement plus nombreuses et, chez les patients à très haut risque, inopérables et qui présentent une sténose valvulaire aortique significative et symptomatique, la plus-value pronostique du TAVI par rapport à une prise en charge médicamenteuse est désormais incontestable. Chez les patients à haut risque également, le TAVI est au moins non inférieur au remplacement chirurgical de la valve aortique et est même à privilégier pour un certain nombre de critères d'évaluation (impact sur le patient, durée de l'hospitalisation, durée du rétablissement). Pour cette raison, pour ces groupes de patients également, le TAVI a été formellement intégré aux recommandations thérapeutiques européennes et américaines chez les patients atteints d'une sténose valvulaire aortique sévère symptomatique. L'équipe cardiaque, composée de chirurgiens cardiaques, cardiologues, techniciens d'imagerie et autres médecins intervenant dans la prise en charge, doit chaque fois réaliser un choix thérapeutique adapté au patient individuel.
En Belgique, depuis la première procédure TAVI réalisée en 2007, un peu plus de 3 000 implantations ont été réalisées et depuis quelques années, un remboursement partiel (qui reste cependant insuffisant) est accordé pour un nombre prédéfini de valves TAVI par année par centre.
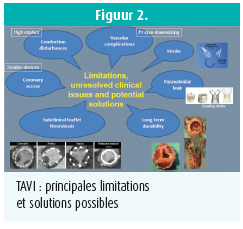
Néanmoins, en raison de diverses limitations et de certains problèmes cliniques non résolus, l'implantation chez les patients plus jeunes (à faible risque) ne peut toujours se faire qu'avec précaution (figure 2). Ainsi, nous sommes par exemple confrontés au problème très pertinent que représente la fuite paravalvulaire, consistant en de petits jets régurgitants le long des nodules calcifiés autour du cadre du TAVI. C'est la raison pour laquelle la plupart des fabricants développent aujourd'hui des « sealing skirts » autour du cadre du TAVI. De même, les troubles de la conduction, nécessitant l'implantation définitive d'un pacemaker, constituent une limitation pertinente, tout au moins pour les valves auto-expansives. à présent que certaines de ces valves sont « recaptable », ce qui rend techniquement possible une implantation valvulaire haute, l'incidence des troubles de la conduction de haut grade est en baisse. Bien que l'incidence des complications cérébrovasculaires, incluant l'AVC, soit faible et ne soit probablement pas plus élevée qu'après un remplacement valvulaire chirurgical, ce type de complication est extrêmement dommageable et exerce généralement un impact significatif sur la qualité de vie du patient. L'utilisation de systèmes spécifiques de protection contre l'embolie, tout comme le traitement percutané pour les lésions carotidiennes, est également en cours d'évaluation. Des complications vasculaires continuent à survenir, même si la plupart des valves sont aujourd'hui nettement moins volumineuses (14-16 Fr au lieu de 24 Fr à l'origine). L'utilisation de dispositifs appelés « large whole closure devices » est actuellement en cours d'évaluation clinique. Enfin, les données de durabilité à long terme dont nous disposons actuellement demeurent relativement limitées. Tant pour la valve Edwards Sapien que pour le système Medtronic CoreValve, des données (très prometteuses) sont désormais disponibles pour le suivi sur une période de 5 à 8 ans. Toutefois, nous manquons toujours énormément de données pour un grand nombre de valves VAVI plus récentes.
Implantation percutanée d'une valve aortique : évolution observée dans les pathologies traitables
Jusqu'ici, conformément aux recommandations thérapeutiques européennes et américaines, le TAVI est indiqué chez les patients présentant une sténose valvulaire aortique sévère symptomatique. à l'avenir, la procédure TAVI pourra très probablement aussi être réalisée dans les stades plus précoces (ou asymptomatiques) de la maladie. Ainsi, l'étude Early TAVR examine dès à présent, selon un plan randomisé, chez les patients présentant une sténose sévère mais strictement asymptomatique de la valve aortique (ainsi qu'une épreuve d'effort normale), si le TAVI permet de réduire la mortalité et la nécessité d'hospitalisation par rapport à une prise en charge consistant en un suivi attentiste. Par ailleurs, l'étude TAVR UNLOAD vise à établir, selon un plan randomisé également, si le TAVI permet d'améliorer le pronostic par rapport à une stratégie médicamenteuse attentiste chez les patients qui présentent une sténose modérée de la valve aortique, mais qui présentent également des symptômes de congestion ou une diminution de la fonction du ventricule gauche.
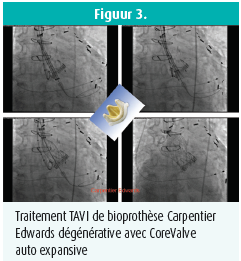
Entretemps, on dispose de preuves croissantes indiquant que le TAVI peut également être utilisé en toute sécurité pour le traitement percutané d'autres pathologies liées à la valve aortique. Nous disposons ainsi déjà d'une expérience relativement large dans le traitement des bioprothèses aortiques dégénératives (figure 3). à cet égard, il est important de déterminer de manière spécifique de quel mécanisme de dégénérescence valvulaire il s'agit (pannus, thrombus, calcification, endocardite …), quel est le diamètre interne de la bioprothèse implantée auparavant et s'il s'agit d'une bioprothèse avec ou sans stent (en raison du risique d'occlusion coronaire éventuelle en cas de traitement par TAVI de bioprothèses dégénératives sans stent).
Par ailleurs, notre expérience du TAVI dans le traitement de la bicuspidie valvulaire et de la régurgitation aortique pure s'est également fortement développée. Plus spécifiquement, dans le traitement de la régurgitation de valve aortique pas du tout calcifiée, il semble qu'un champ d'application existe pour les valves TAVI auto-expansives, la fixation de celles-ci ne nécessitant absolument pas de calcium (contrairement aux valves TAVI dilatées par ballonnet).
Implantation percutanée d'une valve aortique : évolution du type de patients à traiter
Jusqu'ici, toujours conformément aux recommandations thérapeutiques européennes et américaines, le TAVI est principalement réalisé chez les patients à (très) haut risque qui présentent une sténose valvulaire aortique sévère et symptomatique. Toutefois, plusieurs essais randomisés sont actuellement en cours, qui comparent tous cette procédure avec le remplacement chirurgical de la valve aortique ; dans ces essais, plusieurs des valves TAVI actuellement disponibles sont évaluées chez des patients à risque intermédiaire, voire chez des patients à très faible risque. Il est fort probable que chez ces groupes à faible risque, les risques liés à la procédure TAVI s'avèreront nettement plus faibles que ceux observés dans les groupes de patients à haut risque actuellement traités. Dès que les études d'enregistrement et les études randomisées en cours nous fourniront un nombre suffisant de données de durabilité à long terme, le TAVI devrait remplacer de façon croissante le remplacement chirurgical de la valve aortique. Tout au moins lorsque l'âge du patient justifie la pose d'une bioprothèse. Au vu de l'évolution démographique escomptée au cours des prochaines décennies, qui devraient connaître une augmentation significative du nombre de personnes du troisième âge, et si l'on tient compte du fait que la sténose valvulaire aortique est une pathologie qui apparaît seulement à un âge avancé, le TAVI devrait continuer à occuper une place majeure dans le traitement du patient (âgé) à (très) haut risque au sein de tous les centres pratiquant le TAVI.
à cet égard, le principal défi, en particulier en ce qui concerne ce groupe de patients âgés, demeure la sélection optimale des patients. Nous avons besoin de méthodes objectives (p. ex. en vue d'évaluer la fragilité des patients) permettant de déterminer chez quels patients le TAVI permettra d'améliorer la qualité de vie, et chez lesquels ce ne sera absolument pas le cas. à cet âge, le gain en qualité de vie obtenu via l'offre d'un traitement spécifique constitue un objectif au moins tout aussi important que les aspects purement pronostiques. En outre, un autre élément intervient également, à savoir le coût économique. En tant que médecins praticiens, nous devrons veiller de façon croissante à ce que les moyens budgétaires disponibles que nous utilisons pour mettre en oeuvre ces traitements qui restent très onéreux soient réservés aux patients qui en bénéficieront le plus. Pour cette raison, les centres TAVI devront sans aucun doute évoluer pour offrir des services multidisciplinaires, au sein desquels les gériatres se verront également confier un rôle de premier plan.
Références
- Nkomo, V.T., Gardin, J.M., Skelton, T.N., et al. Burden of valvular heart diseases: a population-based study. Lancet, 2006, 368, 1005.
- Schwarz, F., Baumann, P., Manthey, J., et al. The effect of aortic valve replacement on survival. Circulation, 1982, 66, 1105.
- Kitai, T., Honda, S., Okada, Y., et al. Clinical outcomes in non-surgically managed patients with very severe versus severe aortic stenosis. Heart, 2011, 97, 2029.
- Leon, M.B., Smith, C.R., Mack, M., et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med, 2010, 363, 1597.
- Ben-Dor, I., Pichard, A.D., Gonzalez, M.A., et al. Correlates and causes of death in patients with severe symptomatic aortic stenosis who are not eligible to participate in a clinical trial of transcatheter aortic valve implantation. Circulation, 2010, 122, S37.
- Kvidal, P., Bergström, R., Hörte, L.G., Ståhle, E. Observed and relative survival after aortic valve replacement. J Am Coll Cardiol, 2000, 35, 747.
- Bernard, Y., Etievent, J., Mourand, J.L., et al. Long-term results of percutaneous aortic valvuloplasty compared with aortic valve replacement in patients more than 75 years old. J Am Coll Cardiol, 1992, 20, 796.
- Soyer, R., Bouchart, F., Bessou, J.P., et al. Aortic valve replacement after aortic valvuloplasty for calcified aortic stenosis. Eur J Cardiothorac Surg, 1996, 10, 977.
- Hara, H., Pedersen, W.R., Ladich, E., et al. Percutaneous balloon aortic valvuloplasty revisited: time for a renaissance? Circulation, 2007, 115, e334.
- Kvidal, P., Bergström, R., Malm, T., Ståhle, E. Long-term follow-up of morbidity and mortality after aortic valve replacement with a mechanical valve prosthesis. Eur Heart J, 2000, 21, 1099.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.