Le BIWAC ou Belgian Interdisciplinary Working group on Acute Cardiac Care est un groupe de travail interdisciplinaire belge qui se consacre à l'étude des pathologies cardiologiques aiguës et qui vise à favoriser l'utilisation de ces connaissances dans la vie quotidienne. Le terme interdisciplinaire signifie que des urgentistes, intensivistes et généralistes viennent compléter le travail des cardiologues.
Tous les deux ans, le BIWAC organise son propre congrès scientifique. Il assure également la présentation d'exposés lors de congrès d'autres groupes de travail, veille aux échanges d'informations, publie des recommandations de bonne pratique et promeut la recherche scientifique.
Le 8 juin 2018 à Bruxelles, le BIWAC a organisé son sixième congrès, qui a remporté un franc succès. Il s'agit d'un congrès biennal consacré à la meilleure prise en charge possible des patients souffrant d'un syndrome coronarien aigu ou d'insuffisance cardiaque aiguë. Les recommandations les plus récentes ont été présentées par des experts réputés, nationaux ou internationaux, et expliquées à l'aide de cas cliniques. Il y avait également des ateliers interactifs consacrés à la prise en charge préhospitalière du patient cardiaque aigu.
Les thèmes suivants ont été abordés lors de six sessions.
1. Prevention and management of bleeding in the ACS patient (Marco Valgimigli)
Après la présentation, par Philippe Morrimont (CHU Sart Tilman, Liège), d'un cas clinique visant à situer l'importance de ce sujet, Marco Valgimigli, MD PhD (hôpital universitaire de Berne, Suisse) a présenté son exposé au sujet des hémorragies chez le patient souffrant d'un syndrome coronarien aigu.
Alors qu'initialement, on s'employait surtout à éviter les incidents ischémiques, on tient à présent de plus en plus compte du risque hémorragique. Le traitement antiagrégant plaquettaire augmente le risque d'hémorragies spontanées, en particulier gastro-intestinales, urogénitales et intracrâniennes. En cas de traumatisme ou d'intervention chirurgicale, un patient sous antiagrégants plaquettaires court un risque accru d'hémorragies, et il n'existe pas de bon antidote aux antiagrégants plaquettaires. Dans l'étude DAPT, on a noté un excès de décès consécutifs à des traumatismes, mais aussi un excès de décès dus à des tumeurs malignes.
De ce fait, la prévention des hémorragies est également essentielle en cas de syndrome coronarien aigu. Ceci est possible grâce au choix de la voie d'abord (radiale versus fémorale), au choix du stent, au choix du schéma adéquat et à la posologie des anticoagulants autant que des antiagrégants plaquettaires. L'étude MATRIX ACCESS a plaidé pour l'abord radial. Le choix et la posologie des anticoagulants gagnent en importance au fur et à mesure que les patients avancent en âge. Les inhibiteurs de la pompe à protons protègent des hémorragies gastro-intestinales en cas de double thérapie antiagrégante plaquettaire.
Une transfusion sanguine est associée à une mortalité à 30 jours moindre, si l'hématocrite est inférieur à 30 %. En cas de complications hémorragiques, il ne faut pas réagir de manière excessive. Il ne faut pas arrêter de médicaments potentiellement importants, il faut diminuer les médicaments antithrombotiques progressivement et surtout, traiter la cause de l'hémorragie!
Il convient d'établir des schémas de prise en charge des hémorragies légères, modérées et sévères.
La prévention des hémorragies extrahospitalières commence par le choix du stent adéquat. Les hémorragies gastro-intestinales sont les hémorragies extrahospitalières les plus fréquentes. Il faut identifier les patients courant un risque hémorragique élevé et adapter le traitement.
Les systèmes de score sont inévitables pour évaluer le risque thrombotique ou hémorragique et, ce faisant, individualiser le traitement d'un patient souffrant d'un syndrome coronarien aigu. Paradoxalement, une hémorragie peut majorer le risque thrombotique, selon un cercle vicieux. Exemple: le score PRECISE-DAPT (figure 1).

2. Cardiac shock in STEMI patients: challenging the guidelines (Pascal Vranckx)
Cet exposé a été introduit par un cas clinique présenté par Shakeel Kautbally de l'UCL Saint-Luc, Bruxelles.
Pascal Vranckx, MD PhD (Centre cardiaque, Hasselt) se base sur les recommandations de 2017 de l'ESC. Faut-il tendre à une revascularisation complète des lésions non-culprit? Les recommandations de 2012 affirmaient qu'il ne fallait pratiquer de PCI qu'au niveau de la lésion 'culprit', excepté en cas de choc cardiogénique avec ischémie persistante. Dans ce cas, toutes les lésions devaient être traitées à titre primaire. Les recommandations de 2017 nous disent qu'il faut pratiquer en routine une revascularisation de toutes les lésions non liées à l'infarctus, avant que le patient ne quitte l'hôpital. On s'est basé sur des études (PRAMI, CVLPRIT, DANAMI 3 et COMPARE-ACUTE), sur une méta-analyse d'Islam et Elgendy parue dans JCIN 2017 et sur l'étude 'Fractional Flow Reserve-guided Multivessel Angioplasty in Myocardial Infarction' (P.C. Smits dans le NEJM 2017).
Sur la base de nouvelles preuves solides émanant de l'étude CVLPRIT-SHOCK, le groupe d'étude STEMI 2017 estime à présent que, chez les patients souffrant d'un STEMI, en choc cardiogénique, la PCI primaire doit rester limitée à la coronaire responsable de l'infarctus (figure 2).

Bien que l'étude CARRESS-HF fût une étude neutre, sans différences en termes de réduction pondérale, l'ultrafiltration est acceptée comme alternative thérapeutique efficace.
Dans l'étude CRISP-AMI, Patel a montré qu'un IABP ne diminue pas la taille de l'infarctus, en cas d'infarctus myocardique antérieur aigu sans choc cardiogénique. Thiele (NEJM 2012) a montré qu'en cas d'infarctus myocardique aigu avec choc cardiogénique, un IABP ne réduisait pas significativement la mortalité à 30 jours ou à 1 an chez les patients chez qui une revascularisation était planifiée. Malgré tout, un ballon-pompe intra-aortique doit être envisagé chez les patients en choc cardiogénique suite à des complications mécaniques.
Un cathéter de Swan-Ganz peut être envisagé pour confirmer le diagnostic ou orienter le traitement.
En cas de choc cardiogénique, en phase aiguë, il est préférable de ne traiter que la coronaire responsable de l'ischémie sévère.
3. Towards a new definition of Tako-Tsubo Syndrome (Thomas Lüscher)
Thomas Lüscher, MD PhD travaille tant au Royal Brompton and Harefield Hospital NHS Trust & Imperial College de Londres, Royaume-Uni qu'au Centre de Cardiologie Moléculaire, Université de Zurich, Suisse.
Le terme de 'syndrome de Tako-Tsubo' (STT) a été introduit pour la première fois lorsque Sato et al. (1990) ont publié leur rapport de cinq cas dans un périodique médical japonais. Desmet et al. (2003) ont introduit la première série de patients souffrant de ce syndrome. Le terme Tako-Tsubo, qui vient du japonais (piège pour les pieuvres), trouve son origine dans la forme typique du ventricule gauche à la fin de la systole. Ce syndrome porte également d'autres noms: 'syndrome du coeur brisé', 'cardiomyopathie de stress', 'syndrome de ballonisation apicale'. Le STT est caractérisé par un mouvement pariétal anormal transitoire du ventricule gauche, et il a des caractéristiques communes avec le syndrome coronarien aigu: mêmes symptômes, mêmes anomalies à l'ecg, élévation des enzymes cardiaques. Le STT touche 1-3 % de tous les patients et 5-6 % des femmes chez qui on suspecte un STEMI.
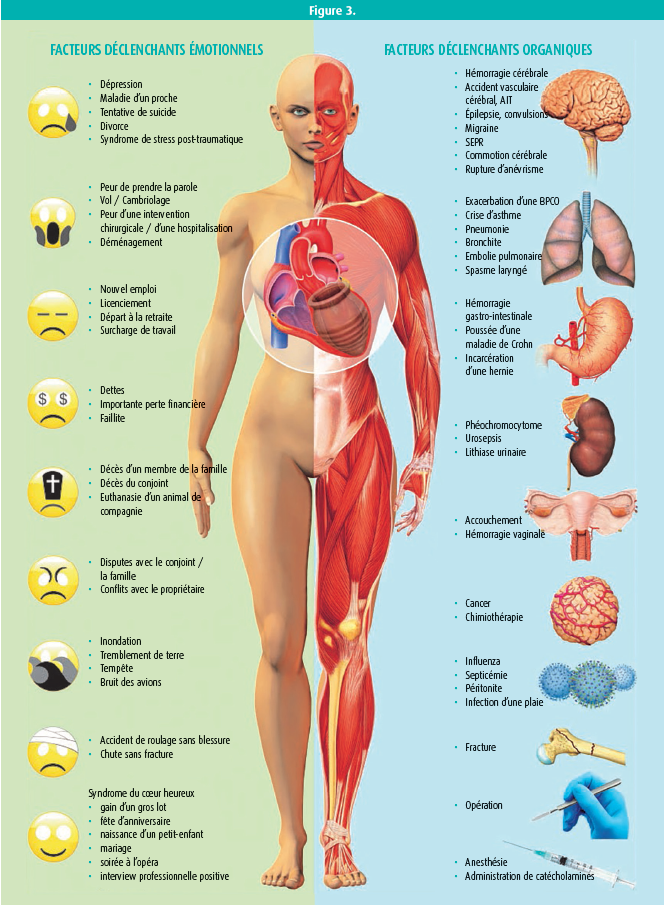
Le mécanisme physiopathologique exact du syndrome de Tako-Tsubo (STT) n'est pas tout à fait compris, mais il est certain qu'une stimulation sympathique est au centre de la pathogenèse. En outre, il semble y avoir une inhibition du système parasympathique. Dans la plupart des cas, le syndrome est provoqué par un épisode de stress psychique ou physique évident. Il s'agit vraisemblablement d'une libération locale de catécholamines myocardiques. On pense qu'un spasme des vaisseaux épicardiques, d'origine sympathique, est la cause du STT. Ce syndrome peut être associé à une dysfonction endothéliale et à d'autres situations dans lesquelles la fonction vasomotrice est anormale, comme les migraines ou le phénomène de Raynaud. Les catécholamines et l'endothéline provoquent une vasoconstriction, surtout dans les microvaisseaux coronaires, où les récepteurs alpha-1 et les récepteurs à l'endothéline de type A prédominent. Un stress émotionnel ou physique entraîne une libération excessive de catécholamines avec une élévation des catécholamines locales et de l'endothéline, induisant une vasoconstriction coronaire. Tant une hémorragie sous-arachnoïdienne qu'un phéochromocytome peuvent également causer un STT.
Le STT est-il un syndrome coronarien?
Le diagnostic du STT pose un défi, car son phénotype ressemble beaucoup à celui d'un infarctus myocardique aigu. On a rédigé des critères diagnostiques internationaux (InterTAK Diagnostic Criteria). Chez un(e) patient(e) souffrant d'un syndrome coronarien aigu, le diagnostic différentiel doit inclure un STEMI/NSTEMI, un angor de Prinzmetal (spasme coronaire) ou un STT (coronaires normales avec vasoconstriction microvasculaire). Les symptômes classiques, à savoir douleurs thoraciques aiguës, dyspnée ou syncope, ne peuvent à première vue pas être distingués d'un infarctus myocardique aigu. Un choc cardiaque, voire l'arrêt cardiaque, sont possibles. L'ecg au repos montre un sus-décalage du segment ST ou des ondes T négatives dans les dérivations précordiales, en plus d'un allongement de l'intervalle QT. Il est frappant de constater que l'élévation de la troponine est moins importante en cas de STT que de STEMI. Par ailleurs, on observe souvent une forte élévation du BNP. L'angiographie coronaire avec ventriculographie gauche constitue la référence pour exclure - ou confirmer - un STT. La forme classique est une dilatation systolique apicale, mais d'autres formes existent: médio-ventriculaire, focale, voire basale (Tako-Tsubo inversé). à l'imagerie nucléaire, on observe des anomalies de perfusion transitoires.
évolution clinique aiguë
Durant l'hospitalisation, le STT se complique fréquemment d'insuffisance cardiaque aiguë, d'obstruction de la chambre de chasse ventriculaire gauche, d'insuffisance mitrale, voire de choc cardiogénique. Moins souvent, on observe une fibrillation auriculaire, des troubles de la conduction AV, un thrombus à l'apex du VG, voire un arrêt cardiaque. Rarement, il se produit une tachy- ou bradyarythmie, des torsades de pointes ou une fibrillation ventriculaire. La fonction ventriculaire gauche peut chuter à 30-40 %, alors qu'elle atteint en moyenne 50 % en cas de syndrome coronarien aigu. Il faut être prudent avec l'administration de catécholamines, et préférer une inhibition de l'ECA. Les options théoriques sont un antagoniste des récepteurs alpha et un antagoniste de l'endothéline. Le rétablissement s'observe en plusieurs jours ou semaines, et peut nécessiter 1 an. à long terme, on observe 50 % de MACE (major adverse cardiac event) et la probabilité de décès s'élève à 25 %.
La nouvelle définition du syndrome de Tako-Tsubo souligne le rôle important du stress émotionnel, surtout chez les femmes postménopausées. Le stress émotionnel provoque une vasoconstriction, qui induit d'une part de l'hypertension et d'autre part une vasoconstriction coronaire avec de l'ischémie. Il existe une nette interaction entre le coeur et le cerveau: 'The brain talks to the heart and the heart talks to the brain.' (figure 3). L'endothéline constitue le médiateur majeur, et on peut envisager un traitement par IEC.
4. Cardiac complications in acute intoxication (Philippe Jorens)
Jerold Spapen de l'UZ Brussel a relaté un cas intéressant au sujet d'une intoxication par antagonistes calciques et Philippe Jorens, MD PhD (Soins intensifs, UZ Antwerpen) a présenté un exposé passionnant sur l'intoxication.
Jerold Spapen de l'UZ Brussel a relaté un cas intéressant au sujet d'une intoxication par antagonistes calciques et Philippe Jorens, MD PhD (Soins intensifs, UZ Antwerpen) a présenté un exposé passionnant sur l'intoxication. Paracelse déclarait déjà que 'c'est la dose qui fait le poison' (dosis sola facit venenum). Une intoxication peut se produire suite à une exposition accidentelle ou intentionnelle à une substance chimique, qu'elle soit ingérée, inhalée ou administrée par voie intraveineuse. Outre les médicaments ou l'alcool, il peut s'agir de drogues, d'insecticides ou de plantes. La plupart du temps, les patients touchés ne sont que légèrement ou modérément malades mais, en cas d'intoxication, le système nerveux autonome est le plus souvent atteint. En cas de stimulation du système orthosympathique (récepteurs alpha et bêta), nous observons de l'hypertension, de la tachycardie, une mydriase, de la fièvre et de l'excitation. En cas de stimulation du système parasympathique (acétylcholine), nous voyons de l'hypotension, de la bradycardie, un myosis et de l'hypothermie. En cas d'intoxication, on pense facilement aux 'vieux compagnons de la dive bouteille' ou à une femme faisant une tentative de suicide, mais les intoxications sont fréquentes chez les personnes jeunes.
- Les organophosphorés inhibent l'acétylcholine- estérase, ce qui donne un ecg typique avec de de larges ondes T négatives, profondes, dans les dérivations précordiales.
- La cocaïne produit un sus-décalage du segment ST dans les dérivations précordiales et des troubles du rythme dus à des spasmes coronaires sévères. Ici, il faut également penser à l'utilisation topique de cocaïne en cas de chirurgie nasale. Il ne faut pas utiliser de labétalol, mais un vasodilatateur.
- Une piqûre de scorpion peut entraîner une myocardite aiguë et un oedème pulmonaire.
- Le propofol diminue tant le tonus sympathique que parasympathique, en fonction de la profondeur du sommeil. Il entraîne une dépression cardiorespiratoire avec hypotension et bradycardie chez les patients septiques. Heureusement, il n'y a pas de tachycardie, et donc pas de demande accrue en oxygène. Tant chez les enfants que chez les adultes, une perfusion de propofol peut induire une insuffisance cardiaque rapide, une bradycardie, une acidose lactique, une rhabdomyolyse, de l'hyperkaliémie et de l'hyperlipémie, une insuffisance rénale aiguë, débouchant généralement sur le décès. L'ecg au repos montre alors un sus-décalage concave du segment ST, surtout dans les dérivations précordiales droites. Par ailleurs, l'instabilité électrique cardiaque va croissant, entraînant de graves troubles du rythme ventriculaire. Parmi les facteurs de risque, citons la dose cumulative, la durée supérieure à 48 h, le jeune âge, des dommages neurologiques aigus (traumatisme, opération), des perfusions de corticostéroïdes, un patient en état critique (avec des apports lipidiques élevés, mais des apports en hydrates de carbone faibles) et des anomalies congénitales de l'oxydation mitochondriale des acides gras. Sur le plan physiopathologique, ce problème s'explique par un déséquilibre entre la demande d'énergie et la fourniture.
- En cas d'intoxication par antagonistes calciques ou bêtabloquants, il faut envisager des doses élevées d'insuline, mais aussi des solutions de lipides intraveineuses.
- Parmi les agents chimiothérapeutiques, de nombreux produits sont également cardiodépresseurs. Un choc cardiogénique dû au 5-FU est rare, mais potentiellement mortel. L'antidote, le triacétate d'uridine, peut traiter rapidement une intoxication par 5-FU.
- Intoxication par le Taxus baccata (graines, écorce ou feuilles).
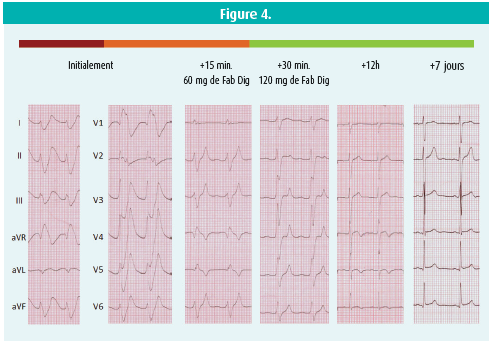
Le taux de taxine est le plus élevé en hiver. La dose létale est de 0,6-1,3 g/ kg. La taxine B, la principale cardiotoxine, inhibe tant les canaux calciques que les canaux sodiques du coeur. Ceci diminue la contractilité myocardique, ralentit la conduction et peut provoquer des troubles du rythme ventriculaire. L'ecg au repos montre des anomalies du segment ST, qui font penser à un syndrome de Brugada. Le traitement est essentiellement supportif: administration rapide de charbon activé et lavage gastrique pour éliminer le produit, pacing temporaire en cas de bradycardie et lidocaïne comme antiarythmique. L'alcalinisation au moyen de bicarbonate sodique constitue la dernière étape. étant donné le poids moléculaire élevé et la piètre hydrosolubilité, l'hémodialyse n'est pas efficace pour éliminer la taxine. Il faut envisager une ECMO en cas de défaillance cardiorespiratoire.
à titre d'antidote en cas d'intoxication par taxine, on peut utiliser des fragments Fab de digoxine, étant donné que les structures moléculaires de la digoxine (Digitalis purpurea), de la taxine (Taxus baccata) et de l'oléandrine (Nerium oleander) sont très similaires.
En cas d'intoxication, 4 principes sont d'application: (1) réanimer, (2) empêcher toute absorption supplémentaire, (3) favoriser l'élimination et (4) administrer un antidote.
Les complications cardiaques ne sont pas rares en cas d'intoxications. L'ecg au repos est très important (e.a. tracé Brugada-like) (figure 4). Il existe des traitements spécifiques en cas d'intoxications. L'ECMO (Extracorporal Membrane Oxygenation) doit être envisagée le plus rapidement possible, pour soutenir le coeur autant que les poumons.
5.1 Acute failure of the native valve (Victoria Delgado)
Victoria Delgado, MD PhD (Leiden University Medical Center, Pays-Bas) a expliqué que la défaillance aiguë d'une valve cardiaque native est peu fréquente, et que cette insuffisance valvulaire est mal tolérée. Comme causes, elle a cité: endocardite, rupture de l'appareil valvulaire (ischémie, traumatisme ...) ou modification aiguë de la charge volumique chez des patients souffrant de dysfonction ventriculaire gauche ou droite. En cas de défaillance valvulaire aiguë, un remodelage cardiaque n'a pas le temps de s'installer, car les pressions de remplissage augmentent rapidement, entraînant une défaillance hémodynamique. En cas de défaillance valvulaire chronique, il y a un remodelage des ventricules, une élévation des pressions de remplissage, mais aussi une compensation hémodynamique. Les recommandations de l'ESC se focalisent sur les maladies valvulaires chroniques. En cas de défaillance valvulaire aiguë, nous devons rechercher le mécanisme sous-jacent, et nous optons pour une chirurgie valvulaire ou un traitement transcathéter, en fonction de la situation hémodynamique. On dispose de trop peu de données pour pouvoir dire quel traitement est préférable.
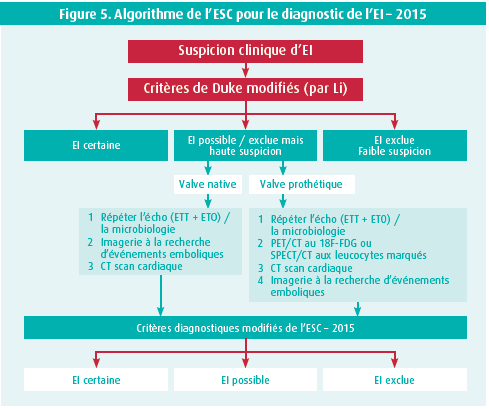
En 2015, l'ESC a publié des critères adaptés pour le diagnostic d'une endocardite infectieuse. L'échocardiographie est très importante pour poser ce diagnostic. L'ESC a défini un algorithme pour le diagnostic et a précisé l'indication et le timing de la chirurgie valvulaire (figure 5).
En cas de rupture d'un muscle papillaire, un soutien hémodynamique s'avère important. En cas de chirurgie valvulaire, la valve peut être remplacée ou réparée. La mortalité de la chirurgie valvulaire est élevée (20-25 %), ce qui explique qu'il faut également envisager une réparation valvulaire mitrale transcathéter.
L'endocardite infectieuse et une rupture d'un muscle papillaire sont les principales causes d'insuffisance cardiaque aiguë sur valves natives.
5.2 Acute failure of the prosthetic valve (Ole De Backer)
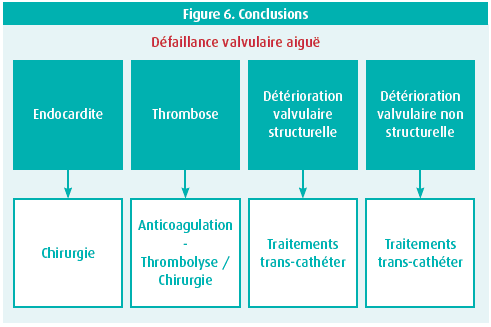
Ole De Backer, MD, PhD, MBA (The Heart Center - Ringhopitalet, Université de Copenhague, Danemark) a tout d'abord présenté une dia au sujet des complications des valves prothétiques. Les complications précoces sont une tamponnade cardiaque, une fibrillation auriculaire et un syndrome post-cardiotomie (syndrome de Dressler). Les complications tardives sont une fibrillation auriculaire tardive, une endocardite infectieuse, une obstruction valvulaire par un thrombus ou un pannus, une défaillance valvulaire structurelle primaire et des complications thrombo-emboliques (figure 6).
Les patients présentant une défaillance valvulaire prothétique aiguë arrivent aux urgences en raison d'une dyspnée aiguë ou d'un oedème pulmonaire aigu, voire d'un choc cardiogénique. La défaillance aiguë d'une valve artificielle n'est pas très fréquente et elle résulte le plus souvent d'une endocardite infectieuse, d'une obstruction valvulaire due à un thrombus ou d'une défaillance valvulaire structurelle primaire. Capodanno a publié en 2017, dans le périodique EJCTS, un document de consensus de l'ESC/EAPCI/EACTS. En 2017, l'ESC a publié, conjointement à l'EACTS, des recommandations pour le traitement des valvulopathies, avec des organigrammes.
L'endocardite infectieuse peut entraîner une défaillance valvulaire aiguë avec, d'une part, une perforation ou une rupture d'un feuillet valvulaire ou l'apparition de fistules et, d'autre part, une déhiscence partielle (détachement) de la prothèse valvulaire. La seule option thérapeutique est alors la chirurgie valvulaire, et ce, bien que la mortalité opératoire soit élevée.
Chez tout patient porteur d'une prothèse valvulaire qui présente une dyspnée récente ou un événement embolique, il faut songer à une thrombose valvulaire. L'incidence annuelle atteint 0,03-5,7 %, et elle est plus élevée chez les patients porteurs d'une prothèse mitrale ou chez qui l'anticoagulation est infrathérapeutique. Le diagnostic est confirmé par échocardiographie, MSCT ou cinéfluoroscopie. En cas de thrombose d'une bioprothèse, il faut optimiser l'anticoagulation avant d'envisager une chirurgie valvulaire. En cas de thrombose d'une prothèse valvulaire mécanique, on recommande un remplacement urgent de la valve chez les patients en état critique, indemnes de comorbidités. La fibrinolyse doit être envisagée si la chirurgie valvulaire n'est pas possible ou si le risque est très élevé, ou encore en cas de thrombose d'une prothèse valvulaire ventriculaire droite. Pour la fibrinolyse, on préconise du tPA, avec un bolus de 10 mg suivi de 90 mg en 90 minutes, avec de l'héparine (UFH). Une alternative consiste à administrer de la streptokinase à raison de 1 500 000 U en 60 minutes, sans héparine (UFH). La chirurgie doit être envisagée en cas de grand thrombus (> 10 mm) non obstructif, compliqué d'embolie.
Le traitement antithrombotique après un TAVI diffère selon les recommandations américaines de l'AHA/ACC et les recommandations européennes de l'ESC/EACTS. Les recommandations européennes préconisent une double thérapie antiagrégante plaquettaire (DAPT) pendant 3-6 mois, suivie d'un seul antiagrégant plaquettaire. Chez les patients courant un risque hémorragique élevé, on préconise une monothérapie antiagrégante plaquettaire. Les anticoagulants oraux sont recommandés à vie chez les patients présentant d'autres indications pour une anticoagulation.
La défaillance ou détérioration valvulaire primaire (non) structurelle
La détérioration valvulaire structurelle implique des modifications intrinsèques durables de la prothèse valvulaire (calcification, fibrose ou déchirure d'un feuillet valvulaire) qui entraînent une dégénérescence et une dysfonction hémodynamique avec une sténose valvulaire aortique centrale ou une insuffisance …
La détérioration valvulaire non structurelle implique des anomalies non intrinsèques de la prothèse valvulaire (insuffisance intra- ou paravalvulaire, malposition de la prothèse valvulaire, disproportion patient-prothèse, embolisation tardive) qui débouchent sur une détérioration et une dysfonction: l'insuffisance aortique paravalvulaire.
Le TAVI percutané valve-in-valve (VIV) va devenir la référence pour le traitement d'une défaillance valvulaire sévère (IAo/ SAo) d'une bioprothèse valvulaire aortique précédemment mise en place par voie chirurgicale, surtout chez les patients présentant une défaillance aiguë d'une bioprothèse, en choc cardiogénique. L'implantation transcathéter valve-in-valve constitue à présent une option pour les patients porteurs d'une bioprothèse dégénérée, à risque chirurgical élevé. La plus grande expérience concerne les bioprothèses valvulaires aortiques, et l'expérience reste limitée avec les bioprothèses valvulaires mitrales et tricuspides.
L'endocardite infectieuse de prothèses valvulaires se traite chirurgicalement. Une thrombose d'une bioprothèse se traite par anticoagulants (héparine ou antagoniste de la vitamine K). En cas de thrombose d'une valve mécanique, on peut opter pour la fibrinolyse ou la chirurgie. En cas de défaillance structurelle de bioprothèses, il faut envisager un TAVI (transcatheter aortic valve implantation) ou le remplacement percutané de la valve aortique. Sur ce plan, un TAVI peut être déployé dans la bioprothèse (valve-in-valve).
6. Can ischemic VT-ablation avoid the need for ICD? State of the art (Sébastien Knecht)
Lors de son exposé, Sébastien Knecht, MD PhD (AZ Sint-Jan, Bruges) a abordé la pathogenèse, la technologie et les critères d'évaluation procéduraux, les études pertinentes au sujet de l'ablation, les recommandations et les perspectives pour le futur. Pathogenèse: une cicatrice myocardique entraîne une tachycardie ventriculaire qui 'tourne' en fibrillation ventriculaire. L'ischémie aiguë provoque une fibrillation ventriculaire primaire. Ces deux situations entraînent le décès, sauf si elles sont résolues à temps.
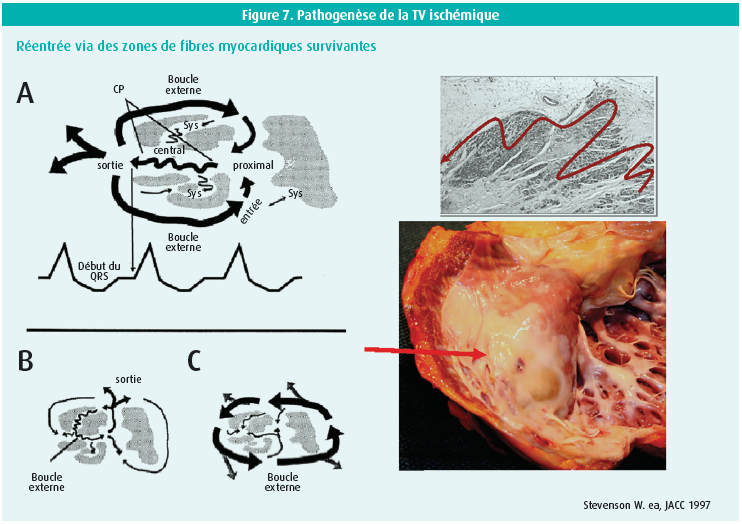
Technologie et critères d'évaluation procéduraux: une tachycardie ventriculaire ischémique s'explique par des réentrées à travers des zones de myocarde survivant (figure 7). Le mapping de voltage permet de distinguer le myocarde sain du myocarde malade: > 1,5 mV est encore du myocarde sain, mais < 0,5 mV signe du myocarde malade. La zone cicatricielle peut être délimitée au moyen d'un CT scan ou d'une IRM. En rythme sinusal, le substrat arythmogène est identifié. Il s'ensuit une ablation par RF jusqu'à ce que les LAVA (local abnormal ventricular activity) soient supprimées et qu'on ne puisse plus induire de tachycardie ventriculaire. L'élimination de ces LAVA est indépendamment associée à une diminution des récidives de tachycardie ventriculaire ou des décès. L'ablation par RF peut être tant endocardique qu'épicardique. Les nouveaux cathéters d'ablation par RF sont dotés de la technologie 'contact force'. Le contrôle de la pression en cas d'ablation par RF permet d'éviter les complications.
Indications d'ablation de TV?
(1) Patients porteurs d'un DCI, qui présentent une tempête électrique (> 3 chocs en 24 h): indication de classe 1 d'après les guidelines. (2) Patients porteurs d'un DCI et ayant > 1 récidive de TV en dépit d'un antiarythmique: indication de classe 1 d'après les guidelines. En cas d'intolérance ou d'échec de l'amiodarone ou d'un autre antiarythmique. (3) Patients porteurs d'un DCI sans récidive de TV, ne prenant pas d'antiarythmiques: indication de classe IIb d'après les guidelines. Un traitement de première ligne devrait être envisagé. Il s'agit essentiellement de patients jeunes, pour lesquels on n'a pas d'autre choix que l'amiodarone. (4) Patients non porteurs d'un DCI: l'implantation d'un DCI est une indication de classe 1 face à presque toutes les tachycardies ventriculaires ischémiques, en tenant compte des préférences du patient, d'une FEVG normale, de la disparition de l'inductibilité après l'ablation par RF et/ou de l'élimination de toutes les LAVA.
Et le futur?
Le rôle du mapping non invasif gagnera en importance: p. ex. une veste à 252 électrodes, les potentiels tardifs… Radiothérapie stéréotaxique sur les zones cicatricielles arythmogènes via la combinaison d'imagerie anatomique et d'imagerie électrocardiographique non invasive pendant la TV.
Une tachycardie ventriculaire ischémique se produit suite à des phénomènes de réentrée dans les myocytes survivants. Importance des 'potentiels tardifs'. La suppression des LAVA (local abnormal ventricular activity) est le but chez les patients présentant une tachycardie ventriculaire suite à une cicatrice. Enfin, dans certains cas, une ablation par radiofréquence d'une tachycardie ventriculaire ischémique peut rendre un DCI (défibrillateur implantable) superflu, surtout si ce patient ne présente pas d'insuffisance cardiaque. à l'avenir, le mapping non invasif gagnera en importance.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.