Introduction
L'insuffisance cardiaque est et reste une affection mortelle. Bien que la mortalité due aux maladies cardiovasculaires diminue à l'échelle mondiale, la mortalité due à l'insuffisance cardiaque augmente encore en termes absolus! On assiste donc à un glissement 'interne' au sein des maladies cardiovasculaires, l'accent étant déplacé vers le traitement de l'insuffisance cardiaque, surtout dans les pays occidentaux. Les implications de cette évolution sont importantes, non seulement pour les cardiologues, mais par extension aussi pour l'ensemble des soins de santé. Bien qu'il existe des traitements efficaces pour les patients souffrant d'insuffisance cardiaque (médicaments, traitement de resynchronisation cardiaque, dispositifs d'assistance et transplantation cardiaque), la mortalité reste très élevée. Une raison importante en est que chaque hospitalisation entraîne une morbi-mortalité élevée pour le patient. Le cardiologue spécialiste de l'insuffisance cardiaque a donc pour mission de prévenir ces hospitalisations en investissant dans des soins ambulatoires très développés pour les patients souffrant d'insuffisance cardiaque, en recourant aux cliniques de l'insuffisance cardiaque disposant d'infirmiers spécialistes de l'insuffisance cardiaque, spécifiquement formés, tout en s'aidant d'un vaste réseau de médecins généralistes, de trajets de soins transmuraux détaillés, etc. Une autre stratégie consiste à prédire les épisodes d'insuffisance cardiaque, afin de pouvoir réagir de manière proactive. Suite à quelques développements scientifiques récents dont des éléments ont été présentés lors du congrès de la Société Européenne de Cardiologie consacré à l'insuffisance cardiaque (HFA-ESC, Vienne, 26-29 mai 2018), cet article traitera plus en détail de cette dernière stratégie.
L'hospitalisation pour insuffisance cardiaque: un problème pour le patient, le médecin et la société
L'hospitalisation pour insuffisance cardiaque: prédictive d'une mort certaine!
Les chiffres et les études sont limpides: un patient souffrant d'insuffisance cardiaque qui est hospitalisé court un risque de décès maximal immédiatement après sa sortie. En effet, au cours de cette période, son équilibre physiopathologique est encore souvent précaire, et son traitement médicamenteux n'est pas encore réglé de manière optimale. En outre, les patients sortent souvent précocement, et ils ne sont dès lors pas encore totalement débarrassés de leur surcharge hydrique. Contrairement à la perception de nombreux patients et dispensateurs de soins1, l'insuffisance cardiaque est une affection dont la mortalité est élevée, supérieure à celle de bien des affections oncologiques. En outre, chaque hospitalisation raccourcit pour ainsi dire de moitié l'espérance de vie restante du patient. D'après certains registres, un peu moins de 30 % des patients hospitalisés pour insuffisance cardiaque décèdent au cours de l'année qui suit2-4!
L'hospitalisation pour insuffisance cardiaque: frustrante pour le cardiologue spécialiste de l'insuffisance cardiaque
Les données indiquent que 'l'inertie' du cardiologue5 est souvent responsable des hospitalisations pour insuffisance cardiaque. Les traitements modulant la maladie (IECA, bêtabloquants, antagonistes des minéralocorticoïdes) sont toujours insuffisamment titrés, et de nouveaux traitements largement validés (sacubitril/valsartan, traitement de resynchronisation cardiaque) sont trop peu instaurés. De ce fait, les patients sont insuffisamment stabilisés dans un contexte ambulatoire, et ils courent un risque de décompensations aiguës. Lorsqu'ils sont enfin hospitalisés, il est fréquent que les organes cibles, comme les reins, soient déjà fortement endommagés, ce qui complique l'adaptation du traitement modulant la maladie. Ils se retrouvent donc dans un cercle vicieux. En outre, il arrive encore souvent qu'on se focalise trop sur l'élimination de l'excès d'eau en soi, via l'administration de diurétiques (de l'anse). L'utilisation chronique de diurétiques de l'anse doit être limitée, dans la mesure du possible, étant donné que ces produits activent le système rénine-angiotensine-aldostérone, plutôt que de le bloquer. En outre, ils influencent souvent négativement la fonction rénale. Dès lors, lorsqu'un patient devient dépendant des diurétiques lors de l'évolution de sa maladie, toutes les sonnettes d'alarme doivent retentir, et il faut évaluer en détail si ce patient reçoit véritablement tous les traitements médicalement indiqués. Il est cependant évident que le cardiologue n'arrive souvent pas à augmenter le traitement modulant la maladie jusqu'aux doses scientifiquement les plus indiquées, en raison d'effets indésirables tels qu'insuffisance rénale et hypotension. Par ailleurs, le concept de surcharge hydrique est de plus en plus abandonné, en faveur d'une hypothèse plus nuancée selon laquelle le problème du patient souffrant d'insuffisance cardiaque n'est pas l'excès d'eau extracellulaire, mais bien sa distribution dans les différents compartiments6. Dans cette optique, il est logique que les diurétiques ne s'attaquent pas (suffisamment) au problème.
L'influence sur les budgets de la sécurité sociale
Suite à l'explosion des dépenses des soins de santé et à l'évolution démographique, les aspects d'économie de la santé doivent également être pris en compte dans l'organisation de la prise en charge de l'insuffisance cardiaque. Les hospitalisations coûtent une fortune, et elles ne sont pas toujours bénéfiques en termes de chances de survie pour le patient, que du contraire. Dès lors, les avantages potentiels du développement d'outils et d'algorithmes capables de prédire les épisodes d'insuffisance cardiaque (ce qui permet d'éviter les hospitalisations) doivent être étudiés selon cette perspective.
Prédiction des épisodes d'insuffisance cardiaque au moyen de dispositifs: bref historique
De manière générale, on affirme que les outils qui aident à prédire certaines affections doivent répondre à l'acronyme STEEP:
- Safe: l'outil doit être sûr pour le patient et le dispensateur de soins.
- Timely: il est capital de prédire l'affection à temps, afin de pouvoir agir au moment opportun.
- Effective: l'outil doit permettre de prédire correctement l'affection, il doit donc avoir une spécificité et une sensibilité suffisamment élevées.
- Efficient: l'outil doit améliorer la pratique du médecin et doit pouvoir être utilisé efficacement.
- Patient-centered: l'outil doit être ciblé sur l'amélioration des soins prodigués au patient.
La plupart des scores qui calculent le risque (de développement) d'insuffisance cardiaque aiguë ou de décès ne calculent qu'un risque statique, étant donné qu'ils n'utilisent que des paramètres 'statiques' obtenus soit 'au départ', soit pendant ou juste après une hospitalisation. Ceci n'est pas le cas avec les paramètres obtenus au moyen de dispositifs, qui peuvent donner une évaluation continue - et donc dynamique - du risque d'insuffisance cardiaque. Ainsi, des études précédentes ont montré que les paramètres basés sur des dispositifs implantables, comme l'impédance intrathoracique7, aident également à identifier la survenue et la durée d'épisodes de FA ou de tachycardie auriculaire et l'activité physique des patients, lorsque les patients courent un risque de développer de l'insuffisance cardiaque. Ces paramètres peuvent être utilisés comme tels ou - mieux encore - de manière combinée, pour réorienter les patients et adapter leur prise en charge. Malheureusement, les études précédentes ont montré une sensibilité et une spécificité assez faibles pour identifier les patients à risque d'insuffisance cardiaque et de décès8, 9. Ceci peut vraisemblablement s'expliquer par le fait qu'un seul paramètre (ou un nombre réduit de paramètres) n'a souvent pas la capacité d'appréhender suffisamment l'interaction complexe entre les différents processus physiopathologiques. L'algorithme qui permet de mieux approfondir cette interaction peut vraisemblablement jouer un rôle sur le plan de la prédiction d'épisodes d'insuffisance cardiaque aigus. Il faut noter que certaines de ces études se sont avérées négatives en raison de problèmes de compliance chez le patient ou d'un manque de connaissance de l'insuffisance cardiaque chez les médecins investigateurs. Enfin, la plupart des études n'incluaient pas de phase de test a priori, avec une phase de validation ultérieure.
Le développement et la validation d'un nouveau score de risque d'insuffisance cardiaque, dynamique, découlant de la combinaison de plusieurs paramètres diagnostiques, suivis au moyen de dispositifs implantables, ont récemment été testés par Martin Cowie et ses collègues10. Dans une cohorte de 2 231 patients, le score de risque dynamique a permis aux auteurs de prédire, dans un cadre ambulatoire, si un patient courait ou non un risque d'hospitalisation pour insuffisance cardiaque. Ceci a fourni des informations additionnelles et a permis de mieux évaluer le risque, comparativement au score de risque statique. Contrairement aux algorithmes qui évaluent le risque de décompensation à l'aide d'une évaluation quotidienne, les patients sont ici répartis en catégories de risque élevé, modéré ou faible, et ce, à l'aide d'évaluations mensuelles. Le groupe à risque élevé court un risque quintuplé d'hospitalisation pour insuffisance cardiaque, comparativement au groupe à faible risque. Par la suite, on a développé un modèle bayésien plus sophistiqué, y compris pour les évaluations mensuelles, qui permet d'identifier les patients courant un risque 10 fois plus élevé d'hospitalisation, comparativement au groupe à faible risque. Malheureusement, dans cette étude, 40 % des patients inclus faisaient toutefois partie du groupe à risque modéré/ médian. Il est important de savoir que ce score de risque d'insuffisance cardiaque est dynamique, et donc variable dans le temps: le patient peut être inclus dans le groupe à haut risque à un certain moment, et devenir un patient à faible risque le mois suivant, en fonction des paramètres diagnostiques enregistrés par les dispositifs implantables.
HeartLogic (Boston Scientific): un pas en avant!
Les preuves: l'étude MultiSENSE
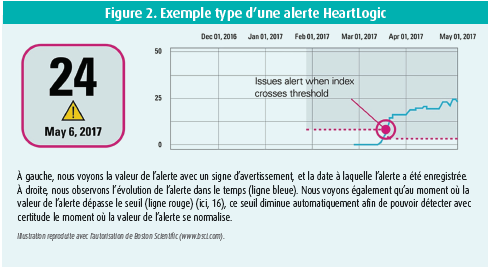
Une étude internationale, multicentrique, non randomisée, récemment publiée, baptisée MultiSENSE11, a confirmé la possibilité d'un algorithme basé sur un dispositif pour prédire l'aggravation graduelle de l'insuffisance cardiaque sur plusieurs jours à semaines. En tout, 900 patients ont été inclus et suivis (phase de développement: n = 500, phase de validation: n = 400) pendant environ 1 an. L'indice HeartLogic avait une sensibilité de 70 %, avec une 'fenêtre d'alerte' médiane de 34 jours avant la survenue de la plupart des événements relatifs à l'insuffisance cardiaque - définis comme une hospitalisation pour insuffisance cardiaque ou le besoin de diurétiques intraveineux. Il n'y avait que 1,47 alarme faussement positive par année-patient, avec le seuil nominal configuré de 16 (valeur de l'indice Heart- Logic = 16) dans la cohorte de validation indépendante. L'indice HeartLogic (Boston Scientific) multicapteur et l'algorithme d'alerte sont donc des outils sensibles permettant de prédire à temps une hospitalisation pour insuffisance cardiaque imminente. Toutefois, de plus amples études sont encore nécessaires pour tester l'algorithme dans des populations plus vastes et pour évaluer comment ce dispositif peut être intégré au mieux en pratique clinique quotidienne. En outre, l'algorithme n'est pour le moment disponible que dans certains sous-modèles des dispositifs CRT-D et ICD de Boston Scientific, et donc pas dans les dispositifs CRT-P. De ce fait, un certain nombre de patients souffrant d'insuffisance cardiaque sont actuellement exclus.
Aspects pratiques inhérents à l'algorithme HeartLogic
Comme l'indiquent schématiquement les figures 1 et 3, l'indice HeartLogic (figure 2) est une valeur sans unité, qui est la résultante d'un certain nombre de paramètres suivis en continu via le dispositif implanté. Ces paramètres sont les suivants:
- le troisième bruit cardiaque (B3): un troisième bruit cardiaque indique une menace de décompensation. L'accéléromètre présent dans le dispositif convertit les vibrations liées au troisième bruit cardiaque en 'cardiophonogramme' au départ du flux magnétique. De là, la valeur est exprimée en milliGauss (B3);
- le premier bruit cardiaque (B1): exprimé en milliGauss, selon le même principe que le troisième bruit cardiaque;
- le rapport entre le troisième et le premier bruit (B3/B1);
- l'impédance intrathoracique, exprimée en Ohm: l'impédance intrathoracique diminue en cas d'accumulation croissante de liquide, étant donné que l'eau est meilleure conductrice que l'air;
- paramètres respiratoires: on évalue non seulement le volume courant, mais on utilise aussi la variation entre les différents cycles respiratoires comme critère de décompensation (une augmentation de la variation peut indiquer une décompensation croissante);
- la fréquence cardiaque diurne et nocturne;
- l'activité physique du patient.

HeartLogic en Belgique: ready for prime time
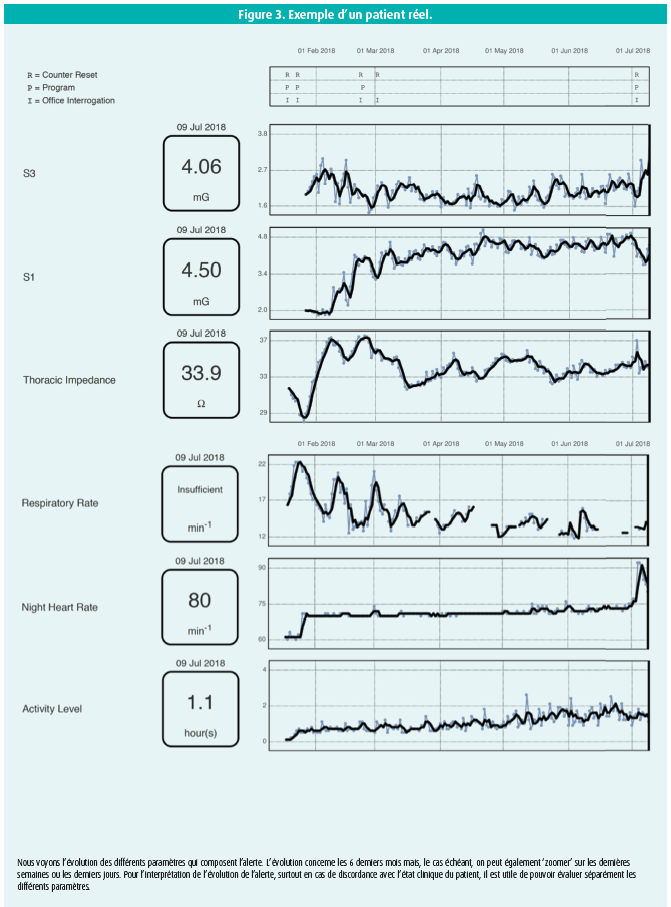
En juin 2018, le centre cardiaque de l'hôpital OLV d'Alost a commencé à implémenter l'algorithme HeartLogic (en tant que premier centre belge, et l'un des premiers centres européens). Entre-temps, une vingtaine de patients en ont déjà bénéficié (exemple: figure 3). L'avenir nous dira si cet algorithme peut aider à réduire le nombre d'hospitalisations pour insuffisance cardiaque. Ici, l'intégration de ce système dans les cliniques de l'insuffisance cardiaque constitue un défi de taille. Les infirmiers et cardiologues spécialistes de l'insuffisance cardiaque ainsi que les techniciens en charge des dispositifs ont été formés afin de comprendre l'algorithme et de l'interpréter conjointement. Nous espérons que ce système pourra contribuer à la prise en charge idéale de l'insuffisance cardiaque, qui donne au patient une place centrale, tout en visant une collaboration entre les infirmiers spécialistes de l'insuffisance cardiaque, les généralistes et les cardiologues spécialisés.
Perspective d'avenir
Dans une perspective plus large, nous devons accueillir avec enthousiasme l'utilisation de telles nouvelles technologies pour améliorer la prise en charge des patients souffrant d'insuffisance cardiaque et tenir compte du fait que cette technologie peut potentiellement être dissociée des événements des CRT-D/ICD. De cette manière, elle pourrait être mise à disposition sous la forme d'un dispositif ressemblant à un looprecorder implantable, afin de suivre chaque patient souffrant d'insuffisance cardiaque.
Références
- Setoguchi, S., Glynn, R.J., Avorn, J., Levin, R., Winkelmayer, W.C. Ten-year trends of cardiovascular drug use after myocardial infarction among community-dwelling persons > or = 65 years of age. Am J Cardiol, 2007, 100 (7), 1061-1067.
- Al-Omary, M.S., Davies, A.J., Evans, T.J., et al. Mortality and Readmission Following Hospitalisation for Heart Failure in Australia: A Systematic Review and Meta-Analysis. Heart, Lung & Circulation, 2018, 10.1016/j. hlc.2018.01.009.2018/03/10.
- Loehr, L.R., Rosamond, W.D., Chang, P.P., Folsom, A.R., Chambless, L.E. Heart failure incidence and survival (from the Atherosclerosis Risk in Communities study). Am J Cardiol, 2008, 101 (7), 1016-1022.
- Ohlmeier, C., Mikolajczyk, R., Frick, J., Prutz, F., Haverkamp, W., Garbe, E. Incidence, prevalence and 1-year all-cause mortality of heart failure in Germany: a study based on electronic healthcare data of more than six million persons. Clin Res Cardiol, 2015, 104 (8), 688-696.
- Berthelot-Garcias, E.IR., Damy, T., Donal, E., Galinier, M., Trochu, J., Dujardin, J. et al. 062: Treatment of heart failure in the real life: clinical inertia early after discharge worsens outcome. Arch Cardiovasc Dis, 2013, 5 (1), 1.
- Fudim, M., Hernandez, A.F., Felker, G.M. Role of Volume Redistribution in the Congestion of Heart Failure. J Am Heart Assoc, 2017, 6 (8), pii: e006817.
- van Veldhuisen, D.J., Braunschweig, F., Conraads, V., et al. Intrathoracic impedance monitoring, audible patient alerts, and outcome in patients with heart failure. Circulation, 2011, 124 (16), 1719-1726.
- Auricchio, A., Gold, M.R., Brugada, J., et al. Long-term effectiveness of the combined minute ventilation and patient activity sensors as predictor of heart failure events in patients treated with cardiac resynchronization therapy: Results of the Clinical Evaluation of the Physiological Diagnosis Function in the PARADYM CRT device Trial (CLEPSYDRA) study. Eur J Heart Fail, 2014, 16 (6), 663-670.
- Auricchio, A., Brugada, J., Ellenbogen, K.A., Gold, M.R., Leyva, F., investigators C. Assessment of a novel device-based diagnostic algorithm to monitor patient status in moderate- to-severe heart failure: rationale and design of the CLEPSYDRA study. Eur J Heart Fail, 2010, 12 (12), 1363-1371.
- Cowie, M.R., Sarkar, S., Koehler, J., et al. Development and validation of an integrated diagnostic algorithm derived from parameters monitored in implantable devices for identifying patients at risk for heart failure hospitalization in an ambulatory setting. Eur Heart J, 2013, 34 (31), 2472-2480.
- Boehmer, J.P., Hariharan, R., Devecchi, F.G., et al. A Multisensor Algorithm Predicts Heart Failure Events in Patients With Implanted Devices: Results From the MultiSENSE Study. JACC Heart Fail, 2017, 5 (3), 216-225.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.