1 L'étude ARRIVE
Le professeur J. M. Gaziano du Brigham and Women's Hospital, à Boston, a présenté les résultats de l'étude ARRIVE. Cette étude randomisée, en double aveugle, menée à grande échelle dans le secteur des soins de première ligne, a évalué l'efficacité et la sécurité de l'acide acétylsalicylique en comparaison d'un placebo chez des patients courant un risque modéré de premier événement cardiovasculaire.
L'utilité de l'acide acétylsalicylique en prévention secondaire du syndrome coronarien aigu et de l'accident vasculaire cérébral ischémique a déjà largement été démontrée par le passé.1 En revanche, le rôle de l'acide acétylsalicylique en prévention primaire de ces affections chez des patients courant un risque modéré de premier événement cardiovasculaire demeurait jusqu'ici sujet à controverse.
Entre juillet 2007 et novembre 2016, l'étude ARRIVE a inclus dans 7 pays (Allemagne, Italie, Irlande, Pologne, Espagne, Royaume-Uni et états-Unis) 12 546 patients estimés courir un risque modéré de premier événement cardiovasculaire (risque à 10 ans d'affections cardiovasculaires de 20-30 %). Ce risque était estimé selon les critères suivants: hommes âgés de plus de 55 ans cumulant ≥ 2 facteurs de risque cardiovasculaire et femmes âgées de plus de 60 ans cumulant ≥ 3 facteurs de risque cardiovasculaire. Les facteurs de risque cardiovasculaire pris en compte étaient une hypercholestérolémie, un tabagisme actif, un faible taux de cholestérol HDL, une hypertension artérielle et un antécédent familial d'affections cardiovasculaires. Les critères d'exclusion étaient un antécédent personnel d'affections cardiovasculaires, un risque hémorragique majoré et un diabète. Les patients ont été randomisés selon un rapport 1:1 pour recevoir soit 100 mg d'acide acétylsalicylique en comprimé gastro-résistant, une fois par jour, soit un placebo.
Le critère d'évaluation primaire d'efficacité consistait en un critère composite associant le délai écoulé jusqu'au décès cardiovasculaire, un syndrome coronarien aigu, un accident vasculaire cérébral ischémique et un accident ischémique transitoire. Les critères d'évaluation secondaires d'efficacité reprenaient les différents composants du critère d'évaluation primaire d'efficacité, seuls ou cumulés, ainsi que la mortalité toutes causes confondues. La sécurité de l'acide acétylsalicylique dans cette population étudiée a été évaluée par l'enregistrement des effets indésirables hémorragiques, classés en grade léger, modéré et sévère selon les critères GUSTO.
En dépit du profil de risque cardiovasculaire majoré de la population étudiée, l'étude ARRIVE n'a pas pu démontrer de réduction des événements cardiovasculaires dans l'analyse en intention de traiter (figure 1). De même, aucune valeur de p ne s'est avérée significative pour les critères d'évaluation secondaires d'efficacité. L'une des causes invoquées est un taux d'événements nettement inférieur au taux prédit sur la base du profil de risque cardiovasculaire à l'inclusion. Par ailleurs, l'interprétation de l'effet protecteur de l'acide acétylsalicylique a été perturbée par le nombre élevé de permutations de traitement (jusqu'à 40 %), un grand nombre de patients ayant été sciemment mis sous acide acétylsalicylique en cours d'étude en raison d'une augmentation du risque cardiovasculaire, par exemple après le développement d'un angor stable. Dans le même temps, l'acide acétylsalicylique a été volontairement arrêté chez une série de patients courant un risque relativement faible. C'est pourquoi les investigateurs ont également réalisé une analyse per protocole, laquelle a montré que la prise d'acide acétylsalicylique pendant au moins 60 % de la durée de l'étude induisait bel et bien une diminution significative du risque d'infarctus aigu du myocarde (37 cas ou 0,98 % dans le bras acide acétylsalicylique vs 72 cas ou 1,84 % dans le bras placebo; HR = 0,53 (IC à 95 %: 0,36-0,79; p = 0,0014) (tableau 1). Comme l'avaient déjà révélé les études antérieures, la prise d'une faible dose d'acide acétylsalicylique entraîne plus d'hémorragies gastro-intestinales (61 cas ou 0,97 % dans le bras acide acétylsalicylique vs 29 cas ou 0,46 % dans le bras placebo; HR = 2,11 (IC à 95 %: 1,36-3,28), mais ces hémorragies sont généralement d'intensité légère à modérée. Les hémorragies gastro-intestinales graves (4 cas ou 0,06 % vs 2 cas ou 0,03 %) et les AVC hémorragiques (8 cas ou 0,13 % vs 11 cas ou 0,18 %) ont été rares dans les deux bras de l'étude.
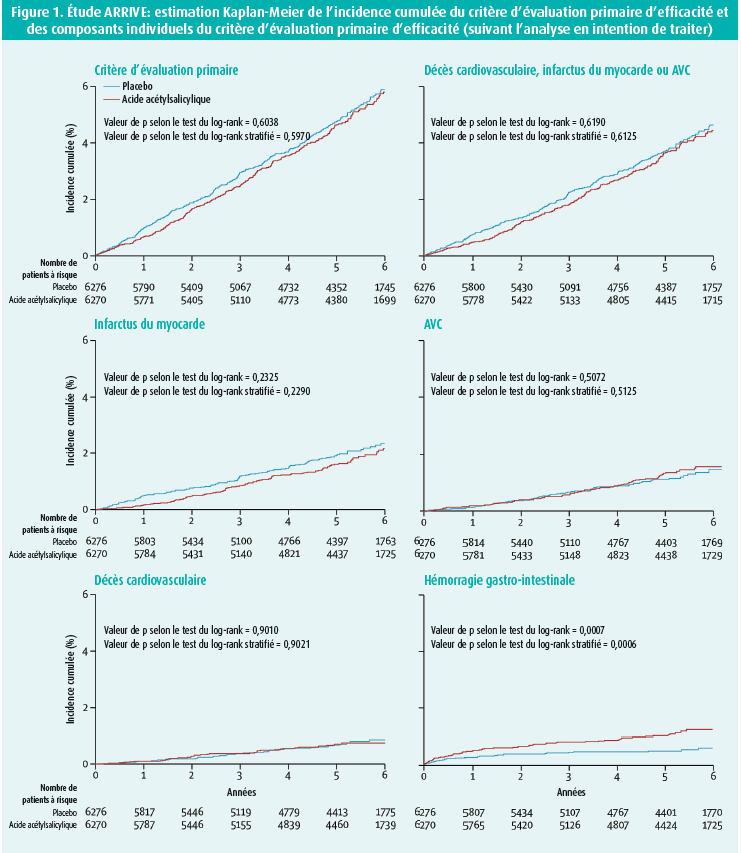
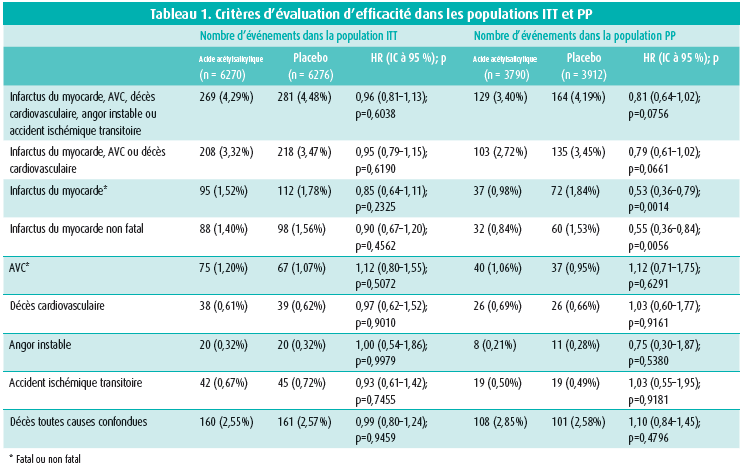
Comme mentionné plus haut, le taux d'événements constaté (à peine 550 événements cardiovasculaires sur l'ensemble de la population de l'étude) s'est avéré nettement inférieur au taux escompté sur la base de l'American College of Cardiology/American Heart Association risk calculator (8 à 9 % contre les 17 à 18 % attendus). Les investigateurs ont avancé plusieurs explications possibles à cet écart. Premièrement, les calculateurs de risque ont été conçus avec des données aujourd'hui désuètes, ce qui entraîne une possible surévaluation du risque dans la pratique moderne. Deuxièmement, l'étude a été réalisée dans le contexte des soins de première ligne, avec un accès parfois difficile aux infrastructures hospitalières, ce qui induit une possible sous-notification des événements cardiovasculaires. Troisièmement, une prise en charge plus agressive des facteurs de risque cardiovasculaire abaisse le risque d'événements cardiovasculaires. Ainsi, 43 % des patients inclus dans l'étude étaient déjà sous statines, sans oublier que les patients diabétiques étaient exclus de l'étude. Enfin, une prise en charge plus agressive des affections cardiovasculaires à un stade précoce peut impliquer une diminution du risque d'événements aigus majeurs. Cette hypothèse est étayée par la différence entre l'analyse en intention de traiter et l'analyse per protocole dans l'étude ARRIVE, plus particulièrement en ce qui concerne l'infarctus aigu du myocarde.
L'une des forces de l'étude ARRIVE est son nombre relativement élevé de femmes et de seniors, une population peu représentée dans les études antérieures. Du côté des points négatifs, relevons le plan de l'étude, une étude menée dans les soins de première ligne présentant le risque de sous-notification des événements d'efficacité et de sécurité. En guise de conclusion, les investigateurs soulignent que la décision de mise sous acide acétylsalicylique relève toujours d'un processus individualisé, nécessitant une pondération des avantages de la prévention cardiovasculaire et des inconvénients du risque hémorragique, des préférences du patient, du coût et d'autres facteurs. L'étude ARRIVE n'a pas fourni de nouvelles informations concernant l'effet préventif potentiel de l'acide acétylsalicylique sur le cancer, vraisemblablement du fait de la durée insuffisante de l'étude (10 ans).
2 L'étude MARINER
Le professeur Alex Spyropoulos de la Donald and Barbara Zucker School of Medicine, à New York, a présenté les résultats de l'étude MARINER, une étude randomisée en double aveugle visant à comparer l'effet protecteur du rivaroxaban, par rapport à un placebo, sur le développement d'une thrombo-embolie veineuse chez des patients récemment hospitalisés.
Il est de notoriété publique que le risque thrombo-embolique est augmenté chez les patients hospitalisés atteints d'affections médicales aiguës (p. ex. insuffisance cardiaque, insuffisance respiratoire, accident vasculaire cérébral, maladies infectieuses et inflammatoires) et qu'un traitement anticoagulant à doses prophylactiques diminue de 50-60 % les événements thrombo-emboliques en cours d'hospitalisation.2, 3 En vertu des recommandations actuelles, ce traitement préventif est rarement poursuivi au-delà de l'hospitalisation. Or, la majorité des quelque 400 000 événements thrombo-emboliques annuels estimés en Europe et aux états-Unis surviennent dans les 6 semaines qui suivent la sortie de l'hôpital. Par le passé, les études ayant évalué la poursuite de la prophylaxie antithrombotique après l'hospitalisation ont produit des résultats variables, allant d'une augmentation des hémorragies à un bénéfice thérapeutique consistant essentiellement en une réduction des thromboses veineuses profondes asymptomatiques.4-6 La poursuite de la prophylaxie antithrombotique après l'hospitalisation restait dès lors contestée.
L'étude MARINER a évalué le profil bénéfice- risque d'une prophylaxie antithrombotique prolongée par rivaroxaban après la sortie de l'hôpital de patients à risque élevé, ainsi qu'une série de critères d'évaluation cliniquement pertinents. Comme critère d'évaluation primaire, l'étude a évalué la supériorité du rivaroxaban en termes de prévention, d'une part, des événements thrombo-emboliques symptomatiques (thrombose veineuse profonde et embolie pulmonaire non fatale) et, d'autre part, des décès liés à des événements thrombo-emboliques (décès des suites d'une embolie pulmonaire ou décès dont il n'était pas possible d'exclure l'embolie pulmonaire parmi les causes potentielles). Les critères d'évaluation secondaires étaient: 1) événements thrombo-emboliques symptomatiques, 2) décès liés à des événements thrombo-emboliques, 3) critère d'évaluation composite associant événements thrombo-emboliques symptomatiques et mortalité toutes causes confondues, 4) critère d'évaluation composite associant événements thrombo-emboliques symptomatiques, infarctus aigu du myocarde, événement cérébrovasculaire non hémorragique et décès cardiovasculaire et 5) mortalité toutes causes confondues. Le critère d'évaluation primaire de sécurité comprenait l'hémorragie majeure, telle que définie par les critères de l'International Society of Thrombosis and Haemostasis (ISTH). Le critère d'évaluation secondaire de sécurité reprenait, quant à lui, l'hémorragie non majeure mais cliniquement pertinente.
Quelque 12 000 patients âgés de plus de 40 ans, qui avaient été hospitalisés entre 3 et 10 fois pour les affections médicales aiguës susmentionnées et qui couraient un risque thrombo-embolique accru (calculé au moyen du score IMPROVE), ont été randomisés pour poursuivre le rivaroxaban ou pour recevoir un placebo pendant 45 jours après la sortie de l'hôpital. Selon leur fonction rénale, les patients du bras rivaroxaban prenaient 10 mg (ClCr ≥ 50 ml/min) ou 7,5 mg de rivaroxaban une fois par jour (ClCr ≥ 30 et < 50 ml/min).
L'étude MARINER n'est pas parvenue à atteindre le seuil de signification pour le critère d'évaluation primaire d'efficacité (50 événements ou 0,83 % dans le bras rivaroxaban vs 66 événements ou 1,10 % dans le bras placebo, avec une valeur de p non significative de 0,136) (tableau 2, figure 2). Si toutefois nous analysons d'un peu plus près la composition du critère d'évaluation primaire, nous remarquons une différence significative au niveau des thromboses veineuses profondes symptomatiques (4 cas ou 0,07 % dans le bras rivaroxaban vs 13 cas ou 0,22 % dans le bras placebo, p = 0,039) et une légère tendance à la baisse au niveau des décès liés aux événements thrombo-emboliques constatés de manière objective. Dans les deux bras, le critère d'évaluation primaire a toutefois principalement été médié par le nombre élevé de cas de mort subite où l'embolie pulmonaire ne pouvait être exclue des causes possibles. Le professeur Spyropoulos souligne qu'en cette ère moderne, où les autopsies sont devenues rares, la définition d'un décès lié à un événement thrombo-embolique devrait peut-être être revue afin d'être plus spécifique. Si on analyse en outre les résultats d'efficacité en fonction de la dose administrée, nous observons une tendance à la baisse du critère d'évaluation primaire à la dose standard de 10 mg (32 cas ou 0,65 % dans le bras rivaroxaban vs 48 cas ou 0,98 % dans le bras placebo) parmi les patients ayant une fonction rénale normale. Pour la dose réduite de 7,5 mg (en cas d'insuffisance rénale modérée), aucune plus-value thérapeutique ne peut toutefois être dégagée par rapport au placebo.
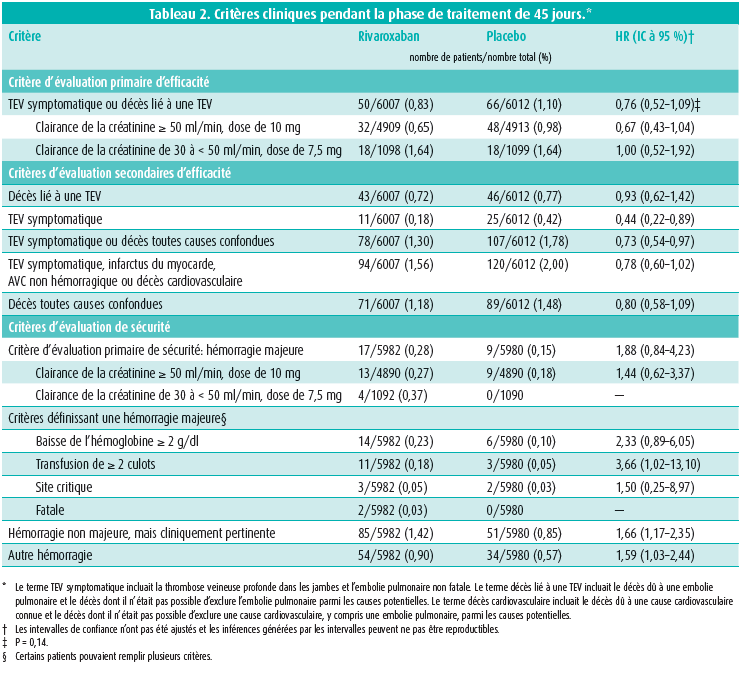
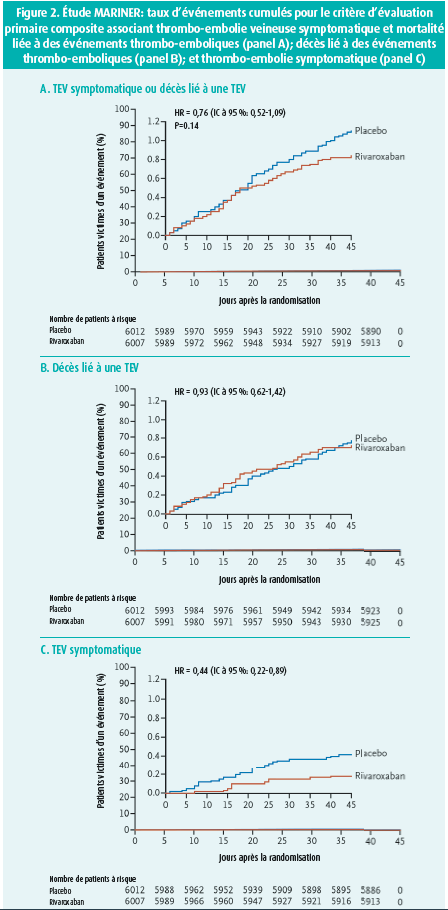
Parmi les critères d'évaluation secondaires proposés, deux se sont révélés significatifs: une réduction de 56 % des événements thrombo-emboliques symptomatiques (HR = 0,44 (IC à 95 %: 0,22-0,89), p = 0,023) et une réduction de 27 % du critère d'évaluation composite associant événements thrombo-emboliques symptomatiques et mortalité toutes causes confondues (HR = 0,73 (IC à 95 %: 0,54-0,97), p = 0,033).
Il n'y a pas eu de différence significative sur le plan du critère d'évaluation primaire de sécurité (17 cas ou 0,28 % dans le bras rivaroxaban vs 9 cas ou 0,15 % dans le bras placebo, p = 0,124). Il s'agissait principalement d'une diminution de l'hémoglobine de ≥ 2 g/dl ou d'une transfusion de ≥ 2 culots. En revanche, l'étude a révélé une différence significative au niveau des hémorragies non majeures, mais cliniquement pertinentes (85 cas ou 1,42 % dans le bras rivaroxaban vs 51 cas ou 0,85 % dans le bras placebo, p = 0,004).
L'étude MARINER nous apprend qu'une prophylaxie antithrombotique par rivaroxaban prolongée après la sortie de l'hôpital réduit le risque de survenue d'une thrombo-embolie veineuse symptomatique, sans augmentation des hémorragies majeures, dans une population à risque accru. Cependant, compte tenu de l'absence d'effet sur les décès liés aux événements thrombo-emboliques, son utilité reste incertaine. De futures études doivent, d'une part, mieux identifier la mortalité due aux événements thrombo-emboliques et, d'autre part, se concentrer sur les patients courant le risque le plus élevé, susceptibles de tirer profit d'une prophylaxie antithrombotique prolongée. Pour le reste, la dose optimale pour les patients présentant une fonction rénale diminuée n'est pas clairement établie, étant donné que la dose normale a induit, par le passé, une augmentation du nombre d'hémorragies chez ces patients mais que la dose réduite n'a pas eu d'effet protecteur dans cette étude.
Références
- Antithrombotic Trialists' (ATT) Collaboration. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet, 2009, 373, 1849-1860.
- Kahn, S.R., Lim, W., Dunn, A.S., et al. Prevention of VTE in nonsurgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest, 2012, 141, Suppl 2:e195S-e226S.
- Mahan, C.E., Fisher, M.D., Mills, R.M., et al. Thromboprophylaxis patterns, risk factors, and outcomes of care in the medically ill patient population. Thromb Res, 2013, 132, 520-526
- Goldhaber, S.Z., Leizorovicz, A., Kakkar, A.K., et al. Apixaban versus enoxaparin for thromboprophylaxis in medically ill patients. N Engl J Med, 2011, 365, 2167-2177.
- Cohen, A.T., Spiro, T.E., Büller, H.R., et al. Rivaroxaban for thromboprophylaxis in acutely ill medical patients. N Engl J Med, 2013, 368, 513-523.
- Cohen AT, Harrington RA, Goldhaber SZ, et al. Extended thromboprophylaxis with betrixaban in acutely ill medical patients. N Engl J Med, 2016, 375, 534-544.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.