Cet article traite de la session du congrès de la ESC: 'The north face in ACS: let's climb it', lors de laquelle la prise en charge de la dyslipidémie après un syndrome coronarien aigu a été confrontée aux nouvelles recommandations de la ESC, au sujet des dyslipidémies.
Dernières nouvelles concernant la dyslipidémie - principaux changements dans la prise en charge du SCA
François Mach
Le Dr Mach illustre l'importance du traitement hypolipémiant après un syndrome coronarien aigu (SCA). Il commence par aborder une étude du registre suédois qui a montré qu'une statine améliore de 25 % la survie à 1 an après un SCA (p = 0,001)1. L'étude MIRACL a montré que l'atorvastatine 80 mg après un SCA réduit de 16 % le risque de décès et d'événements cardiovasculaires majeurs (MACE) (p = 0,048).2 L'étude PROVE IT a prouvé que par rapport à une statine à faible intensité, une statine à haute intensité (atorvastatine 80 mg vs pravastatine 40 mg) réduit de 16 % le risque de décès et de MACE (p = 0,005).3 L'étude IMPROVE IT a montré que l'association d'ézétimibe et de simvastatine 40 mg réduit de 6 % le taux de LDL c (diminution absolue de 15 mg/dl) et le risque de décès cardiovasculaire ainsi que de MACE (p = 0,016)4.
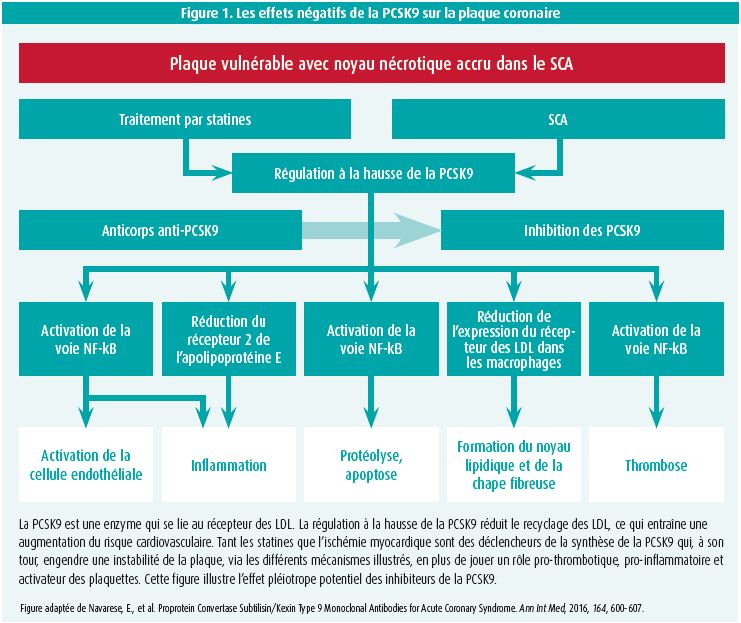
Il montre ensuite ce que recommandent les nouvelles directives de l'ESC en cas de SCA. Lors de chaque SCA, une statine à haute intensité doit être instaurée à haute dose, indépendamment du taux de LDL c (recommandation IA). Après quatre à six semaines, il convient de contrôler si une réduction > 50 % et un taux de LDL c < 55 mg/dl ont été atteints (recommandation IIaC). Si l'objectif n'a pas été atteint malgré le traitement par statine maximal toléré, l'association avec l'ézétimibe est recommandée (recommandation IB). Si l'objectif n'est pas atteint avec ce traitement, un inhibiteur de la PCSK9 est recommandé (recommandation IB). En présence d'une intolérance ou d'une contre-indication à une statine, une monothérapie par ézétimibe doit être envisagée (recommandation IIaC). Si le patient souffre d'un SCA et est déjà sous traitement par statine maximal toléré plus ézétimibe et si l'objectif de < 55 mg/dl n'a pas été atteint, il est recommandé d'instaurer un inhibiteur de la PCSK9 rapidement après l'événement (recommandation IIaC). La justification pour une réduction rapide du taux de LDL c au moyen d'inhibiteurs de la PCSK9 après un SCA découle de l'observation du fait que la PCSK9 joue un rôle pro-inflammatoire, oxydant et pro-thrombotique. En outre, l'ischémie cardiaque fait augmenter la production de PCSK9, ce qui implique conceptuellement qu'un inhibiteur de la PCSK9 peut avoir un effet anti-inflammatoire et stabilisateur de la plaque peu de temps après un SCA (figure 1)5.
Confrontation à la réalité: directives et pratique clinique
Gaetano De Ferrari
Le Dr De Ferrari a présenté les résultats que nous obtenons dans la pratique actuelle. L'étude EUROASPIRE V a montré qu'en prévention secondaire, 71 % n'atteignent pas un taux de LDL c < 70 mg/ dl6. Le registre DYSIS II montre que 59,4 % en Belgique n'atteignent pas cet objectif7.
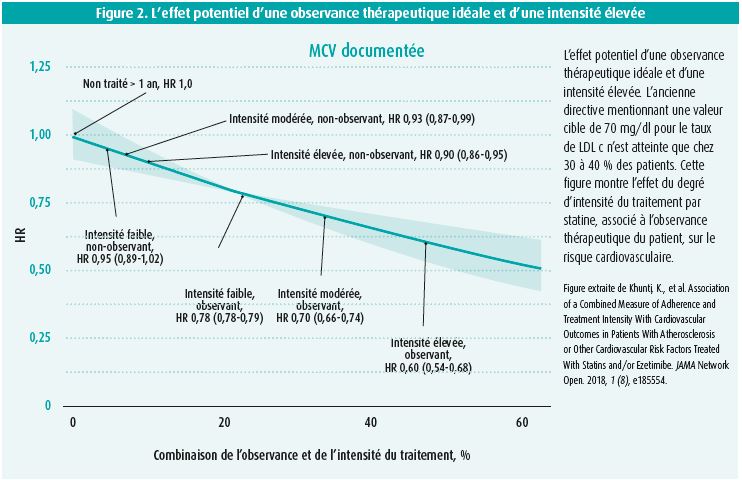
Les directives ne sont donc pas suivies à la lettre aujourd'hui. Il pose alors la question de savoir s'il est bien nécessaire de les respecter scrupuleusement. Une étude portant sur l'effet combiné de l'observance thérapeutique et de l'intensité du traitement par statine a montré qu'un patient qui prend scrupuleusement une statine à haute intensité atteint une réduction du risque cardiovasculaire de près de 50 % (figure 2)8. Si chaque patient suit un traitement hypolipémiant optimal, un tiers des événements cardiovasculaires peut être évité (23,7 événements/1000 patients-années). Cette étude montre que cela vaut la peine de suivre les directives!
Dans ce cas, n'avons-nous pas peur des taux de LDL c très bas? Lors de l'étude IMPROVE IT, 4780 patients ont atteint un taux de LDL c < 50 mg/dl, parmi lesquels 971 ont atteint un taux < 30 mg/dl. Lors de l'étude FOURIER, 504 patients ont atteint un taux de LDL c < 10 mg/dl. Lors des deux études, aucun problème de sécurité en association avec ces taux de LDL c très bas n'a été observé (respectivement 7 ans et 3 ans de suivi), tandis qu'une poursuite de la réduction de la mortalité s'est manifestée.
Pour conclure, il déclare, en se basant sur l'étude LAPLACE 2, que le choix entre l'ézétimibe et un inhibiteur de la PCSK9 doit plutôt dépendre de la diminution exigée du taux de LDL c pour atteindre l'objectif9. Dès qu'une réduction > 20-25 % du taux de LDL c est nécessaire, un inhibiteur de la PCSK9 peut être préféré.
Le futur, c'est maintenant
Marc Sabatine
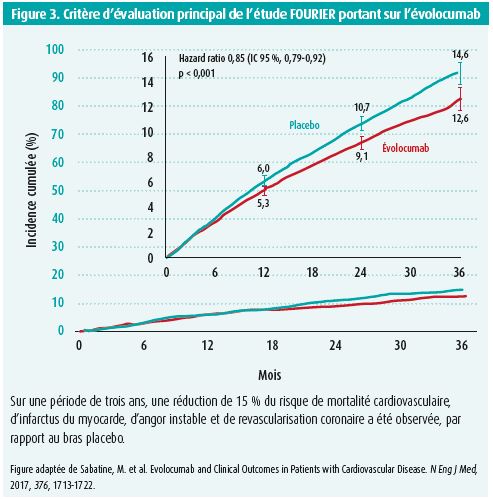
Marc Sabatine présente les résultats des études FOURIER et ODYSSEY OUTCOMES. Lors de l'étude FOURIER, une réduction de 59 % du taux de LDL c et une réduction de 15 % du risque de mortalité cardiovasculaire, d'infarctus du myocarde, d'angor instable et de revascularisation coronaire ont été observées chez les patients stables prenant de l'évolocumab en plus d'une statine à haute intensité (p < 0,0001) (figure 3)10. Lors de l'étude ODYSSEY OUTCOMES, une réduction aussi forte du taux de LDL c et une réduction du risque de MACE ont été observées avec l'alirocumab dans un contexte post-SCA (HR 0,85; p = 0,003)11. Dans les deux études, aucun signal de problème de sécurité quelconque ni une mortalité accrue n'ont été observés en présence de taux de LDL c extrêmement bas. En outre, l'étude GLAGOV basée sur des mesures IVUS montre que l'évolocumab induit même une régression de l'athéromatose coronarienne12.
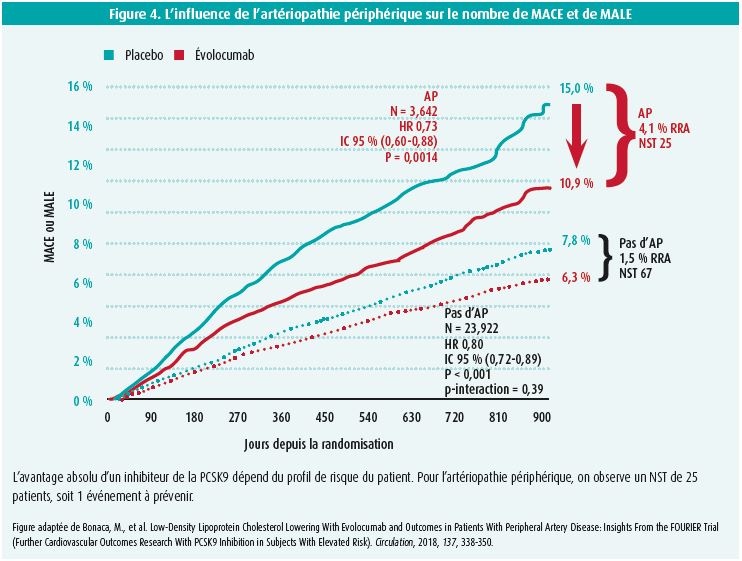
L'avantage absolu dépend évidemment de la gravité du profil de risque. Une séparation plus rapide des courbes de survie et un effet plus marqué sont observés dans le sous-groupe qui a été victime d'un infarctus du myocarde < 2 ans, de ≥ 2 infarctus du myocarde antérieurs ou en cas d'affection multivasculaire13. Pour l'artériopathie périphérique, en particulier, on observe une plus grande réduction du risque absolu de MACE (3,5 % contre 1,6 %; HR 0,79), de sorte que le nombre de patients qui doivent être traités pour prévenir un événement cardiovasculaire majeur n'est que de 29 (au lieu de 63)14. Cet effet est encore plus marqué si les MACE et les MALE (événements indésirables majeurs touchant les membres) sont combinés (HR 0,73; NST 25) (figure 4).
étude EVOPACS
Konstantinos Koskinas
L'étude EVOPACS examine l'effet d'un inhibiteur de la PCSK9 (évolocumab) en plus d'une statine à haute intensité dans le contexte d'un SCA15. L'effet de réduction du taux de LDL c des inhibiteurs de la PCSK9 est en effet puissant et intervient rapidement. En outre, les inhibiteurs de la PCSK9, à l'instar des statines, ont probablement des effets pléiotropes sur l'inflammation, sur l'activation plaquettaire et dans le cadre de la prévention des lésions rénales induites par les produits de contraste5.
L'évolocumab a permis d'atteindre un taux de LDL c < 55 mg/dl chez 90,1 % des patients après huit semaines, contre 10,7 % dans le groupe de contrôle recevant l'atorvastatine 40 mg. Aucune différence n'a été observée en ce qui concerne le nombre d'effets indésirables, la hs CRP, la réactivité plaquettaire, la fonction rénale et les lésions myocardiques après une PCI.
L'évolocumab dans le contexte d'un SCA entraîne une réduction importante du taux de LDL c, ce qui est bien toléré. L'impact clinique doit encore être prouvé, mais un inhibiteur de la PCSK9 sera probablement indispensable pour atteindre le taux de LDL c < 55 mg/dl recommandé.
Références
- Stenestrand, U., Wallentin, L. Early statin treatment following acute myocardial infarction and 1-year survival. JAMA, 2001, 285 (4), 430-436.
- Schwartz, G., Olsson, A., Ezekowitz, M., Ganz, P., Oliver, M., Waters, D., et al. Effect of atorvastatin on early recurrent ischemic events in acute coronary syndromes. The MIRACL study: A randomized controlled trial. JAMA, 2001, 285 (13), 1711-1718.
- Cannon, C., Braunwald, E., McCabe, C., Rader, D., Rouleau, J., Belder, R., et al. Intensive versus Moderate Lipid Lowering with Statins after Acute Coronary Syndromes. N Engl J Med, 2004, 350, 1495-1504.
- Cannon, C., Blazing, M., Ciugliano, R., McCagg, A., White, J., Theroux, P., et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med, 2015, 372, 2387-2397.
- Navarese, E., Kolodziejczak, M., Kereiakes, D., Tantry, U., O'Connor, C., Gurbel, P. Proprotein Convertase Subtilisin/Kexin Type 9 Monoclonal Antibodies for Acute Coronary Syndrome. Ann Int Med, 2016, 164, 600-607.
- De Backer, G., Jankowski, P., Kotseva, K., Mirrakhimov, E., Reiner, Z., Tokgözoglu, L., et al. Management of dyslipidaemia in patients with coronary heart disease: results from the ESC-EORP EUROASPIRE V survey in 27 countries. Atherosclerosis, 2019, 285, 135-146.
- Hermans, M., Gevaert, S., Descamps, O., Missault, L., Gillot, B., De Keyzer, D., et al. Frequency and predictors of cholesterol target attainment in patients with stable coronary heart disease in Belgium: results from the Dyslipidemia International Study II (DYSIS II CHD). Acta Clin Belg, 2018, 1-6.
- Khunti, K., Danese, M., Kutikova, L., Catterick, D., Sorio-Vilela, F., Gleeson, M., et al. Association of a Combined Measure of Adherence and Treatment Intensity With Cardiovascular Outcomes in Patients With Atherosclerosis or Other Cardiovascular Risk Factors Treated With Statins and/or Ezetimibe. JAMA Network Open, 2018, 1 (8): e185554.
- Robinson, J., Nedergaard, B., Rogers, W., Fialkow, J., Neutel, J., Ramstad, D., et al. Effect of Evolocumab or Ezetimibe Added to Moderate- or High-Intensity Statin Therapy on LDL-C Lowering in Patients With Hypercholesterolemia: The LAPLACE-2 Randomized Clinical Trial. JAMA, 2014, 311 (18), 1870-1883.
- Sabatine, M., Giugliano, R., Keech, A., Honarpour, N., Wiviott, S., Murphy, S., et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med, 2017, 376, 1713-1722.
- Schwartz, G., Szarek, M., Bhatt, D., Bittner, V., Edelberg, J., Goodman, S., et al. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med, 2018, 379, 2097-2107.
- Nicholls, S., Puri, R., Anderson, T., Ballantyne, C., Cho, L., Kaastelein, J., et al. Effect of Evolocumab on Progression of Coronary Disease in Statin-Treated Patients: The GLAGOV Randomized Clinical Trial. JAMA, 2016, 316 (22), 2373-2384.
- Sabatine, M., De Ferrari, G., Giugliano, R., Huber, K., Lewis, B., Ferreira, J., et al. Clinical Benefit of Evolocumab by Severity and Extent of Coronary Artery Disease. Circulation, 2018, 138, 756-766.
- Bonaca, M., Nault, P., Giugliano, R., Keech, A., Pineda, A., Kanevsky, E., et al. Low-Density Lipoprotein Cholesterol Lowering With Evolocumab and Outcomes in Patients With Peripheral Artery Disease: Insights From the FOURIER Trial (Further Cardiovascular Outcomes Research With PCSK9 Inhibition in Subjects With Elevated Risk). Circulation, 2018, 137, 338-350.
- Koskinas, K., Windecker, S., Pedrazzini, G., Mueller, C., Cook, S., Matter, C., et al. Evolocumab for Early Reduction of LDL-Cholesterol Levels in Patients with Acute Coronary Syndromes (EVOPACS). JACC, doi: 10.1016/j. jacc.2019.08.010.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.