La fibrillation auriculaire est l'arythmie cardiaque la plus fréquente. Malgré les spectaculaires progrès enregistrés sur le plan des techniques d'ablation pour le traitement de cette arythmie, les résultats du traitement sont sous-optimaux. Raison suffisante pour que les organisateurs de la réunion de la BeHRA donnent la parole à deux experts, afin d'expliquer les causes de l'échec de l'ablation et l'effet de la poursuite du traitement médical.
Dans la première partie de cette session, le Dr Kottkamp de Düsseldorf a analysé l'effet de la fibrose auriculaire sur les résultats d'une ablation de fibrillation auriculaire. Sur la base de ses propres résultats de recherche, il a défini l'entité appelée 'cardiomyopathie auriculaire fibrotique' (fibrotic atrial cardiomyopathy, ou FACM)1. La fibrose se développe à la suite d'une libération excessive de matrice extracellulaire (principalement du collagène I, du collagène III et de la fibronectine) entre les cardiomyocytes auriculaires, ce qui se traduit par une diminution des voltages électriques. De ce fait, les zones de fibrose peuvent être identifiées pendant une ablation de fibrillation auriculaire, par le biais d'une carte de voltage de l'oreillette gauche, où la fibrose auriculaire correspond à des zones de faibles voltages. En fonction du degré de fibrose, on décrit cinq types de FACM (0-4) (figure 1).
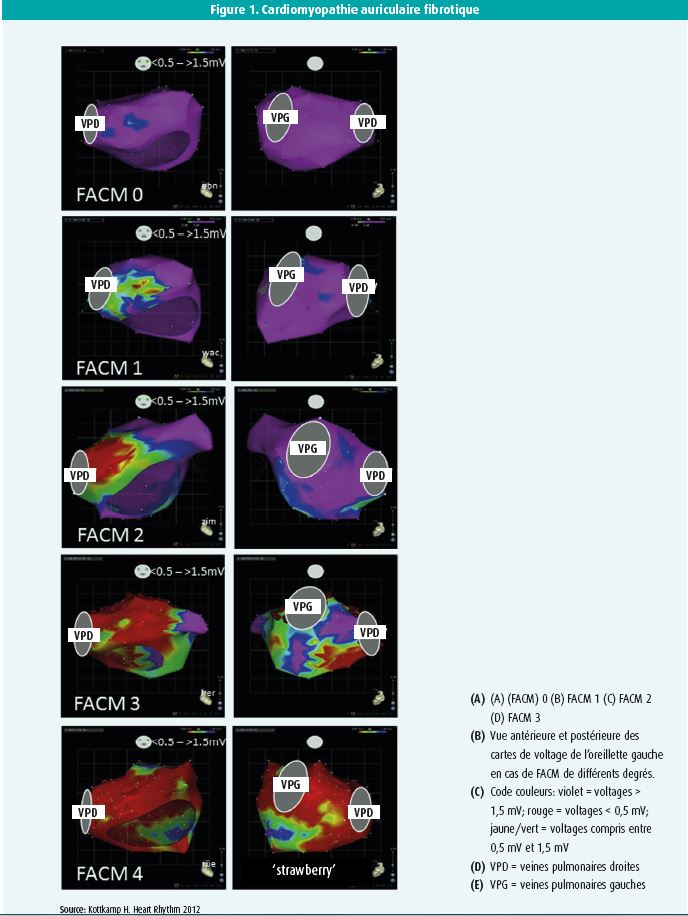
Des études anatomopathologiques ont montré que la survenue d'une fibrillation auriculaire est associée à une augmentation significative de la fibrose dans l'oreillette gauche, mais qu'il n'existe aucune corrélation entre la quantité de fibrose auriculaire et l'âge, l'hypertension artérielle, le diabète et les maladies coronariennes, et seulement une corrélation limitée et non significative entre la quantité de fibrose auriculaire et la durée de la fibrillation auriculaire (paroxystique vs persistante prolongée)2-3. En cas de valvulopathie mitrale sous-jacente, associée à une dilatation de l'oreillette gauche, on a observé une augmentation significative de la fibrose. Il semble donc qu'il existe une grande variation dans l'apparition de la fibrose chez les patients souffrant de fibrillation auriculaire. Un jeune patient présentant une fibrillation auriculaire paroxystique d'apparition récente sans autres facteurs de risque peut avoir une fibrose diffuse lors du mapping de voltage. En revanche, un patient âgé souffrant de fibrillation auriculaire persistante depuis plusieurs années, d'hypertension et de diabète peut avoir une oreillette gauche avec des voltages tout à fait normaux.
Verma et al. ont démontré que la fibrose auriculaire est un facteur de risque indépendant pour une récidive de fibrillation auriculaire, après une isolation fructueuse des veines pulmonaires4.
Dans sa propre étude portant sur 141 patients, le Dr Kottkamp a évalué l'effet d'une isolation circonférentielle supplémentaire des zones de fibrose (Box Isolation of Fibrotic Areas [BIFA]) en plus de l'isolation des veines pulmonaires sur le résultat d'une ablation5. Dans cette étude, 49 patients témoins indemnes de fibrose auriculaire (FACM 0) ont été traités uniquement par isolation des veines pulmonaires, et 92 patients présentant différents degrés de fibrose (FACM 1 à 4) ont été traités par isolation des veines pulmonaires et isolation circonférentielle additionnelle des zones de fibrose (BIFA). Cette approche a conduit à un taux de succès procédural multiple (1,1 procédure par patient) de 94 % dans le groupe témoin, 93 % en cas de FACM 1 et 2, et 61 % en cas de FACM 3 et 4, essentiellement en raison d'un taux de succès de 20 % seulement en cas de FACM 4.
Ces données apportent un éclairage nouveau sur le rôle de quelques-uns des facteurs de risque classiques (âge, hypertension, diabète et maladie coronarienne) et sur l'adage 'AF begets AF', dans lequel on supposait par le passé que la présence de facteurs de risque et surtout la persistance de la fibrillation auriculaire étaient la principale cause d'apparition de fibrose auriculaire. Les résultats du traitement spécifique de cette fibrose au moyen de l'isolation circonférentielle sont prometteurs, mais ils doivent encore être confirmés dans des études multicentriques avec de grands nombres de patients.
Dans la deuxième partie de cette session, le Pr Duytschaever de Bruges a fait un exposé sur l'effet de la poursuite des antiarythmiques après une isolation des veines pulmonaires pour une fibrillation auriculaire paroxystique.
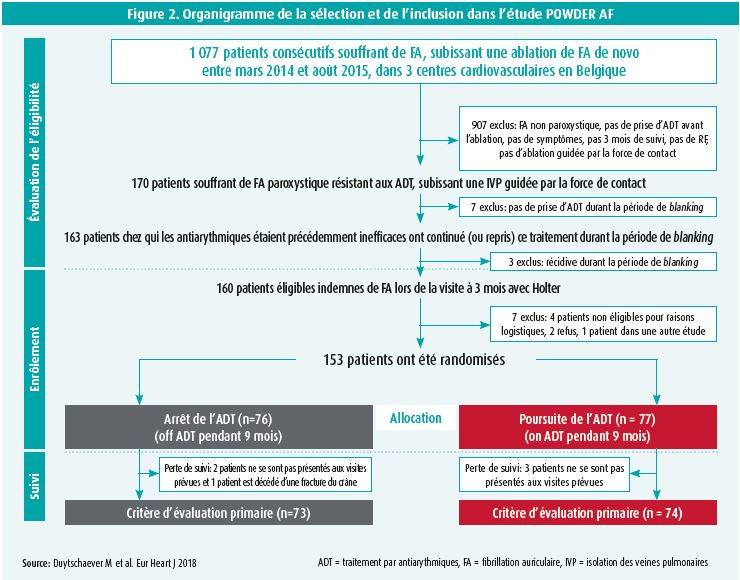
L'effet des antiarythmiques sur le maintien du rythme sinusal chez les patients atteints de fibrillation auriculaire varie de 50 % (sotalol), plus de 60 % (classe Ic) à 70 % (amiodarone)6. L'effet de l'ablation sur le maintien du rythme sinusal varie de 50 à 80 %, en fonction du type de fibrillation auriculaire (paroxystique vs persistante ou persistante prolongée)7. Une enquête européenne sur le suivi des patients après une ablation de fibrillation auriculaire a montré qu'après une ablation, les antiarythmiques sont fréquemment poursuivis (amiodarone dans 12 % des cas, antiarythmiques de classe I dans 19 % des cas)8. Cependant, la reprise des antiarythmiques après la période de 'blanking' de 3 mois est considérée dans de nombreuses études et évaluations de l'effet de l'ablation comme un échec de la procédure d'ablation9, 10. Pourtant, des études observationnelles ont montré que le traitement par antiarythmiques après l'ablation augmente considérablement les chances de maintien du rythme sinusal, avec un effet plus marqué en cas de récidives tardives11. Dès lors, le Pr Duytschaever et son équipe ont mis sur pied l'étude multicentrique randomisée POWDER AF, pour évaluer l'effet de la poursuite des antiarythmiques sur la prévention des récidives après une ablation de fibrillation auriculaire paroxystique symptomatique, résistante aux antiarythmiques12.
Dans cette étude, un traitement par des agents antiarythmiques précédemment inefficaces a été poursuivi pendant la période de blanking de 3 mois, après une ablation de fibrillation auriculaire paroxystique au moyen d'une isolation des veines pulmonaires guidée par la force de contact (figure 2). Par la suite, les patients qui n'ont pas développé de récidive au cours de cette période de blanking ont été randomisés vers la poursuite des antiarythmiques (groupe ADT ON) ou leur arrêt (groupe ADT OFF). Tous les patients ont été suivis jusqu'à un an après la procédure, au moyen d'une évaluation clinique, d'un monitoring de Holter et d'enquêtes sur la qualité de vie à 6 et 12 mois après la procédure.
Le critère d'évaluation primaire, soit l'apparition d'une arythmie auriculaire de plus de 30 secondes, a été observé chez 2,7 % des patients du groupe ADT ON et 21,9 % des patients du groupe ADT OFF (p < 0,001) (figure 3). Dans le groupe ADT ON, on notait une fréquence moindre de nouvelles ablations (1,4 % vs 19,2 %, HR 0,053; intervalle de confiance à 95 % 0,007-0,399; p < 0,01), et moins de consultations imprévues liées à l'arythmie (2,7 % vs 20,5 %, HR 0,055; IC 95 % 0,007-0,410; p lt; 0,01). Les scores de qualité de vie étaient comparables dans les deux groupes.
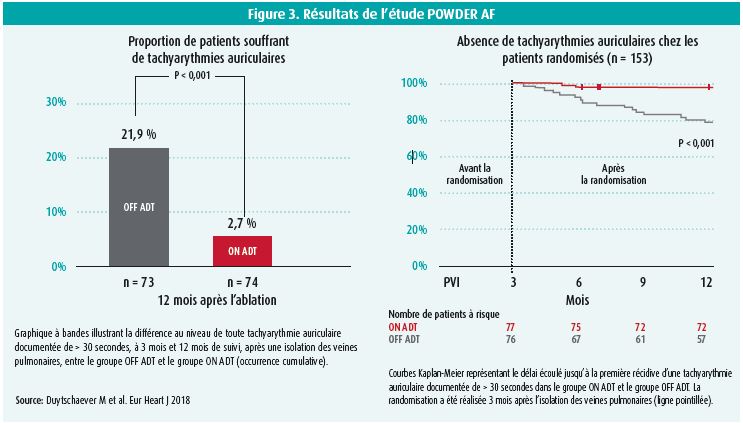
Le Pr Duytschaever a donc conclu que la poursuite des antiarythmiques précédemment inefficaces réduisait significativement le risque de récidive au cours de la première année suivant l'ablation, chez les patients souffrant de fibrillation auriculaire paroxystique, indemnes de récidive de l'arythmie auriculaire 3 mois après une isolation des veines pulmonaires.
Une étude multicentrique randomisée similaire évaluant l'effet de la poursuite des antiarythmiques après une ablation de fibrillation auriculaire persistante est actuellement en cours.
Références
- Kottkamp, H. Atrial fibrillation substrate: the "unknown species"-- from lone atrial fibrillation to fibrotic atrial cardiomyopathy. Heart Rhythm, 2012, 9 (4), 481-482.
- Boldt, A., Wetzel, U., Lauschke, J., Weigl, J., Gummert, J., Hindricks, G., et al. Fibrosis in left atrial tissue of patients with atrial fibrillation with and without underlying mitral valve disease. Heart, 2004, 90 (4), 400-405.
- Platonov, P.G., Mitrofanova, L.B., Orshanskaya, V., Ho, S.Y. Structural abnormalities in atrial walls are associated with presence and persistency of atrial fibrillation but not with age. J Am Coll Cardiol, 2011, 58 (21), 2225-2232.
- Verma, A., Wazni, O.M., Marrouche, N.F., Martin, D.O., Kilicaslan, F., Minor, S., Schweikert, R.A., et al. Pre-existent left atrial scarring in patients undergoing pulmonary vein antrum isolation: an independent predictor of procedural failure. J Am Coll Cardiol, 2005, 45 (2), 285-292.
- Schreiber, D., Rieger, A., Moser, F., Kottkamp, H. Catheter ablation of atrial fibrillation with box isolation of fibrotic areas: Lessons on fibrosis distribution and extent, clinical characteristics, and their impact on long-term outcome. J Cardiovac Electrophysiol, 2017, 28 (9), 971-983.
- Lafuente-Lafuente, C., Mouly, S., Longás-Tejero, M.A., Mahé, I., Bergmann, J.F. Antiarrhythmic drugs for maintaining sinus rhythm after cardioversion of atrial fibrillation: a systematic review of randomized controlled trials. Arch Intern Med, 2006, 166 (7), 719-728.
- Andrade, J.G., Verma, A., Mitchell, L.B., Parkash, R., Leblanc, K., Atzema, C. et al. 2018 Focused Update of the Canadian Cardiovascular Society Guidelines for the Management of Atrial Fibrillation. Can J Cardiol, 2018, 34 (11), 1371-1392.
- Arbelo, E., Brugada, J., Hindricks, G., Maggioni, A.P., Tavazzi, L., Vardas, P. et al. The atrial fibrillation ablation pilot study: a European Survey on Methodology and results of catheter ablation for atrial fibrillation conducted by the European Heart Rhythm Association. Eur Heart J, 2014, 35 (22), 1466-1478.
- Kuck, K., Brugada, J., Albenque J. Cryoballoon or Radiofrequency Ablation for Atrial Fibrillation. N Engl J Med, 2016, 375 (11), 1100-1101.
- Van Brabandt, H., Neyt, M., Devos, C. Effectiveness of catheter ablation of atrial fibrillation in Belgian practice: a cohort analysis on administrative data. Europace, 2013, 15 (5), 663-668.
- Gaztañaga, L., Frankel, D.S., Kohari, M., Kondapalli, L., Zado, E.S., Marchlinski, F.E. Time to recurrence of atrial fibrillation influences outcome following catheter ablation. Heart Rhythm, 2013, 10 (1), 2-9.
- Duytschaever, M. Demolder, A., Phlips, T., Sarkozy, A., El Haddad, M., Taghji, P. et al. PulmOnary vein isolation With vs. without continued antiarrhythmic Drug trEatment in subjects with Recurrent Atrial Fibrillation (POWDER AF): results from a multicentre randomized trial. Eur Heart J, 2018, 39 (16), 1429-1437.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.