Introduction
Le meilleur site de stimulation cardiaque est débattu depuis de nombreuses années. En effet, si la région apicale du ventricule droit a toujours été privilégiée, on sait que la primo-activation de celle-ci peut être délétère sur le plan fonctionnel, notamment par le biais d'un asynchronisme de contraction1.
La resynchronisation biventriculaire associant la stimulation apicale ventriculaire droite à une stimulation ventriculaire gauche via le sinus coronaire a révolutionné la prise en charge non médicamenteuse de l'insuffisance cardiaque avec dysfonction systolique du ventricule gauche (HFREF)2. Toutefois, cette approche ne donne pas complète satisfaction puisqu'il persiste toujours environ 30 % de non-répondeurs3 et qu'elle ne permet pas de traiter tous les patients en insuffisance cardiaque, notamment ceux qui présentent un QRS fin à l'électrocardiogramme4.
La stimulation hissienne n'est pas un concept neuf: le premier enregistrement de signaux en provenance du faisceau de His (figure 1) et sa stimulation avaient déjà été décrits chez le chien en 19675 puis chez l'homme en 19956.
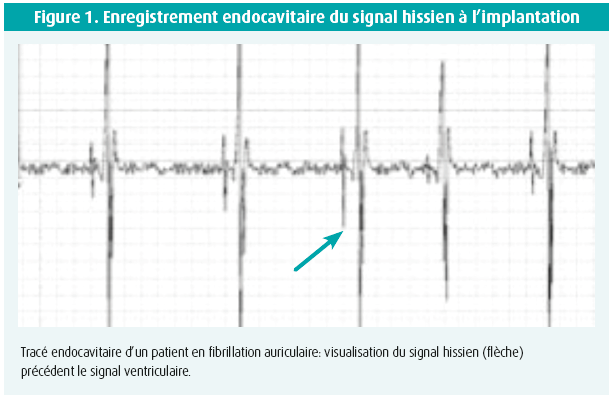
La description initiale de stimulation hissienne permanente chez l'homme remonte à 2 000 dans une étude originale portant sur des patients en fibrillation auriculaire chronique avec dysfonction systolique ventriculaire gauche, chez lesquels une ablation du noeud AV avait été pratiquée. Dans ces conditions, la stimulation hissienne a montré une réduction des dimensions du ventricule gauche ainsi qu'une amélioration de sa fonction systolique7.
L'intérêt potentiel de la stimulation hissienne est qu'elle produit une dépolarisation ventriculaire plus physiologique que la stimulation ventriculaire droite apicale ou biventriculaire via le sinus coronaire. Elle emprunte le système His-Purkinje natif responsable d'une activation normale des deux ventricules, sans entrainer d'asynchronisme de contraction. Elle peut être sélective ou non sélective et est à même de corriger un bloc de branche gauche dans un certain nombre de cas. Elle nécessite néanmoins une programmation spécifique chez les patients appareillés.
Anatomie et physiologie du faisceau de His
Les premières descriptions du faisceau de His et de ses branches remontent à 1893. Son tronc principal fait suite au noeud AV compact et est situé au sein du septum membraneux, d'abord sur sa portion atrioventriculaire droite puis ventriculaire gauche se dirigeant vers le bas et la gauche par rapport au noeud AV. Il mesure environ 20 mm de long sur 2 mm d'épaisseur et est entouré d'une zone transitionnelle constituée de tissu fibreux. C'est au niveau de la crête du septum musculaire qu'il se divise en deux branches, la branche gauche se divisant elle-même en trois fascicules après deux centimètres. De nombreuses ramifications et interconnexions sous-endocardiques y font suite8. Trois variantes anatomiques ont été décrites concernant les rapports entre le septum interventriculaire (membraneux et musculaire) et le faisceau de His, ce qui peut avoir une implication sur les seuils de stimulation et sur les transitions observées lors des tests9. Une stimulation ventriculaire permanente peut être obtenue par stimulation de la portion atriale ou ventriculaire du faisceau de His.
Le faisceau de His est constitué d'une multitude de fibres conductrices au sein d'une gaine commune et séparée par des fibres de collagène limitant la propagation latérale de l'influx électrique. En l'absence de 'lésion', il existe de nombreuses interconnexions entre ces fibres qui favorisent la propagation transversale de l'influx électrique au sein du faisceau de His et y assurent une relative homogénéité des vitesses de conduction en son sein10. En cas d'ischémie, d'atteinte inflammatoire ou de toute autre cause de 'souffrance physiologique', cette conduction transversale de l'influx électrique est altérée et un bloc fonctionnel de la conduction transversale est observé. Enfin, rappellons que contrairement au noeud AV, le faisceau de His n'a pas de propriétés décrémentielles.
Matériel et techniques d'implantation de la sonde hissienne
L'enthousiasme initial de la stimulation hissienne était tempéré par l'absence d'outils d'implantation adaptés. Au départ, on utilisait du matériel standard qu'on modifiait en préformant les stylets mais cette approche était techniquement difficile, responsable de procédures longues et grevée d'un taux d'échec important. De plus, une sonde de mapping électrophysiologique devait être utilisée pour repérer le faisceau de His. Ensuite sont apparus des introducteurs spécifiques (introducteurs C315, C304 Selectsite Medtronic) qui, couplés à des sondes actives souples (Selectsecure) ont permis d'atteindre des taux de succès procédural de plus de 90 % tout en raccourcissant les temps de procédure et de fluoroscopie (figure 2)11, 12.
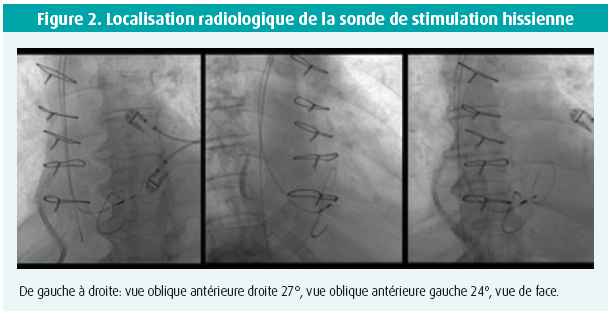
En pratique, après avoir ponctionné la veine sous-clavière gauche et mis en place un introducteur classique par la technique de Seldinger, un long guide métallique est avancé jusqu'à hauteur de l'anneau tricuspide sous contrôle fluoroscopique. L'introducteur C315 est alors glissé le long du guide pour être positionné dans l'oreillette droite. La sonde est ensuite introduite à la place du guide et glissée dans l'introducteur sans cependant dépasser son extrémité. Elle est alors connectée à un système d'enregistrement et après mobilisation adéquate, les signaux endocavitaires (unipolaires) atriaux, hissiens et ventriculaires sont enregistrés en rythme sinusal à 100 mm/s pour un ratio A/V d'au maximum 1:2. Lorsque le signal hissien est obtenu, on tente de le capturer par une stimulation à 10 volts pour 1 milliseconde en l'analysant sur un électrocardiogramme à 12 dérivations. En cas de bloc auriculo-ventriculaire complet, une technique de stimulation locale ('pacemapping'), bien que plus fastidieuse, peut également être utilisée. La sonde est alors fixée en la tournant ± 5 fois dans le sens des aiguilles d'une montre. L'introducteur est ensuite retiré et le seuil de stimulation vérifié en unipolaire et en bipolaire pour des valeurs optimales inférieures ou égales à 2 volts pour 1 milliseconde. Un courant de lésion peut s'observer dans 40 % des cas à l'implantation, prédisant un excellent seuil de capture à court et long terme13.
Physiologie de la stimulation hissienne
La capture hissienne est plus difficile à obtenir qu'une capture myocardique classique à l'apex du ventricule droit car le faisceau de His est généralement entouré de tissu fibreux. De plus, sa taille relativement petite (20 mm de long sur 2 mm d'épaisseur) rend son abord difficile.
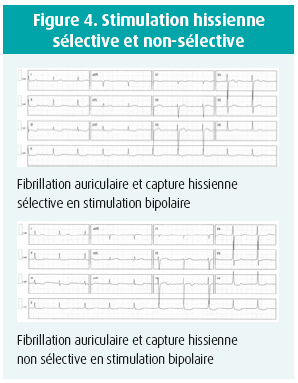
Capture sélective et non sélective (figures 3 et 4)
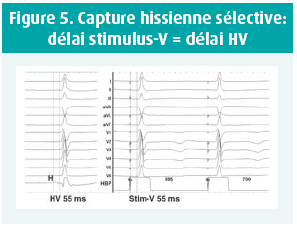
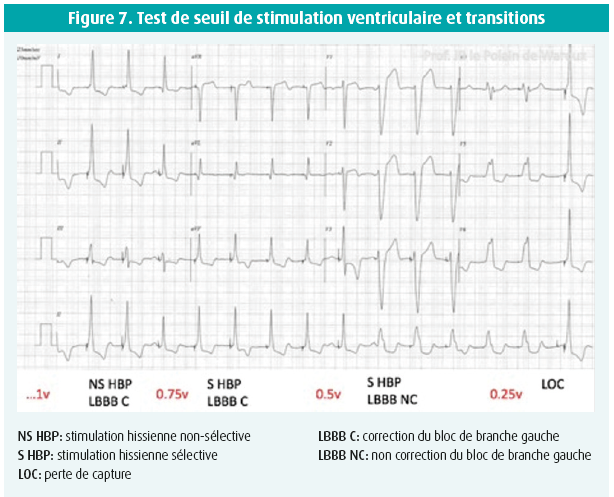
On distingue une capture hissienne sélective et non sélective. Une capture sélective (hissienne pure) est caractérisée à l'électrocardiogramme par une stimulation suivie d'un délai correspondant au temps de dépolarisation hissien (Délai stimulus-V = délai HV, voir figure 5) avant d'observer un QRS dont la morphologie est identique aux QRS natifs du patient. Une capture hissienne non sélective se marque sur l'électrocardiogramme par une stimulation directement suivie par une 'pseudo onde delta' correspondant à une dépolarisation du tissu myocardique local avoisinant le faisceau de His et se surajoutant à la capture hissienne sélective proprement dite. Le caractère sélectif ou non de la capture dépend de la position de la sonde par rapport au His, de la nature du tissu environnant et de l'amplitude de stimulation14, 15. Il est à noter qu'à l'heure actuelle, il n'est pas démontré qu'une stimulation sélective comporte un avantage hémodynamique quelconque par rapport à une stimulation non sélective. Au contraire, cette dernière garantit une capture parahissienne en cas de perte de capture du His. Lors d'un test de seuil de capture ventriculaire, la forme sélective suit généralement la capture non sélective. L'inverse est en théorie impossible mais la transition entre ces deux formes n'est pas toujours observée. Les différences de seuil sont souvent faibles et lorsqu'on programme une stimulation avec une marge de sécurité, on observe généralement une capture non sélective. Il existe actuellement 4 critères pour définir le caractère sélectif ou non de la capture hissienne:
- La relation entre les intervalles His-QRS et S-QRS;
- La présence ou l'absence de capture directe de l'électrogramme ventriculaire local sur la sonde de stimulation;
- La durée et la morphologie des QRS;
- Le seuil de capture.
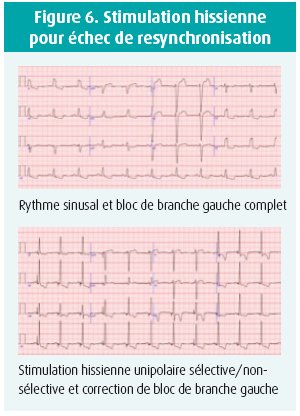
Correction d'un bloc de branche gauche (figure 6)
La stimulation hissienne est à même de corriger complètement ou partiellement un bloc de branche gauche complet jusqu'à 70 à 90 % des cas dans les meilleures séries, affinant le QRS de surface sur l'électrocardiogramme 12 dérivations16, 17. Le degré de correction peut varier avec l'énergie de stimulation ou non. Cela se traduit par une réduction de l'asynchronisme de contraction ventriculaire. Les mécanismes proposés pour expliquer la correction du bloc de branche sont les suivants:
- La stimulation peut s'effectuer en aval du niveau lésionnel, restaurant ainsi la conduction de la branche gauche18, 19.
- Une augmentation de la densité de courant en amont de la lésion peut réactiver la conduction distale (ce qui corrobore l'hypothèse d'un bloc fonctionnel).
- La capture d'une branche septale haute peut entrainer une activation hétérolatérale du His-Purkinje au-delà de la zone de bloc.
Lors du suivi d'un patient porteur d'une stimulation hissienne, différents seuils de stimulation peuvent être observés (transitions, voir figure 7): seuil de stimulation sélective, seuil de stimulation non-sélective, seuil de correction (partielle ou complète) du bloc de branche gauche, perte de capture … Il est recommandé de noter la valeur de ces différents seuils dans le dossier du patient. À noter qu'ils ne sont pas toujours tous présents et que de nombreuses formes de transition peuvent être observées.
Indications de la stimulation hissienne
Des études de faisabilité et de sécurité de la stimulation hissienne ont initialement été réalisées7, 20. On a alors montré que celle-ci n'entrainait pas d'asynchronisme de contraction21.
Stimulation hissienne et fibrillation auriculaire
Des études observationnelles ont suivi chez des patients insuffisants cardiaques en fibrillation auriculaire pour lesquels une ablation du noeud auriculo-ventriculaire était associée à la stimulation hissienne7, 22. L'ablation du noeud auriculo- ventriculaire pouvait être précédée, au cours de la même procédure, de l'implantation de la sonde hissienne qui servait alors de repère pour réaliser l'ablation suffisamment en amont afin d'éviter que celle-ci, trop proche de la sonde, ne provoque une élévation des seuils de stimulation. Le cathéter d'ablation était positionné à hauteur du ring de la sonde hissienne23. Des bénéfices étaient observés en termes de remodelage cardiaque, fonction systolique du ventricule gauche, réduction des hospitalisations pour insuffisance cardiaque et diminution de l'usage des diurétiques.
Stimulation hissienne et bloc auriculoventriculaire de haut grade
La stimulation hissienne a également été envisagée chez des patients présentant un bloc auriculo-ventriculaire de haut grade et des QRS fins24. Une sonde 'back up' était implantée à l'apex du ventricule droit par sécurité (figure 8). La stimulation hissienne pouvait dès lors être comparée à la stimulation apicale du ventricule droit chez le même patient, montrant une amélioration significative de la fraction d'éjection du ventricule gauche avec la stimulation hissienne. À noter que plus le niveau du bloc est haut situé, plus le taux de succès de la stimulation hissienne est élevé25.
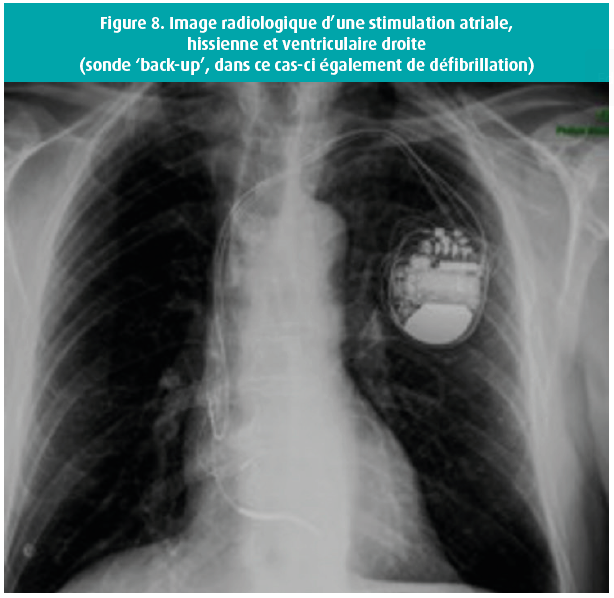
Une sonde 'back-up' est potentiellement envisagée en cas de seuil hissien élevé, de bloc auriculo-ventriculaire complet sans rythme d'échappement ou de bloc auriculo-ventriculaire traumatique per procédural (plus rare).
Comparaison entre la stimulation hissienne et la stimulation apicale ventriculaire droite
La stimulation hissienne a été comparée à la stimulation apicale ventriculaire droite dans plusieurs études montrant une réduction des indices échocardiographiques d'asynchronisme et une amélioration de la fonction systolique du ventricule gauche ainsi qu'une amélioration de la capacité d'effort16, 26. Une étude observationnelle a montré une réduction de l'objectif combiné hospitalisations pour insuffisance cardiaque et mortalité à cinq ans en faveur de la stimulation hissienne par rapport à la stimulation apicale ventriculaire droite si le taux de stimulation ventriculaire était supérieur à 40 %. La fraction d'éjection ventriculaire gauche n'était pas modifiée dans le groupe stimulation hissienne alors qu'elle était détériorée dans le groupe stimulation apicale ventriculaire droite. Il y avait également moins de tachycardiomyopathies dans le groupe stimulation hissienne27. Une seconde étude observationnelle a également montré une réduction des hospitalisations pour insuffisance cardiaque et de la mortalité toutes causes en faveur de la stimulation hissienne pour un taux de stimulation supérieur à 20%28. Des études randomisées et contrôlées sont toutefois nécessaires pour confirmer ces données.
Stimulation hissienne et resynchronisation cardiaque
Une des indications prometteuses de la stimulation hissienne est représentée par les patients en insuffisance cardiaque à fraction d'éjection ventriculaire gauche réduite et présentant une indication de resynchronisation. La stimulation hissienne présente des bénéfices théoriques par rapport à la stimulation du ventricule gauche via le sinus coronaire ou l'épicarde. En effet, un certain degré d'asynchronisme persistant avec la stimulation gauche et qui peut atténuer le bénéfice de ce mode de stimulation peut souvent être corrigé par la stimulation hissienne.
Les premières études ont montré une amélioration fonctionnelle similaire entre la stimulation hissienne et la stimulation biventriculaire. La stimulation hissienne a alors été proposée comme alternative à la stimulation biventriculaire en cas d'échec de celle-ci (non-réponse, difficultés techniques ou anatomiques d'implantation de la sonde gauche) et des études observationnelles ont montré des résultats encourageants29, 30. Certains auteurs ont également montré que la stimulation hissienne pouvait être utilisée comme stratégie initiale pour la resynchronisation31.
Stimulation hissienne et bloc auriculo- ventriculaire du premier degré
Une indication originale de la stimulation hissienne a porté sur des patients insuffisants cardiaques avec bloc auriculo- ventriculaire du premier degré et bloc de branche droit complet ou QRS fins où la stimulation hissienne a été comparée à la stimulation biventriculaire. On sait en effet que le remplissage ventriculaire est altéré par un allongement du délai auriculo- ventriculaire et que ceci est associé à une augmentation de la mortalité chez les insuffisants cardiaques32. La stimulation hissienne n'a pas entrainé d'augmentation de la durée des QRS contrairement à la stimulation biventriculaire et on notait également un bénéfice hémodynamique de la stimulation hissienne33.
Recommandations actuelles concernant la stimulation hissienne
Aux États-Unis, la stimulation hissienne a fait son apparition dans les recommandations en 2018. Un niveau de recommandation IIa est retenu chez les patients présentant un bloc auriculo-ventriculaire avec indication de stimulation permanente et fraction d'éjection ventriculaire gauche entre 36 % et 50 %, et ayant un taux de stimulation attendu de plus de 40 %, en préférence à la stimulation apicale ventriculaire droite. Une recommendation de niveau IIb est également envisagée pour les patients ayant une indication de mise en place d'un stimulateur cardiaque pour bloc auriculo-ventriculaire et dont le niveau du bloc auriculo-ventriculaire se situe à hauteur du noeud34. En Europe, aucune recommandation n'est actuellement publiée sur la stimulation hissienne.
Généralités concernant la programmation d'un stimulateur cardiaque avec sonde hissienne35
La programmation d'un stimulateur cardiaque avec sonde en position hissienne va dépendre du type de stimulateur implanté et du port dans lequel la sonde hissienne est installée. Ces informations doivent absolument être mentionnées dans les données 'patient' de la prothèse et dans le dossier de suivi du patient. En général, la sonde est placée dans le port ventriculaire droit ou ventriculaire gauche en cas de mise en place d'un stimulateur cardiaque de resynchronisation. La sonde hissienne peut être placée dans le port atrial en cas de fibrillation auriculaire permanente.
Il est recommandé d'évaluer la capture hissienne sur un électrocardiogramme à 12 dérivations.
Sonde hissienne dans un port ventriculaire
Lorsque la sonde hissienne est placée dans un port ventriculaire, il faut penser au délai stimulus-QRS (= HV) qui peut être allongé. Il faudra alors raccourcir d'autant le délai auriculo-ventriculaire et désactiver les algorithmes de capture automatique (ou les mettre en mode de monitoring), ceux-ci se basant sur la présence d'un potentiel évoqué, absent en cas de délai stimulus-QRS et amenant à un risque de confusion avec une perte de capture.
Stimulation
La stimulation sera réglée, par analogie à la stimulation cardiaque conventionnelle à deux fois le seuil en voltage, la durée d'impulsion recommandée étant actuellement de 1 ms. L'énergie de stimulation sera parfois programmée plus bas pour préserver la batterie (généralement 1 volt au-dessus du seuil hissien), en particulier si le patient n'est pas stimulateur-dépendant ou s'il existe un back-up ventriculaire droit. L'énergie sera aussi parfois réglée plus bas si l'on souhaite privilégier une capture sélective pure.
Détection
La détection peut parfois également poser problème en raison de la position anatomique de la sonde et du far field atrial qui peut en découler, des potentiels hissiens de haute amplitude et d'un signal ventriculaire parfois de faible amplitude. Ceci peut avoir un impact sérieux chez les patients en bloc auriculo-ventriculaire complet par exemple. Chez ces derniers, la sensibilité doit donc être dégradée afin d'assurer une stimulation permanente.
Resynchronisation cardiaque
Dans le cas particulier d'une implantation de sonde hissienne pour resynchronisation cardiaque, celle-ci est généralement placée dans le port ventriculaire gauche et on met une sonde ventriculaire droite supplémentaire à l'apex du ventricule droit pour la détection (qui sera meilleure qu'en région hissienne) et comme stimulation de sécurité. On programme alors un mode de stimulation biventriculaire séquentiel, d'abord ventriculaire gauche (sonde hissienne) puis ventriculaire droite avec délai V-V maximal pour éviter une fusion de stimulation (délai maximal V-V possible variant de 64 à 120 ms selon les marques). Dans ce cas, la stimulation ventriculaire droite aura lieu indépendamment de la capture hissienne mais tombera en période réfractaire ventriculaire. Une stimulation ventriculaire droite de sécurité n'est toutefois pas toujours indispensable. Les algorithmes d'optimisation des délais AV et VV doivent également être désactivés car inadaptés à la situation et pouvant entrainer une programmation erronnée.
Sonde hissienne dans le port atrial
La mise en place d'une sonde hissienne dans le port atrial en cas de fibrillation auriculaire permanente est la situation qui peut le plus porter à confusion pour la programmation des stimulateurs cardiaques double ou triple chambre. Retenons que la programmation doit se faire en DDD(R), DDI(R) ou DVI(R). La valeur de programmation du délai AV revêt ici toute son importance.
Limitations de la stimulation hissienne
Le manque de stabilité de la sonde hissienne était une crainte importante initialement en l'absence de matériel approprié mais les données récentes montrent que les sondes actuelles sont relativement stables, limitant la plupart du temps la nécessité d'avoir une sonde ventriculaire droite de secours. Le taux de révision de sonde à long terme (recul jusqu'à 5 ans) est de l'ordre de 5 à 6,7 %27, 36.
La durée de la procédure est actuellement plus longue que pour la stimulation ventriculaire droite classique, mais généralement plus courte que pour une resynchronisation biventriculaire.
Le seuil de stimulation est en moyenne plus élevé, ce qui peut engendrer une déplétion prématurée de la batterie. Il faut toutefois noter qu'en cas de resynchronisation, la stimulation hissienne permet de n'utiliser qu'une seule sonde, réduisant de ce fait la consommation d'énergie par rapport à une stimulation ventriculaire droite et gauche classique. Ce problème de déplétion prématurée de batterie n'est plus actuellement limité qu'aux patients nécessitant une haute énergie pour corriger un bloc de branche gauche27, 36.
Les algorithmes actuels des stimulateurs cardiaques ne sont pas adaptés à la stimulation hissienne et ceci appelle à un effort particulier de la part de l'industrie pour créer des boitiers dédiés.
Le matériel d'implantation pourrait également encore être amélioré, en particulier la création de gaines déflectables bidirectionnelles serait souhaitable.
Perspectives de la stimulation hissienne
À l'heure actuelle, la stimulation hissienne manque de données scientifiques prospectives et randomisées pour en confirmer l'intérêt à long terme. Le potentiel de cette approche est important, tant pour les candidats à la stimulation cardiaque que pour la resychronisation. Plusieurs études prospectives sont en cours, en particulier dans l'indication de resynchronisation:
- HOPE-HF est une étude anglaise évaluant l'intérêt du pacing hissien chez des patients en insuffisance cardiaque avec bloc AV du premier degré et qui sont inéligibles pour une resynchronisation classique sur base de l'aspect ou de la durée du QRS. Cent soixante patients seront comparés sur 6 mois avec ou sans stimulation hissienne. L'évaluation primaire portera sur la capacité d'effort37.
- His-SYNC est une étude américaine qui porte sur 40 patients ayant une indication conventionnelle de resynchronisation et qui sont randomisés soit pour une resynchronisation classique, soit pour une stimulation hissienne. L'évaluation primaire combinée porte sur la fraction d'éjection ventriculaire gauche mesurée par échocardiographie à 6 mois, la modification de durée du QRS et le délai avant une première hospitalisation ou le décès.
Conclusion
La stimulation hissienne présente un potentiel important d'optimalisation de la stimulation cardiaque et connait un regain d'intérêt significatif ces dernières années. L'apport de matériel d'implantation approprié n'y est pas étranger et de nouvelles indications apparaissent avec des perspectives cliniques prometteuses, en particulier chez les patients en insuffisance cardiaque avec indication de resynchronisation. Les données observationnelles actuelles doivent encore être validées par des études prospectives randomisées et l'industrie doit également fournir un effort important pour pouvoir proposer des algorithmes adaptés et un matériel plus performant.
Références
- Vanderheyden, M. et al. Hemodynamic deterioration following radiofrequency ablation of the atrioventricular conduction system. Pacing Clin Electrophysiol, 1997, 20, 2422- 2428.
- Bristow, MR. et al. Cardiac resynchronisation therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med, 2004, 350, 2140-2150.
- Auricchio, A. et al. Non-responders to cardiac resynchronization therapy. Circulation, 2011, 75, 521-527.
- Khan, F.Z. et al. Characterization of the suitability of coronary venous anatomy for targeting left ventricular lead placement in patients undergoing cardiac resynchronization therapy. Europace, 2009, 11, 1491-1495.
- Scherlag, B.J. et al. A technique for ventricular pacing from the His bundle of the intact heart. J Appl Physiol, 1967, 22, 584-587.
- Mabo, P., Scherlag, B.J. et al. A technique for stable His bundle recording and pacing: electrophysiological and hemodynamic correlates. Pacing Clin electrophysiol, 1995, 18, 1894-1901.
- Deshmuck, P. et al. Permanent, direct His bundle pacing. A novel approach to cardiac pacing in patients with normal His-Purkinje activation. Circulation, 2000, 101 869-877.
- Anderson, R.H. et al. The anatomy of the cardiac conduction system. Clinical anatomy, 2009, 22, 99-113.
- Kawashima, T. et al. A macroscopic anatomical investigation of atrioventricular bundle locational variation relative to the membranous part of the ventricular septum in elderly human hearts. Surg Radiol Anat, 2005, 27, 206-213.
- Sharma, P.S. et al. Permanent His bundle pacing: shaping the future of physiological ventricular pacing. Nature Reviews/Cardiology online, 27 June 2019
- Gammage, M.D. et al. Multicenter clinical experience with a lumenless, catheter-delivered, bipolar, permanent pacemaker lead: implant safety and electrical performance. PACE, 2006, 29, 858-865.
- Sharma, P.S. et al. Permanent His bundle pacing is feasible, safe, and superior to right ventricular pacing in routine clinical practice. Heart Rhythm, 2015, 12, 305-312.
- Vijayaraman, P. et al. His bundle injury current during implantation of permanent His bundle pacing lead predicts excellent pacing outcomes. PACE, 2015, 38, 540-546.
- Correa de Sa et al. Autopsy evaluation of the implantation site of a permanent direct His bundle pacing lead. Circ Arrhythm Electrophysiol, 2012, 5, 244-246.
- Vijayaraman, P. et al. Imaging evaluation of implantation site of permanent direct His bundle pacing lead. Heart Rhythm, 2014, 11, 529-530.
- Occhetta, E. et al. Permanent parahissian pacing. Indian Pacing Electrophysiol J, 2006, 7, 110-125.
- Morina-Vasquez, P. et al. Cardiac resynchronization through selective His bundle pacing in a patient with the so-called infra-His atrioventricular block. Pacing Clin Electrophysiol, 2005, 28, 726-729.
- Narula, O.S. et al. Longitudinal dissociation in the His bundle. Bundle branch block due to asynchronous conduction within the His bundle in man. Circulation, 1977, 56, 996-1006.
- El-Sherif, N. et al. Normalization of bundle branch block patterns by distal His bundle pacing. Clinical and experimental evidence of longitudinal dissociation in the pathologic His bundle. Circulation, 1978, 57, 473-483.
- Narula, O.S. et al. Pervenous pacing of the specialized conducting system in man: His bundle and AV nodal stimulation. Circulation, 1970, 41, 77-87.
- Catanzariti, D. et al. Permanent His bundle pacing maintains long-term ventricular synchrony and left ventricular performance, unlike conventional right ventricular apical pacing. Europace, 2013, 15, 546-553.
- Huang, W. et al. Benefits of permanent His bundle pacing combined with atrioventricular node ablation in atrial fibrillation patients with heart failure with both preserved and reduced left ventricular ejection fraction. J Am Heart Assoc, 2017, 6, e005309.
- Vijayaraman, P. et al. How to perform His bundle pacing: tips and tricks. PACE, 2016, 39, 1298-1304.
- Kronborg, M.B. et al. His or para-His pacing preserves left ventricular function in AV block: a double-blind, randomized, crossover study. Europace, 2014, 16, 1189-1196.
- Vijayaraman, P. et al. Permanent His bundle pacing in advanced AV block. Electrophysiological insights into site of AV block. J Am Coll Cardiol EP, 2015, 1, 571-581.
Catanzariti, D. et al. Permanent direct His bundle pacing does not induce ventricular dyssynchrony unlike conventional right ventricular apical pacing. J Interv Card Electrophysiol, 2006, 16, 81-92. - Vijayaraman, P. et al. Permanent His bundle pacing: Long term lead performance and clinical outcomes. Heart Rhythm, 2018, 15, 696-702.
- Abdelrahman, M. et al. Clinical outcomes of His bundle pacing compared to right ventricular pacing: Results from the HBP registry. J Am Coll Cardiol, 2018, 71, 2319-2330.
- Ajijola, O.A. et al. Permanent His-bundle pacing for cardiac resynchronization therapy: initial feasibility study in lieu of left ventricular lead. Heart Rhythm, 2017, 14, 1353-1361.
- Sharma, P.S. et al. Permanent His-bundle pacing as an alternative to biventricular pacing for cardiac resynchronization therapy: a multicenter experience. Heart Rhythm, 2018, 15, 413-420.
- Lustgarten, D.L. et al. His-bundle pacing versus biventricular pacing in cardiac resynchronization therapy patients: a crossover design comparison. Heart Rhythm, 2015, 12, 1548-1557.
- Milasinovic, G. et al. Percent ventricular pacing with managed ventricular pacing mode in standard pacemaker population. Europace, 2008, 10, 151-155.
- Sohaib, S.A. et al. Atrioventricular optimized direct His bundle pacing improves acute hemodynamic function in patients with heart failure and PR interval prolongation without left bundle branch block. JACC Clin Electrophysiol, 2015, 1, 582-591.
- Kusumoto, F.M. et al. 2018 ACC/AHA/HRS guideline on the evaluation and management of patients with bradycardia and cardiac conduction delay: executive summary. Heart Rhythm, 2019, 16, e227-e279.
- Burri, H. et al. Device programming for His bundle pacing. Circ Arrhythm Electrophysiol, 2019, 12, e006816.
- Vijayaraman, P. et al. Permanent His bundle pacing: Electrophysiological and echocardiographic observations from long term follow- up. Pacing Clin Electrophysiol, 2017, 40, 883-891.
- Keene, D. et al. Rationale and design of the randomized multicentre His Optimized Pacing Evaluated for Heart Failure (HOPE-HF) trial. ESC Heart Fail, 2018, 5, 965-976.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.