Le testing préopératoire optimal du COVID-19 reste un défi. Nous rapportons un cas de COVID-19 survenu après un pontage coronarien, en dépit d'un testing préopératoire approfondi, et passons en revue les différentes méthodes de testing.Résumé
Nous connaissons actuellement une deuxième vague de pandémie de coronavirus. Le virus SARS-CoV-2, responsable du COVID-19, provoque non seulement des symptômes pulmonaires, mais il peut aussi être à l'origine de manifestations cardiaques et rénales. Il est important que les patients opérés à coeur ouvert ne soient pas infectés par la COVID-19, afin que le risque de complications reste faible.
À l'aide de ce cas clinique, nous commenterons l'évolution d'un patient testé positif au COVID-19 après l'intervention, en dépit de tests préopératoires négatifs à plusieurs reprises. Différentes méthodes de testing sont abordées, y compris l'avènement des tests rapides.
Ce cas indique clairement que la répétition des tests ne donne pas toujours le résultat souhaité, et que le dépistage basé sur les tests rapides peut être une nouvelle méthode prometteuse.
Introduction
Pour le moment, nous connaissons une deuxième vague de pandémie due au COVID-19. Initialement, la pandémie a été à l'origine de problèmes de capacité dans les hôpitaux. Maintenant que les contaminations réaugmentent, les hôpitaux essaient de se préparer au mieux, sans devoir trop reporter les soins classiques. À cet égard, le testing des patients constituera de nouveau une priorité majeure. Nous décrivons nos points de vue à propos des méthodes de testing à l'aide d'un cas clinique.
Cas clinique
Un homme de 53 ans a été admis, après un cathétérisme cardiaque électif, dans un centre référent, en raison de symptômes progressifs d'angor consécutif à une maladie tritronculaire, pour laquelle une indication de pontage aorto-coronarien (CABG) a été retenue. Un mois avant son hospitalisation, le patient avait consulté son généraliste en raison d'une dyspnée minime et d'une toux. L'auscultation s'étant avérée anormale, le patient s'était vu prescrire une antibiothérapie empirique pour une pneumonie, et il s'était rapidement rétabli. Aucun test pour le COVID-19 ou autre imagerie n'avait été demandé.
Lors de son admission dans l'hôpital référent, le patient avait été isolé, et on avait recherché le COVID-19 à l'aide d'un CT scan et d'un frottis nasopharyngé profond avec PCR (réaction en chaîne par polymérase en temps réel) avec amplification des acides nucléiques. Le CT scan avait révélé des condensations sous-pleurales dans les deux lobes pulmonaires inférieurs et d'anciennes lésions fibrotiques caractéristiques correspondant à un score CO-RADS 2 (figure 1A). La PCR n'avait pas détecté de SARS-CoV-2, d'influenza A et B, de virus respiratoire syncytial ni de virus parainfluenza humain.
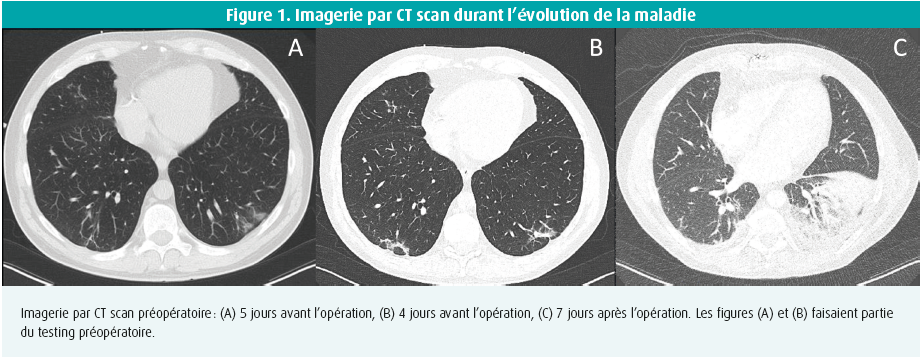
Le patient a été transféré dans le centre tertiaire, où il a de nouveau été isolé. Cette fois, le CT scan montrait un score CO-RADS 4 (figure 1B), avec des opacités en verre dépoli périphériques bilatérales. Les PCR successives ont été répétées 48 et 72 heures après la première PCR. Les deux frottis étaient négatifs pour le SARS-CoV-2. La présence d'anticorps n'a pas été recherchée. Cliniquement, il n'y avait pas de signes d'infection, et la température du patient atteignait un maximum de 37,1 °C. Après cette mise au point approfondie, le patient a été considéré non-infecté, et un CABG a été programmé à court terme en raison d'un angor progressif au repos.
Après l'intervention, qui s'est déroulée sans complications, le patient a été admis en unité non COVID, n'accueillant que des patients testés négatifs au moyen de CT scan et de tests PCR et où les visites des familles sont également limitées.
Au 4e jour postopératoire, la température est montée à 38,6 °C. Le patient a de nouveau été isolé, et des hémocultures et un test PCR ont été réalisés. Les hémocultures étaient négatives, mais le test PCR était positif pour le SARS-CoV-2. Comme le patient n'avait pas d'autres symptômes et que sa fièvre avait baissé, il a pu quitter l'hôpital le soir même, à sa demande. Trois jours après sa sortie, le patient a développé une fièvre persistante, une toux et une anorexie. Lors d'une réévaluation aux urgences, l'examen physique était sans particularité. Cependant, le CT scan montrait une augmentation des opacités en verre dépoli et des anomalies infiltrantes dans les deux lobes inférieurs, avec des emboles pulmonaires dans le lobe inférieur droit (figure 1C). Un test PCR a de nouveau montré la présence du virus SARS-CoV-2. Le patient a été traité par antibiotiques pour la pneumonie liée au COVID-19 et par apixaban pour les emboles pulmonaires. Il s'est rapidement rétabli et a pu quitter l'hôpital au bout de quatre jours, avec une recommandation d'isolement pendant deux semaines (figure 2).

Discussion
Il est apparu que les patients atteints de maladies cardiovasculaires ont un taux de mortalité et un pourcentage de complications plus élevé lorsqu'ils sont infectés par le SARS-CoV-2.1 Il n'existe pas de protocole uniforme pour le testing préopératoire essentiel du COVID-19. Les outils de testing disponibles les plus utilisés pour le COVID-19 sont la PCR et le CT scan thoracique.2
Les tests PCR en temps réel, dans lesquels l'ARN viral est isolé à partir d'un prélèvement nasopharyngé, présentent un pourcentage élevé de résultats faussement négatifs pour le SARS-CoV-2, en raison de la quantité variable de matériel viral présent dans l'échantillon ou d'erreurs de laboratoire. Des résultats de PCR négatifs à plusieurs reprises ne sont pas déterminants pour identifier l'absence du virus et définir l'indication l'isolement des patients suspects de COVID-19.3 Ces derniers temps, la sensibilité de ces tests PCR est passée à 95 %, à condition qu'ils soient effectués par du personnel entraîné.4, 5
L'étude de Prokop décrit la valeur diagnostique des scores CO-RADS au CT scan, par rapport aux tests PCR pour la détection du COVID-19. Il en ressort que des scores très faibles ou élevés suffisent pour pouvoir diagnostiquer avec certitude l'absence ou la présence du COVID-19.6
La détection des anticorps à l'aide de tests immunoenzymatiques (ELISA) est une autre possibilité. Les immunoglobulines IgM et IgG sont trouvées à partir de 3 et 7 jours après la contamination. La sensibilité des anticorps IgM et IgG est de 48,1 % et 88,9 %. L'aspect rétrospectif constitue un inconvénient, et on ne sait pas si tout le monde fabrique suffisamment d'anticorps.7 Par ailleurs, les cultures cellulaires peuvent également détecter le SARS-CoV-2, mais cette méthode prend beaucoup de temps (1-7 jours).7
Wang et al. ont rapporté une sensibilité de 93 % en cas de lavage bronchoalvéolaire (LBA).8, 9 Malgré sa sensibilité élevée, le LBA n'est pas utilisé comme méthode diagnostique primaire, étant donné le risque élevé de diffusion du virus par les aérosols.10
Les tests d'amplification isotherme médiée par boucle de transcription inverse (RT-LAMP) constituent une nouveauté. Ces tests utilisent des techniques d'amplification génique à température constante, contrairement aux tests PCR, et ils peuvent donc donner des résultats en une heure.11, 12 La méthode est actuellement comparée à la PCR et, jusqu'à présent, les résultats paraissent prometteurs, avec une sensibilité de 99 % dans 900 échantillons avec les tests rapides.13 La technique a été utilisée précédemment, notamment en Belgique pour le diagnostic de la malaria.14 Les premiers tests sont déjà sur le marché, et leur implémentation accélérerait logistiquement le testing préopératoire des patients.15
À partir de ce cas, et rétrospectivement, les hypothèses suivantes peuvent être formulées : 1) le testing préopératoire du patient avait donné un résultat faussement négatif, en présence d'une infection asymptomatique, 2) un mois plus tôt, le patient s'était déjà rétabli d'une infection par le COVID-19, et l'opération a provoqué le retour de l'infection, 3) le patient a été infecté lors de son hospitalisation, malgré un isolement strict. Notre stratégie actuelle pour éviter que des patients infectés soient opérés consiste en la réalisation de questionnaires téléphoniques visant à rechercher des plaintes liées au COVID et en l'exécution d'un test PCR négatif, via un prélèvement nasopharyngé profond effectué par du personnel hospitalier entraîné, dans les 72 heures précédant l'opération, en respectant un isolement strict jusqu'à ce qu'il soit prouvé que les résultats sont négatifs. Ce n'est qu'en cas de doute qu'un CT scan complémentaire est demandé et que les risques du report de l'opération par rapport aux risques d'opérer un patient potentiellement infecté sont mis en balance. L'utilisation de tests rapides pourrait être un complément efficace et peu onéreux pour rendre le processus de testing à l'hôpital plus performant. Toutefois, de plus amples études seront nécessaires pour trouver la meilleure méthode de testing.
Conclusion
Diverses mesures sont prises pour enrayer la propagation du virus, alors que nous connaissons une deuxième vague de contaminations. Le testing des patients est essentiel pour éviter les contaminations du personnel et des autres patients de l'hôpital, et pour éviter les complications liées aux opérations. Ce cas clinique a montré que la répétition des tests n'améliore pas nécessairement la détection du virus. On assiste à des développements rapides pour le diagnostic de ce virus, suite à quoi la sensibilité des tests PCR peut atteindre 95-99 %, ainsi qu'à la mise au point de tests rapides. L'implémentation de ceux-ci doit encore suivre, mais ils pourraient accélérer le testing des patients dans un avenir proche.
Références
- Inciardi, R.M., Adamo, M., Lupi, L., Cani, D.S., Di Pasquale, M., Tomasoni, D. et al. Characteristics and outcomes of patients hospitalized for COVID-19 and cardiac disease in Northern Italy. Eur Heart J, 2020, 41 (19), 1821-1829.
- Chakraborty, C., Sharma, A.R., Sharma, G., Bhattacharya, M., Lee, S.S. SARS-CoV-2 causing pneumonia-associated respiratory disorder (COVID-19): diagnostic and proposed therapeutic options. Eur Rev Med Pharmacol Sci, 2020, 24 (7), 4016-4026.
- Li, Y., Yao, L., Li, J., Chen, L., Song, Y., Cai, Z. et al. Stability issues of RT-PCR testing of SARS-CoV-2 for hospitalized patients clinically diagnosed with COVID-19. J Med Virol, 2020, 92 (7), 903-908.
- Winichakoon, P., Chaiwarith, R., Liwsrisakun, C., Salee, P., Goonna, A., Limsukon, A. et al. Negative Nasopharyngeal and Oropharyngeal Swabs Do Not Rule Out COVID-19. J Clin Microbiol, 2020, 58 (5), e00297-20.
- Corman, V.M., Landt, O., Kaiser, M., Molenkamp, R., Meijer, A., Chu, D.K. et al. Detection of 2019 novel coronavirus (2019- nCoV) by real-time RT-PCR. Euro Surveill., 2020, 25 (3), 2000045.
- Prokop, M., van Everdingen, W., van Rees Vellinga, T., Quarles van Ufford, H., Stöger, L., Beenen, L. et al. COVID-19 Standardized Reporting Working Group of the Dutch Radiological Society. CO-RADS: A Categorical CT Assessment Scheme for Patients Suspected of Having COVID-19-Definition and Evaluation. Radiology, 2020, 296 (2), E97-E104.
- Ekrami, E., Pouresmaieli, M., Barati, F., Asghari, S., Ziarani, F.R., Shariati, P. et al. Potential Diagnostic Systems for Coronavirus Detection: A Critical Review. Biol Proced Online, 2020, 22 (21).
- Wang, W., Xu, Y., Gao, R., Lu, R., Han, K., Wu, G. et al. Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA, 2020, 323 (18), 1843-1844.
- Bwire, G.M., Majigo, M.V., Njiro, B.J., Mawazo, A. Detection profile of SARS-CoV-2 using RT-PCR in different types of clinical specimens: A systematic review and meta-analysis. J Med Virol, 2020, 10.1002/jmv.26349.
- Pascarella, G., Strumia, A., Piliego, C., Bruno, F., Del Buono, R., Costa, F. et al. COVID-19 diagnosis and management: a comprehensive review. J Intern Med, 2020, 288 (2), 192-206.
- Lamb, L.E., Bartolone, S.N., Ward, E., Chancellor, M.B. Rapid detection of novel coronavirus/Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) by reverse transcription-loop-mediated isothermal amplification. PLoS One, 2020, 15 (6), e0234682.
- Thompson, D., Lei, Y. Mini review: Recent progress in RT-LAMP enabled COVID-19 detection. Sensors and Actuators Reports, 2020, 2 (1), 100017.
- TNO innovation for life, „TNO Nieuws: praktijk proef met corona sneltest TNO succesvol,” 15 oktober 2020. [Online]. Available: https://www.tno.nl/nl/over-tno/ nieuws/2020/10/praktijkproef-met-coronasneltest- tno-succesvol/. [Ouvert le 15 octobre 2020].
- De Koninck, A.S., Cnops, L., Hofmans, M., Jacobs, J., Van den Bossche, D., Philippé, J. Diagnostic performance of the loopmediated isothermal amplification (LAMP) based illumigene® malaria assay in a nonendemic region. Malar J, 2017, 16 (1), 418.
- KyvoBio, „SARS-CoV-2 RT-LAMP for research and development,” 6 november 2020. [Online]. Available: https://www.kyvobio.be/ buy/cat-sars-cov-2-rt-lamp-for-research-5304. html. [Ouvert le 6 novembre 2020].
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.