Les troubles de la repolarisation sur l'électrocardiogramme (ECG) représentent souvent une urgence cardiologique. Nous présentons ici le cas d'un patient présentant d'importantes altérations des phases de repolarisation à l'ECG observées durant son séjour aux urgences. Après intégration des informations cliniques - biologiques et échocardiographiques, un diagnostic de syndrome coronarien aigu sera écarté au profit d'anomalies électrocardiophiques traduisant une irritation mécanique du péricarde dans les suites d'un acte médical.
Présentation clinique
Un homme de 87 ans se présente aux urgences pour dyspnée, asthénie et douleurs thoraciques respiro-dépendantes latéralisées à droite. Il s'agit d'un patient fumeur, diabétique insulinodépendant, qui souffre d'hypertension artérielle et d'hypercholestérolémie.
A son arrivée aux urgences, il présente une insuffisance respiratoire avec saturation à 85 % à l'air ambiant nécessitant 2 l/min d'oxygène. Il est apyrétique et normo tendu à 110/60 mmHg avec une fréquence cardiaque à 71/min. La propédeutique cardio-pulmonaire révèle une franche hypoventilation droite avec matité et abolition du murmure vésiculaire de ce côté. Le reste de l'examen clinique est banal.
L'anamnèse révèle une inappétence avec altération d'état général et perte de poids de 6 kg en 3 mois. Il est traité par insuline (insuline glargine - insuline aspart), bisoprolol 5 mg, périndopril 10 mg et rosuvastatine/ézétimibe 10/10.
Le bilan biologique révèle un syndrome inflammatoire neutrophilique (neutrophiles 10 930/mm3 et CRP à 45,4 mg/l) ainsi que des troponines ultrasensibles légèrement majorées à 55ng/l, avec une fonction rénale normale (GFR > 60 ml/min/1,73m2), attribuables en première intention à l'hypoxémie d'admission (NSTEMI Type II).
L'ECG d'admission est sans grande particularité. Un scanner thoracique (figure 1) est réalisé et confirme un épanchement pleural droit de volume important avec atélectasie sous-jacente et ne révèle aucun épanchement péricardique. Une lésion néoplasique ne peut être exclue dans ces conditions.
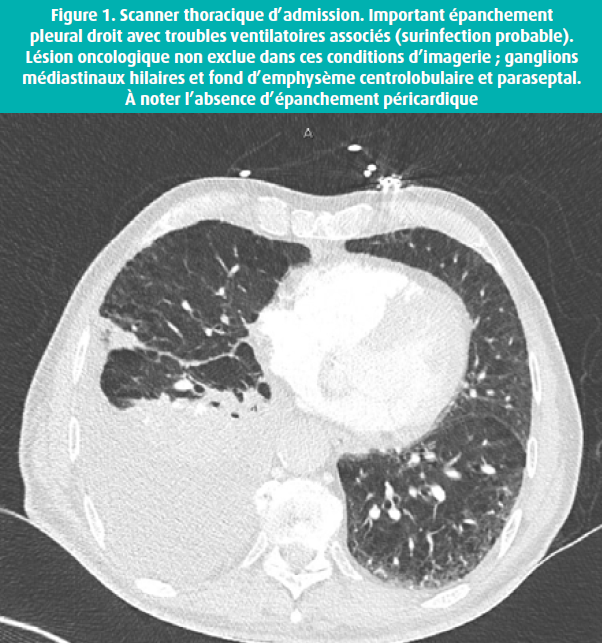
Une ponction pleurale avec mise en place d'un drain est réalisée, drainant rapidement plus de 1 500 cc d'un exsudat lymphocytaire jaunâtre. Le patient est placé sous lévofloxacine.
Le contrôle enzymologique cardiaque réalisé à 3 heures montre l'absence de cinétique enzymatique significative tant pour les valeurs de troponines I ultrasensibles que pour les CK-MB. Paradoxalement, un ECG de contrôle (figure 2) objective cette fois un sus-décalage diffus du segment ST, concave, associé à un sous-décalage diffus de l'espace PR hormis dans la dérivation aVR où celui-ci est sus-décalé (signe de Spodick).

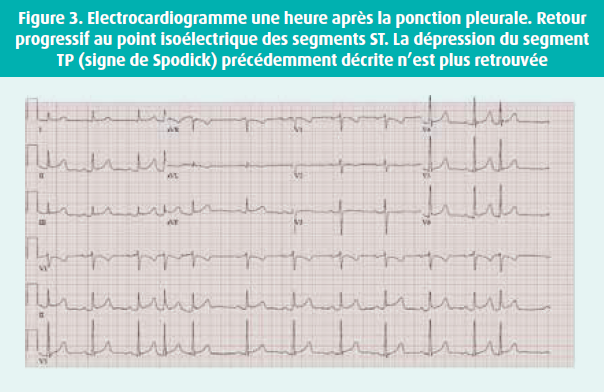
Par ailleurs, le patient reste épargné de tout symptôme cardiaque en particulier de précordialgie. Un troisième ECG (figure 3) révèle un retour progressif des phases terminales à leur point isoélectrique. Un diagnostic électrocardiographique d'irritation péricardique mécanique suite au drainage thoracique est suspecté et le patient est hospitalisé en pneumologie.
Durant son séjour hospitalier, les explorations complémentaires permettent la mise en évidence d'une étiologie oncologique à l'épanchement pleural (adénocarcinome pulmonaire). L'échographie cardiaque transthoracique se révèle rassurante avec une cinétique segmentaire parfaitement homogène. Une origine mécanique irritative du péricarde est donc bien à l'origine des modifications électrocardiographiques et l'intégration globale du dossier tant clinique que paraclinique a permis d'éviter d'exposer le patient à une procédure invasive inutile et potentiellement risquée chez un patient âgé en insuffisance respiratoire.
Discussion
L'activité électrique du coeur est connue et étudiée depuis le 19ème siècle. C'est en 1901 que Willem Einthoven, un médecin néerlandais, publiait ses premiers tracés électrocardiographiques de bonne qualité1. Ses travaux furent d'ailleurs récompensés du prix Nobel de médecine en 1924. Depuis lors, l'ECG fait partie du quotidien du médecin cardiologue, du médecin hospitalier urgentiste notamment ainsi qu'en médecine générale.
En ce qui concerne les phases terminales d'un cycle électrocardiographique, la période isoélectrique, plus communément connue sous le nom de 'Segment ST', correspond à la période du cycle cardiaque où les deux ventricules sont dépolarisés uniformément. Il est habituellement isoélectrique dans les 12 dérivations.
L'onde T représente la repolarisation ventriculaire. La phase de repolarisation démarre en sous-épicardique, le potentiel d'action étant plus court au sein des cellules de cette zone sous-épicardique. Les ondes T sont donc normalement orientées dans la même direction que les QRS qui les précèdent.
En conditions physiologiques, il existe des variations possibles de ces phases terminales chez des patients en bonne santé2. Par exemple, le point J, marquant la limite entre la dépolarisation (fin du QRS) et la repolarisation (début de l'onde T), peut être physiologiquement sus-décalé dans les précordiales droites. Ce phénomène est appelé l'effet Edeiken3.
Il existe de très nombreuses causes pathologiques modifiant ces phases terminales4. Il est important d'intégrer le contexte clinique (anamnèse, examen clinique) aux modifications électrocardiographiques. Par la suite, d'autres examens peuvent venir compléter le bilan : biologie, CT-scanner, échographie, …
L'altération des phases terminales peut être liée à des causes primaires (cardiologiques) ou secondaires (non cardiologiques).
Les causes primaires
La première cause à laquelle il faut penser est le syndrome coronarien aigu (SCA). Ce dernier doit être pris en charge rapidement dès l'admission d'un patient aux urgences. Le sus-décalage convexe vers le haut du segment ST (onde de Pardee) ou le sous-décalage horizontal/ descendant correspondant à un territoire coronarien en sont des caractéristiques déterminantes. Dans les conditions standards d'impression d'ECG à 25 mm/s et de 10 mm/mV d'amplitude, il s'agit d'un sus-décalage ≥ 0,2 mV chez l'homme.
La péricardite, est souvent confondue en pratique clinique avec le SCA5. Il faut distinguer, en plus des symptômes différents, un sus-décalage concave, diffus, ne correspondant pas à un territoire coronarien. Le signe de Spodick6 est un argument à l'ECG renforçant le diagnostic différentiel avec le SCA. Il s'agit d'une dépression diffuse de l'espace PR, sauf en aVR s'étendant même à l'entièreté du segment TP. Une revue de littérature récente l'assimile à 29 % (95 % CI 16 %-45 %) des patients atteints d'une péricardite7.
Par la suite, le bilan biologique et l'échocardiographie transthoracique permettront en général de confirmer le diagnostic et d'en donner l'étiologie. Les causes de péricardite sont multiples et peuvent être divisées en causes infectieuses et non infectieuses8. Elles varient en fonction de l'ethnie, l'histoire épidémiologique mais aussi les présentations cliniques et les résultats des examens complémentaires cités précédemment. Comme causes infectieuses, retenons les péricardites virales (Coxsackies, Echovirus, EBV, Adénovirus, Parvovirus B19 ou encore SARS-CoV-29) ainsi que les péricardites bactériennes, fongiques ou parasitaires, plus rares dans nos régions. Les étiologies non infectieuses sont vastes : auto immunes (post myocardiques ou syndrom de Dressler, lupus érythémateux disséminé, syndrome de Sjögren, vascularites, maladie de Behçet, …), néoplasiques, métaboliques ou encore traumatiques.
L'ECG obtenu après drainage chez notre patient correspond donc à une forme de péricardite considérée alors comme iatrogène, par un mécanisme de trauma indirect du péricarde. En effet, ce dernier a été irrité mécaniquement par l'aspiration rapide du liquide pleural. L'évolution des tracés ECGs ainsi que l'échocardiographie confirment le diagnostic par exclusion.
Les causes secondaires
Ces étiologies sont tout autant importantes que les causes primaires et doivent être reconnues du clinicien. Nous y retrouvons l'hypothermie (ondes J d'Osborn), les troubles ioniques (principalement l'hyperkaliémie) mais aussi l'embolie pulmonaire et des intoxications médicamenteuses comme l'intoxication aux digitaliques.
Conclusion
L'ECG n'a plus à prouver sa place indispensable dans la pratique clinique quotidienne. Néanmoins n'oublions pas qu'il s'agit initialement d'un courant électrique qui peut être modifié pour de multiples raisons. Certaines causes comme un syndrome coronarien aigu doivent être impérativement diagnostiqués rapidement. D'autres, plus rares, comme notre cas clinique, peuvent mimer des signes électriques pathologiques sans répercussion pronostique.
Il est important de souligner l'importance de l'intégration du tracé électrocardiographique, avec l'anamnèse, l'examen clinique, et les examens paracliniques, constituant la base inébranlable de la médecine clinique qui en fait, in fine, un art de guérir…
Références
- Barold, S. Willem Einthoven and the birth of clinical electrocardiography a hundred years ago. Card Electrophysiol Rev, 2003, 7 (1), 99-104.
- Haarmark, C., Graff, C., Andersen, M.P., Hardahl, T., Struijk, J.J., Toft, E. et al. Reference values of electrocardiogram repolarization variables in a healthy population. J Electrocardiol, 2010, 43 (1), 31-39.
- Edeiken, J. Elevation of the RS-T segment, apparent or real in the right precordial leads as a probable normal variant. Am Heart J, 1954, 48, 331-339.
- Coppola, G., Carita, P., Corrado, E., Borrelli, A., Rotolo, A., Guglielmo, M. et al. ST Segment elevations: Always a marker of acute myocardial infarction? Indian Heart J, 2013, 65 (4), 412-423.
- Wang, K., Asinger, R.W., Marriott, H.J.L. ST-Segment elevation in conditions other than acute myocardial infarction. N Engl J Med, 2003, 349, 2128-2135.
- Spodick, D.H. Electrocardiogram in acute pericarditis. Am J Cardiol, 1974, 33, 470-474.
- Abdelazeem, B., Kandah, E., Borchen, M., Alnaimat, S., Kunadi, A. Spodick's Sign: A case report and Review of Literature. Cureus, 2020, 12 (11), e11606.
- Imazio, M. Contemporary management of pericardial diseases. Curr Opin Cardiol, 2012, 27 (3), 308-317.
- Ferrant, L., Sottiaux, T., Adam, J.F., Lejeune, F. Pericardial effusion: an underrated complication of SARS-CoV-2. Méd Intensive Réa, 2020, 30 (HS1), 81-87.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.