Le récent congrès de la Société européenne de Cardiologie comportait de nombreuses sessions intéressantes. L'une d'elles était consacrée à la détection précoce et au triage des patients souffrant de fibrillation auriculaire et d'insuffisance cardiaque. Étant donné que ces deux affections seront de plus en plus fréquentes dans les décennies à venir, une détection précoce et le triage sont essentiels pour pouvoir instaurer un traitement correct. Cette session était donnée par Jason Andrade (Canada), Lukas Dekker (Pays-Bas) et Ward Heggermont (Belgique).
L'ablation par cathéter comme traitement de première ligne de la fibrillation auriculaire - des preuves à la pratique
Jason Andrade - Vancouver, Canada
La fibrillation auriculaire (FA) est le trouble du rythme cardiaque le plus fréquent, avec une prévalence de plus de 5 % chez les sujets de plus de 65 ans. Le coût de cette affection est en outre considérable. Ainsi, la FA représente 2,5 % des dépenses totales de santé au Royaume-Uni, en Italie et en France. À l'heure de traiter la FA, il faut choisir entre une stratégie de contrôle du rythme ou de la fréquence. Longtemps, aucune différence entre les deux stratégies n'a pu être démontrée sur la base de critères d'évaluation concrets (mortalité totale et cardiovasculaire) dans les grandes études, bien que le contrôle du rythme se soit révélé plus avantageux dans quelques séries plus petites (e. a. DIAMOND, CHFSTAT, étude de cohorte du Québec)1. Plus récemment, l'étude EAST AFNET 42 a été publiée. Dans cette étude, 2 789 patients chez qui une FA avait été diagnostiquée récemment (délai médian d'inclusion: 36 jours après le diagnostic) ont été randomisés entre les soins standard, d'une part, et un contrôle précoce et poussé du rythme, d'autre part. Après une période de suivi médiane de 5 ans, on a constaté une réduction significative du critère d'évaluation primaire (décès cardiovasculaire, AVC, hospitalisation pour insuffisance cardiaque ou syndrome coronarien aigu; hazard ratio = 0,79; P = 0,005) dans le groupe 'contrôle du rythme'. Ce résultat était principalement déterminé par une nette réduction des critères d'évaluation les plus forts, à savoir la mortalité cardiovasculaire et les AVC.Étant donné que les études précédentes avaient souvent utilisé une période de suivi plus courte, l'orateur avance que ces études ont peut-être été clôturées trop tôt pour pouvoir détecter une différence significative, et qu'il existe de solides preuves pour tendre à un contrôle précoce du rythme. Dans les recommandations actuelles, les antiarythmiques sont préférés à l'ablation. Pourtant, il existe plusieurs raisons de préférer l'ablation par cathéter comme traitement de première ligne. Tout d'abord, les antiarythmiques sont relativement inefficaces pour maintenir le rythme sinusal. Ainsi, des études ont montré que seul un tiers des patients sous antiarythmiques sont exempts de fibrillation auriculaire après 1 an, alors que ce chiffre était de 57 % pour l'ablation par cathéter3. Deuxièmement, il y a souvent des effets indésirables ou une intolérance au médicament prescrit, ce qui entraîne un arrêt prématuré du traitement et une diminution de l'observance thérapeutique. Troisièmement, avec certains antiarythmiques (dont l'amiodarone et le sotalol), on a décrit une mortalité plus élevée comparativement au placebo4. Enfin, il existe des arguments selon lesquels l'ablation est plus efficace lorsqu'elle est utilisée à un stade précoce du processus de la maladie. En effet, la FA est un processus évolutif chronique lors duquel le substrat auriculaire évolue, entraînant ainsi une transformation graduelle d'une FA paroxystique en FA persistante. Il est donc préférable de réaliser une ablation lorsque le problème électrique est encore isolé, et de ne pas attendre la formation du substrat auriculaire.
Pour ces raisons, la pertinence de l'ablation (par radiofréquence) comme traitement de première ligne a déjà été étudiée par le passé, dans le cadre de quelques études de moindre envergure (RAAFT, MANTRA-PAF et RAAFT-2)5-7.
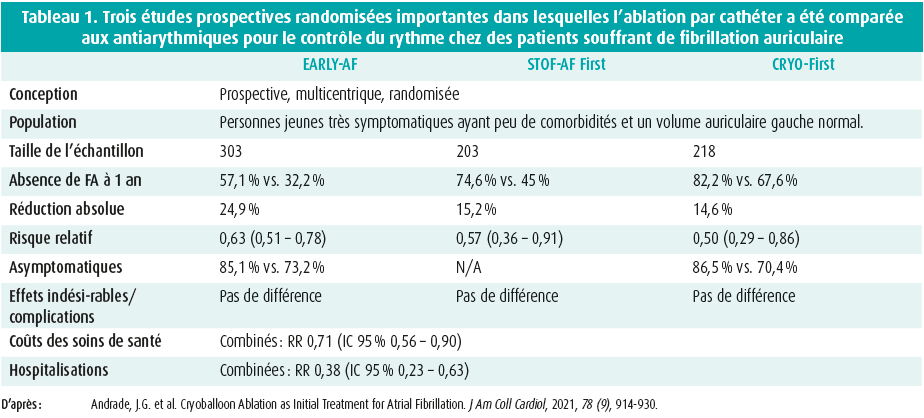
Toutefois, les résultats de ces études n'étaient pas très convaincants, de sorte que les recommandations actuelles ne préconisent pas (encore) l'ablation par cathéter comme traitement de première ligne. Plus récemment, 3 autres études importantes ont été publiées, chacune d'entre elles montrant que la cryoablation est supérieure aux antiarythmiques pour le maintien du rythme sinusal3,8,9. Les principales caractéristiques de ces études sont reprises au tableau 1. A cet égard, on observe un meilleur maintien du rythme sinusal, une meilleure qualité de vie et une réduction des frais et des hospitalisations. En revanche, il n'y a pas de différences sur le plan des effets indésirables/ complications. Il est donc plus que probable que l'ablation par cathéter jouera un rôle encore plus important dans le traitement de la FA à l'avenir.
Moniteurs cardiaques implantables : précis et durables
Lukas Dekker - Eindhoven, Pays-Bas
Les moniteurs cardiaques implantables (MCI) sont actuellement utilisés pour la mise au point des syncopes récurrentes inexpliquées et des palpitations intermittentes d'origine inconnue. Ils peuvent également être intéressants pour la mise au point d'un AVC cryptogénique. L'étude CRYSTAL-AF10 a servi de base à cette stratégie. Basée sur le principe 'qui cherche, trouve', cette étude a clairement démontré l'avantage de la surveillance du rythme à long terme pour objectiver une FA. Un an après la randomisation, on avait diagnostiqué une FA chez 12,4 % des patients porteurs d'un MCI, contre 2 % dans le groupe témoin (hazard ratio = 7,3; P < 0,001). D'autre part, en utilisant le même principe, on pourrait supposer que la cause d'un AVC cryptogénique peut dans de nombreux cas être attribuée à une FA non diagnostiquée. Ceci a conduit à envisager une anticoagulation thérapeutique systématique chez les patients qui ont présenté un AVC cryptogénique, indépendamment d'un éventuel diagnostic de FA. Une telle stratégie a déjà été étudiée dans 2 séries, respectivement avec le dabigatran et le rivaroxaban11,12. Aucun bénéfice n'a pu être démontré comparativement à l'utilisation d'acide acétylsalicylique, mais on a par contre observé davantage d'hémorragies mineures et majeures. En cas d'AVC d'origine inconnue, l'objectivation d'une FA reste donc une exigence pour instaurer une anticoagulation à dose thérapeutique, et un MCI peut donc avoir son utilité.
En outre, un MCI peut être utile pour individualiser davantage la prise en charge des patients souffrant de FA. L'orateur a donné 3 exemples lors de son exposé.
1. Un MCI permet de distinguer plus précisément les patients souffrant de FA paroxystique ou persistante. Cela permet de mieux sélectionner les patients pour une ablation par cathéter ou le contrôle de la fréquence.
2. Les patients qui rechutent après une ablation par cathéter peuvent également être répartis en 3 classes. Premièrement, les patients qui repassent immédiatement d'un rythme sinusal à une FA. Deuxièmement, les patients qui présentent d'abord un flutter auriculaire, qui se transforme dans un second temps en FA. Enfin, les patients qui présentent des extrasystoles auriculaires fréquentes, et dans un second temps une FA. Une petite étude de Pokushalov et al. a montré à cet égard que, dans les 2 derniers groupes, on pouvait s'attendre à un effet bénéfique d'une nouvelle ablation, tandis que le premier groupe obtenait de meilleurs résultats avec des antiarythmiques13.
Un troisième exemple concerne l'arrêt de l'anticoagulation chez les patients après une ablation fructueuse. Dans une petite étude de Mascarenhas et al., un MCI a été implanté après une ablation par cathéter chez 70 patients présentant un score CHA2DS2-VASc ≥ 2 et un score HAS-BLED ≥ 314. Par la suite, les anticoagulants ont été arrêtés chez les patients qui étaient toujours en rythme sinusal après 3 mois (AF burden < 1 %). Après une période de suivi médiane de 2 ans, aucun AVC n'a été observé dans ce groupe, tandis que le risque d'hémorragies était considérablement réduit. Bien que les exemples et les études cités soient à petite échelle, ils montrent qu'il existe bel et bien une indication pour un MCI dans l'individualisation plus poussée des soins. Il va de soi que de plus amples études sur l'utilisation et les indications d'un MCI sont souhaitables.
L'apport du numérique pour le traitement des patients souffrant d'insuffisance cardiaque
Ward Heggermont - Aalst, Belgique
L'insuffisance cardiaque est une affection chronique. Les interventions visent donc à réduire la mortalité, mais aussi le nombre d'hospitalisations. Le schéma typique d'un patient souffrant d'insuffisance cardiaque montre des hospitalisations fréquentes au début du diagnostic, suivies dans le meilleur des cas par une phase de plateau avec relativement moins d'hospitalisations. La phase terminale de la maladie est alors à nouveau caractérisée par un besoin accru d'hospitalisations. En outre, toute hospitalisation pour insuffisance cardiaque aiguë décompensée est associée à un risque accru de mort subite cardiaque et, globalement, la qualité de vie après une hospitalisation n'est plus ce qu'elle était auparavant. L'insuffisance cardiaque est donc une cause majeure d'hospitalisations, elle est associée à une morbidité et à une mortalité et a en outre un impact économique important. Il est donc de la plus haute importance de réduire le nombre d'hospitalisations pour cette affection. Or, le suivi clinique ambulatoire est insuffisant à cet égard. On peut donc se demander si des algorithmes informatiques basés sur les paramètres des dispositifs implantables peuvent apporter une solution. Un exemple d'un tel algorithme est le Triage HF™ de Medtronic, présenté par l'orateur. Triage HF™ est intégré aux dispositifs de DCI et de TRC-D et vise à prédire les épisodes de décompensation cardiaque. Pour ce faire, l'algorithme englobe divers paramètres, tels que: OptiVol® (analysé plus loin), pourcentage de temps passé en FA (AF burden), pourcentage de temps d'ectopies ventriculaires (ventricular burden), variabilité de la fréquence cardiaque, pouls au repos, pourcentage de temps de besoin de pacing, etc. À partir de ces paramètres, on calcule un risque de décompensation cardiaque dans les 30 prochains jours (faible/intermédiaire/élevé) (figure 1). Il est important de souligner qu'un risque faible est corrélé à une valeur prédictive négative de près de 100 % et un risque élevé à un risque décuplé de décompensation cardiaque dans les 30 jours15. Chez les patients à faible risque, on peut donc pratiquement exclure la survenue d'épisodes de décompensation cardiaque dans les 30 prochains jours, et le clinicien peut se concentrer davantage sur les autres patients. Toutes ces données peuvent en outre être visualisées par le clinicien via un système de monitoring à domicile. En outre, des alarmes peuvent être envoyées lorsque les patients se trouvent dans une zone à risque, pour une intervention ciblée.
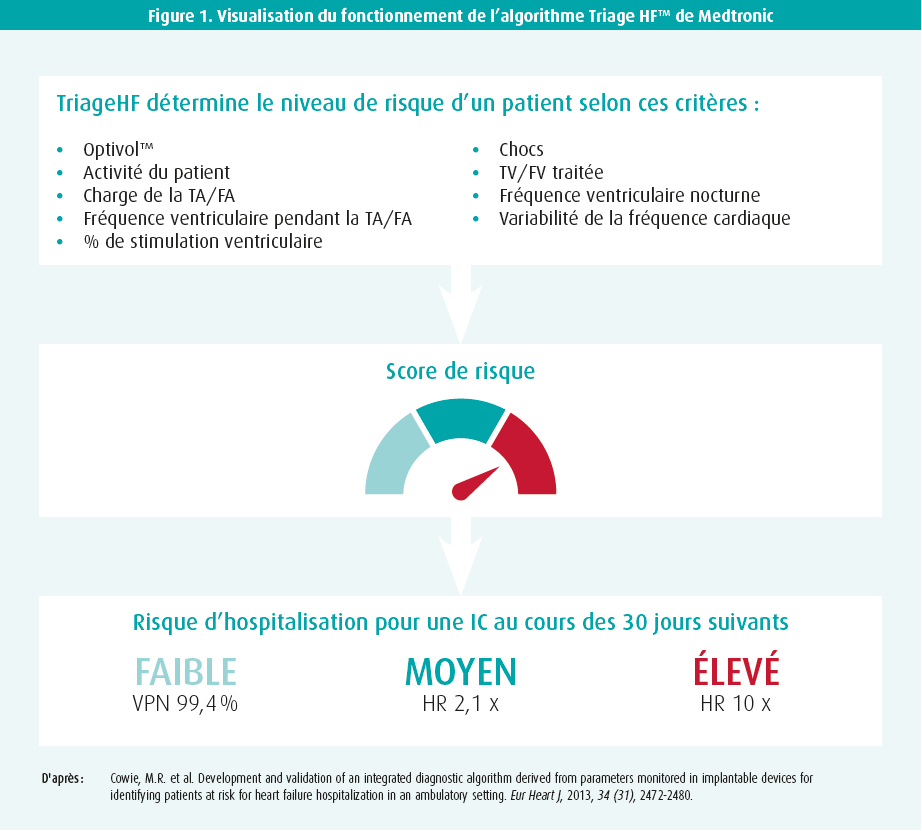
Ces avantages sont-ils démontrés? Commençons par l'algorithme OptiVol®, qui permet de prédire la surcharge liquidienne à partir de la mesure de l'impédance intrathoracique. Cet algorithme a été étudié pour la première fois par Small et al. en 2009, qui ont montré qu'une baisse de l'impédance intrathoracique était associée à un risque accru d'hospitalisation pour insuffisance cardiaque16. Cependant, en raison des nombreux faux positifs, il s'est avéré préférable de combiner l'algorithme OptiVol® avec d'autres paramètres, ce qui a été fait pour la première fois dans l'étude PARTNERS HF17. Ici, l'indice Optivol® a été combiné aux paramètres cliniques cités ci-dessus, et il a pu être démontré que la présence d'une combinaison de facteurs augmentait jusqu'à 5,5 fois le risque d'hospitalisation pour insuffisance cardiaque dans les 30 jours (HR = 5,5; P < 0,0001). Ces résultats ont ensuite été validés dans d'autres études15,18,19. Une augmentation du score de risque avec le Triage HF™ peut donc indiquer quels patients présentent un risque accru d'hospitalisation pour insuffisance cardiaque. On ignore si la détection précoce par ces algorithmes peut également entraîner une réduction des hospitalisations et/ou de la mortalité. De plus amples études scientifiques sont nécessaires à cet égard.
Références
- Caldeira, D., David, C., Sampaio, C. Rate versus rhythm control in atrial fibrillation and clinical outcomes: updated systematic review and meta-analysis of randomized controlled trials. Arch Cardiovasc Dis, 2012, 105 (4), 226-238.
- Kirchhof, P., Camm, A.J., Goette, A. et al. Early Rhythm-Control Therapy in Patients with Atrial Fibrillation. N Engl J Med, 2020, 383 (14), 1305-1316.
- Andrade, J.G., Wells, G.A., Deyell, M.W. et al. Cryoablation or Drug Therapy for Initial Treatment of Atrial Fibrillation. N Engl J Med, 2021, 384 (4), 305-315.
- Freemantle, N., Lafuente-Lafuente, C., Mitchell, S. et al. Mixed treatment comparison of dronedarone, amiodarone, sotalol, flecainide, and propafenone, for the management of atrial fibrillation. Europace, 2011, 13 (3), 329-345.
- Morillo, C.A., Verma, A., Connolly, S.J. et al. Radiofrequency ablation vs antiarrhythmic drugs as first-line treatment of paroxysmal atrial fibrillation (RAAFT-2): a randomized trial. JAMA, 2014, 311 (7), 692-700.
- Wazni, O.M., Marrouche, N.F., Martin, D.O. et al. Radiofrequency ablation vs antiarrhythmic drugs as first-line treatment of symptomatic atrial fibrillation: a randomized trial. JAMA, 2005, 293 (21), 2634-2640.
- Walfridsson, H., Walfridsson, U., Nielsen, J.C. et al. Radiofrequency ablation as initial therapy in paroxysmal atrial fibrillation: results on health-related quality of life and symptom burden. The MANTRA-PAF trial. Europace, 2015, 17 (2), 215-221.
- Kuniss, M., Pavlovic, N., Velagic, V., Hermida, J.S., Healey, S., Arena, G. et al. Cryoballoon ablation vs. antiarrhythmic drugs: first-line therapy for patients with paroxysmal atrial fibrillation. Europace, 2021, 23 (7), 1033-1041.
- Wazni, O.M., Dandamudi, G., Sood, N., Hoyt, R., Tyler, J., Durrani, S. et al. Cryoballoon Ablation as Initial Therapy for Atrial Fibrillation. N Engl J Med, 2021, 384 (4), 316-324.
- Sanna, T., Diener, H-C., Passman, R.S., Di Lazzaro, V., Bernstein, R.A., Morillo, C.A. et al. Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med, 2014, 370 (26), 2478-2486.
- Diener, H-C., Sacco, R.L., Easton, J.D., Granger, C.B., Bernstein, R.A., Uchiyama, S. et al. Dabigatran for Prevention of Stroke after Embolic Stroke of Undetermined Source. N Engl J Med, 2019, 380 (20), 1906-1917.
- Hart, R.G., Sharma, M., Mundl, H., Kasner, S.E., Bangdiwala, S.I., Berkowitz, S.D. et al. Rivaroxaban for Stroke Prevention after Embolic Stroke of Undetermined Source. N Engl J Med, 2018, 378 (23), 2191-2201.
- Pokushalov, E., Romanov, A., Corbucci, G., Artyomenko, S., Turov, A., Shirokova, N. et al. Use of an implantable monitor to detect arrhythmia recurrences and select patients for early repeat catheter ablation for atrial fibrillation: a pilot study. Circ Arrhythm Electrophysiol, 2011, 4 (6), 823-831.
- Mascarenhas, D.A.N., Farooq, M.U., Ziegler, P.D., Kantharia, B.K. Role of insertable cardiac monitors in anticoagulation therapy in patients with atrial fibrillation at high risk of bleeding. Europace, 2016, 18 (6), 799-806.
- Cowie, M.R., Sarkar, S., Koehler, J., Whellan, D.J., Crossley, G.H., Tang, W.H.W. et al. Development and validation of an integrated diagnostic algorithm derived from parameters monitored in implantable devices for identifying patients at risk for heart failure hospitalization in an ambulatory setting. Eur Heart J, 2013, 34 (31), 2472-2480.
- Small, R.S., Wickemeyer, W., Germany, R., Hoppe, B., Andrulli, J., Brady, P.A. et al. Changes in intrathoracic impedance are associated with subsequent risk of hospitalizations for acute decompensated heart failure: clinical utility of implanted device monitoring without a patient alert. J Card Fail, 2009, 15 (6), 475-481.
- Whellan, D.J, Ousdigian, K.T., Al-Khatib, S.M., Pu, W., Sarkar, S., Porter, C.B. et al. Combined heart failure device diagnostics identify patients at higher risk of subsequent heart failure hospitalizations: results from PARTNERS HF (Program to Access and Review Trending Information and Evaluate Correlation to Symptoms in Patients With Heart Failure) study. J Am Coll Cardiol, 2010, 55 (17), 1803-1810.
- Gula, L.J., Wells, G.A., Yee, R., Koehler, J., Sarkar, S., Sharma, V. et al. A novel algorithm to assess risk of heart failure exacerbation using ICD diagnostics: validation from RAFT. Heart Rhythm, 2014, 11 (9), 1626-1631.
- Burri, H., da Costa, A., Quesada, A., Ricci, R.P., Favale, S., Clementy, N. et al. Risk stratification of cardiovascular and heart failure hospitalizations using integrated device diagnostics in patients with a cardiac resynchronization therapy defibrillator. Europace, 2018, 20 (5), e69-77.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.