Dans le contexte actuel de la pandémie de Covid-19, le dernier congrès de l'ESC s'est tenu virtuellement pour la deuxième année consécutive. Le dimanche 29 août, une session était dédiée aux récentes avancées technologiques des dispositifs cardiaques implantables : d'une part le stimulateur cardiaque sans sonde (Micra VR et AV, Medtronic) et, d'autre part le défibrillateur automatique implantable (DAI).
Stimulation cardiaque : la stimulation sans sonde passe au niveau supérieur
Simon Sporton (Londres, RU)
L'implantation d'un stimulateur cardiaque est le seul traitement efficace de la bradycardie symptomatique sévère depuis plus de 60 ans. L'implantation d'un stimulateur dit « conventionnel » est associée à un taux non négligeable de complications (1-12,4 % à un suivi de 2 mois)1. Ces complications sont liées à la présence d'un boîtier sous-cutané (infection/érosion cutanée) et/ou d'une ou plusieurs sonde(s) de stimulation transveineuse(s) (pneumothorax, occlusion veineuse, perforation cardiaque, dislocation de sonde, …). Le stimulateur sans sonde a été approuvé pour une utilisation clinique en 2015 avec l'espoir de réduire les complications de la stimulation conventionnelle.
Les Micra VR et AV (Medtronic) sont actuellement les seuls dispositifs de stimulation ventriculaire sans sonde disponible pour une utilisation clinique. Il s'agit d'un dispositif de stimulation monochambre ventriculaire miniaturisé, d'un poids de 2 g, d'une longueur de 25,9 mm avec un diamètre de 6,7 mm. Son extrémité distale intègre l'électrode et quatre crochets rétractables en nitinol pour assurer sa fixation dans le myocarde tandis que son extrémité proximale intègre un mécanisme de reprise du système pour permettre un repositionnement si nécessaire (figure 1). L'appareil présente des caractéristiques similaires à celles d'un stimulateur ventriculaire « classique », y compris un asservissement de fréquence à l'effort grâce à la présence d'un accéléromètre et la gestion automatisée des seuils de capture de stimulation. Une durée nominale de largeur d'impulsion de 0,24 ms assure une durée de vie de la batterie de l'ordre de 10-12 ans2. Le Micra VR permet une stimulation en mode VVI tandis que le Micra AV, plus récent, permet une stimulation en mode VDD (stimulation avec synchronisme auriculo-ventriculaire).

Le Micra Post Approval Registry (PAR) est un registre multicentrique évaluant l'efficacité et la sécurité du Micra VR en contexte clinique réel3. Publiée en 2018, l'étude a inclus 1 817 patients suivis pour une durée moyenne de 6,8 ± 6,9 mois. Les indications de stimulation étaient 1) la présence d'une fibrillation auriculaire à réponse ventriculaire lente (62 %), 2) une syncope (13 %), 3) la présence d'un bloc auriculo-ventriculaire (AV) de haut grade (12 %) et 4) la dysfonction sinusale. L'implantation du Micra VR a été réussie chez 99,1 % des patients, 64 % des stimulateurs étant implantés au niveau du septum. Le taux de complications majeures était de 2,26 % (prédit à 2,7 % pour un suivi de 12 mois), ce qui correspond à une réduction de 63 % en comparaison indirecte à une cohorte de patients semblables implantés avec un stimulateur monochambre de type conventionnel. Les complications rapportées étaient d'ordre vasculaire (0,61 %), des perforations cardiaques/ épanchements péricardiques (0,44 %), des dislocations de l'appareil (0,06 %) et des infections (0,18 %).
Le Micra VR a montré une excellente performance électrique avec une impédance de stimulation et une détection ventriculaire stables au cours du temps. Les seuils de stimulation étaient également bas et stables dans le décours du suivi.
La première génération de stimulateur sans sonde - le Micra VR - ne permet qu'une stimulation en mode VVI (pas AV synchrone). Ce type de stimulateur n'est implanté en pratique clinique que dans 14 % des indications de mise en place d'un stimulateur cardiaque. Le stimulateur cardiaque « double chambre » est recommandé chez les patients présentant un rythme sinusal (avec bloc AV de haut degré) car il permet d'éviter le « syndrome du pacemaker », améliore le débit cardiaque, le statut fonctionnel et la qualité de vie du patient.
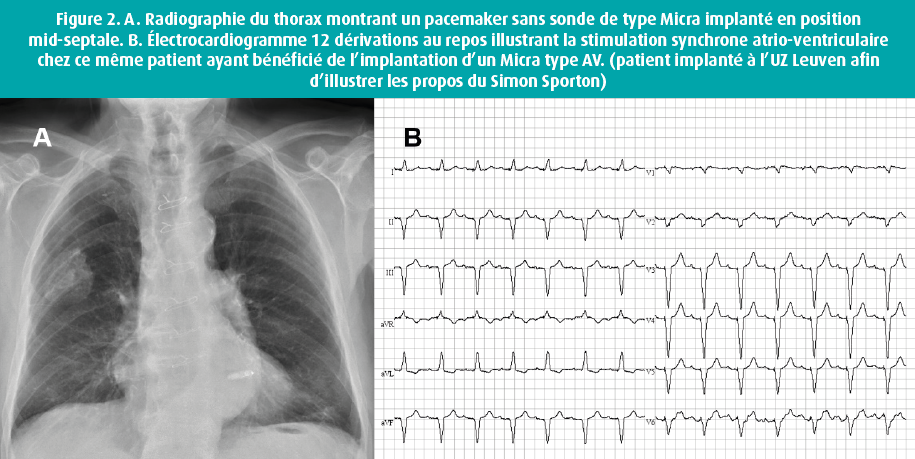
La deuxième génération de stimulateur sans sonde - le Micra AV - permet de stimuler le ventricule tout en assurant un synchronisme AV. L'accéléromètre tridimensionnel contenu dans le Micra permet de reconnaître les différentes phases du cycle cardiaque et en particulier l'activité mécanique de l'oreillette (appelée A4/AM). Le stimulateur est alors capable de fonctionner en mode VDD (figure 2).
L'étude MARVEL 2 a permis de tester l'algorithme de stimulation prévu pour assurer la stimulation AV synchrone chez les patients présentant un rythme sinusal et un bloc AV complet4. L'étude de courte durée (max 5 h) a inclus un total de 75 patients dont 40 patients en bloc AV complet. Au sein de cette population, le nouvel algorithme a permis d'améliorer significativement le synchronisme AV de 26,8 % (mode VVI) à 89,2 % (mode VDD) (p < 0,001). Grâce au mode VDD, le débit cardiaque (mesuré par le paramètre échocardiographique LVOT-VTI) a été significativement amélioré (p = 0,002). Ces résultats étaient toutefois obtenus chez le sujet au repos. Il semble en effet que les modifications de posture ou l'activité physique diminuent le pourcentage de synchronisme AV.
Enfin, le Micra AV contient également 2 modes switch. Le premier appelé « AV Conduction Mode Switch » permet de réduire le pourcentage de stimulation ventriculaire en présence d'une activité ventriculaire intrinsèque > 40/min. Le second mode switch appelé « Activity Mode Switch » permet un passage en mode VDIR dans le but d'améliorer la tachycardisation nécessaire à l'effort.
Simon Sporton a conclu son exposé en présentant les principales indications du stimulateur cardiaque sans sonde qui ne sont pas reprises dans les recommandations actuelles de l'ESC sur le pacing (tableau 1).

Traitement par défibrillateur en 2021 : sauver des vies tout en réduisant la survenue de chocs
Tomas Datino - Madrid, Espagne
L'utilisation des défibrillateurs automatiques implantables (DAI) en pratique clinique est souvent considérée couteuse et a été récemment remise en question. En effet, les études sur lesquelles se basent les recommandations internationales sont souvent considérées comme « archaïques ». De plus, les résultats de la récente étude DANISH remettaient également en question le positionnement du défibrillateur dans la stratégie thérapeutique avec l'évolution des traitements médicamenteux de l'insuffisance cardiaque. En réalité, plusieurs études récentes confirment l'intérêt du défibrillateur automatique implantable dans la réduction de mortalité même en prévention primaire.
Dans la première partie de son exposé, Tomas Datino a présenté les données de la littérature récente confirmant la place thérapeutique du DAI.
Tout d'abord, une analyse minutieuse des données de l'étude DANISH publiée dans le New England Journal of Medicine montre une réduction de la mortalité au sein d'une population bien sélectionnée de patients présentant une cardiopathie non ischémique à fraction d'éjection < 35 %. Si le DAI ne permet pas de réduire la mortalité globale des patients inclus dans l'étude, il permet de réduire de moitié la survenue de mort cardiaque subite et réduit le mortalité globale de 36 % au sein des patients âgés de moins de 68 ans5.
Une sous-analyse de l'étude PARADIGM-HF dont l'objectif principal était d'évaluer l'effet du traitement sacubitril/valsartan sur la mortalité cardiaque subite montre également l'intérêt du DAI. Cette étude a montré que sur 85 % des patients éligibles pour un DAI, seuls 15 % étaient effectivement porteurs d'un DAI.
Au sein des patients éligibles pour un traitement par DAI, le DAI réduit de 56 % le risque de mort subite et ce aussi bien chez les patients atteints de cardiopathie ischémique (p < 0,001) que non ischémique (p = 0,02)6. Le traitement sacubitril/ valsartan permet aussi de réduire le risque de mort subite de 51 % chez les patients porteurs d'un DAI et de 19 % chez les patients non porteur d'un DAI.
Le récent registre européen EU-CERT-ICD, dont les résultats ont été publiés en 2020, a permis de montrer en contexte clinique réel l'efficacité du DAI en prévention primaire dans une population de 2 327 patients atteints d'une cardiopathie ischémique ou dilatée (fraction d'éjection < 35 %, QRS fins). L'implantation prophylactique d'un DAI est associée avec une réduction de la mortalité de 27 %7. Le registre SwedeHF a également montré la réduction significative de mortalité en prévention primaire et a même mis en évidence une certaine sous-utilisation du DAI en pratique clinique : seuls ± 10% (1305/16702) des patients présentant une indication de DAI en prévention primaire en étaient effectivement porteurs8.
Dans la deuxième partie de sa présentation, Tomas Datino a présenté une revue de la littérature sur la réduction du risque de thérapies/chocs inappropriés.
La première étude présentée PainFREE Rx II montre l'intérêt de l'usage de la stimulation anti-tachycardie (dite ATP) même lors de tachycardie ventriculaire rapides (188 - 250/min)9. La délivrance d'ATP permet d'arrêter l'arythmie ventriculaire et d'éviter la survenue d'un choc dans 72 % des cas tout améliorant la qualité de vie des patients sans diminuer l'efficacité du DAI.
Une deuxième possibilité d'éviter la survenue de chocs inappropriés est d'allonger le temps de détection de l'arythmie ventriculaire. Cette stratégie a été évaluée dans l'étude ADVANCE II qui a inclus 1 902 patients porteurs d'un DAI10. Un allongement de l'intervalle de détection de l'arythmie a permis de réduire la nécessité de tout traitement de 37 % et a réduit la survenue de chocs inappropriés de 45 % sans provoquer d'augmentation du taux de syncope ou de mortalité. L'intérêt de l'allongement de l'intervalle de détection a été confirmé en pratique clinique par le registre espagnol Umbrella11.
Une troisième méthode pour réduire les chocs inappropriés est l'usage d'algorithmes de discrimination permettant de mieux reconnaitre l'arythmie ventriculaire. Ainsi, la SmartShock Technology proposée dans les défibrillateurs de la marque Medtronic permet de réduire le taux de chocs inappropriés à 1 an à un taux de 1,5 % pour les défibrillateurs double chambre et resynchronisant et à 2,5 % pour les défibrillateurs simple chambre12. L'efficacité des algorithmes de discrimination a également été démontrée par un registre de patients en contexte clinique réel13.
Ces différentes études sur la programmation des DAI ont permis l'élaboration de recommandations sur la programmation des DAI en tenant compte de la marque du défibrillateur14.
En conclusion, les études récentes et plusieurs registres incluant des patients porteurs de DAI ont montré une réduction de mortalité chez les patients avec fraction d'éjection abaissée. La meilleure stratégie thérapeutique est un traitement médicamenteux optimal combiné à l'implantation d'un DAI qui reste trop peu utilisé en contexte clinique.
Chez les patients porteurs d'un DAI, la stimulation anti-tachycardie, l'allongement des délais de détection et l'usage des algorithmes de discrimination permettent de diminuer la survenue de chocs inappropriés.
Références
- Udo, E.O., Zuithoff, N.P., van Hemel, N.M., de Cock, C.C., Hendriks, T., Doevendans, P.A. et al. Incidence and predictors of short- and long-term complications in pacemaker therapy: the FOLLOWPACE study. Heart Rhythm, 2012, 9 (5), 728-735.
- Ritter, P., Duray, G.Z., Steinwender, C., Soejima, K., Omar, R., Mont, L. et al. Early performance of a miniaturized leadless cardiac pacemaker: the Micra Transcatheter Pacing Study. Eur Heart J, 2015, 36 (37), 2510-2519.
- El-Chami, M.F., Al-Samadi, F., Clementy, N., Garweg, C., Martinez-Sande, J.L., Piccini, J.P. et al. Updated performance of the Micra transcatheter pacemaker in the real-world setting: A comparison to the investigational study and a transvenous historical control. Heart Rhythm, 2018, 15 (12), 1800-1807.
- Steinwender, C., Khelae, S.K., Garweg, C., Sun Chan, J.Y., Ritter, P., Johansen, J.B. et al. Atrioventricular synchronous pacing using a leadless ventricular pacemaker: Results from the MARVEL 2 study. JACC Clin Electrophysiol, 2019, 6 (1), 94-106.
- Kober, L., Thune, J.J., Nielsen, J.C., Haarbo, J., Videbaek, L., Korup, E. et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med, 2016, 375 (13), 1221-1230.
- Rohde, L.E., Chatterjee, N.A., Vaduganathan, M., Claggett, B., Packer, M., Desai, A.S. et al. Sacubitril/Valsartan and Sudden Cardiac Death According to Implantable Cardioverter-Defibrillator Use and Heart Failure Cause: A PARADIGM-HF Analysis. JACC Heart Fail, 2020, 8 (10), 844-855.
- Zabel, M., Willems, R., Lubinski, A., Bauer, A., Brugada, J., Conen, D. et al. Clinical effectiveness of primary prevention implantable cardioverter-defibrillators: results of the EU-CERT-ICD controlled multicentre cohort study. Eur Heart J, 2020, 41 (36), 3437-3447.
- Schrage, B., Uijl, A., Benson, L., Westermann, D., Stahlberg, M., Stolfo, D. et al. Association Between Use of Primary- Prevention Implantable Cardioverter- Defibrillators and Mortality in Patients With Heart Failure: A Prospective Propensity Score-Matched Analysis From the Swedish Heart Failure Registry. Circulation, 2019, 140 (19), 1530-1539.
- Wathen, M.S., DeGroot, P.J., Sweeney, M.O., Stark, A.J., Otterness, M.F., Adkisson, W.O. et al. Prospective randomized multicenter trial of empirical antitachycardia pacing versus shocks for spontaneous rapid ventricular tachycardia in patients with implantable cardioverter-defibrillators: Pacing Fast Ventricular Tachycardia Reduces Shock Therapies (PainFREE Rx II) trial results. Circulation, 2004, 110 (17), 2591-2596.
- Gasparini, M., Proclemer, A., Klersy, C., Kloppe, A., Lunati, M., Ferrer, J.B. et al. Effect of long-detection interval vs standard-detection interval for implantable cardioverter-defibrillators on antitachycardia pacing and shock delivery: the ADVANCE III randomized clinical trial. JAMA, 2013, 309 (18), 1903-1911.
- Loughlin, G., Datino, T., Arenal, A., Ruiz- Granell, R., Sanchez-Gomez, J.M., Perez, L. et al. Predictors of adoption and impact of evidence-based programming on the incidence of implantable cardioverterdefibrillator therapies. Rev Esp Cardiol (Engl Ed), 2021, 74 (4), 296-302.
- Auricchio, A., Schloss, E.J., Kurita, T., Meijer, A., Gerritse, B., Zweibel, S. et al. Low inappropriate shock rates in patients with single- and dual/triple-chamber implantable cardioverter-defibrillators using a novel suite of detection algorithms: PainFree SST trial primary results. Heart Rhythm, 2015, 12 (5), 926-936.
- Regoli, F., Graf, D., Schaer, B., Duru, F., Ammann, P., Stefano, L. et al. Arrhythmic episodes in patients implanted with a cardioverter-defibrillator - results from the Prospective Study on Predictive Quality with Preferencing PainFree ATP therapies (4P). BMC Cardiovasc Disord, 2019, 19 (1), 146.
- Wilkoff, B.L., Fauchier, L., Stiles, M.K., Morillo, C.A., Al-Khatib, S.M., Almendral, J. et al. 2015 HRS/EHRA/APHRS/SOLAECE expert consensus statement on optimal implantable cardioverter-defibrillator programming and testing. Heart Rhythm, 2016, 13, e50-86.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.