L'embolie pulmonaire occupe la troisième place des pathologies cardiovasculaires aiguës les plus fréquentes (derrière l'infarctus aigu du myocarde et l'AVC ischémique), avec une incidence de 1/1 000 par an en Europe et est corrélée à la morbidité (à court comme à long terme) et à la mortalité.1
Comme nous l'apprennent les recommandations émises par l'ESC en 2019, une détérioration hémodynamique survenant en marge d'une importante embolie pulmonaire est due à une insuffisance cardiaque droite et suit un schéma fixe qui porte bien son surnom de « spirale de la mort ».2 Le risque de mortalité à 30 jours présente une corrélation directe avec le degré de surcharge cardiaque droite (right heart strain). Ce constat a conduit à une stratification du risque clairement délimitée dans l'embolie pulmonaire aiguë (figure 1) : bas risque, risque intermédiaire bas, risque intermédiaire haut (RIH) et haut risque (assortis respectivement d'un risque de mortalité à 30 jours de < 1 %, 3,1 %, 10,4 % et 24,4 %).2
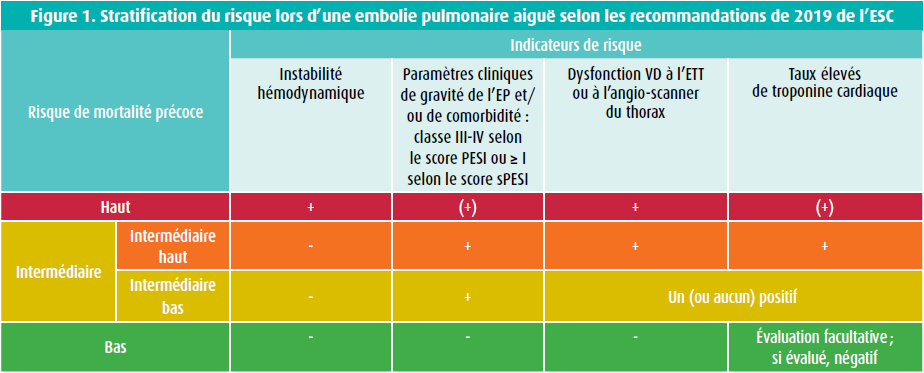
Le traitement d'une embolie pulmonaire aiguë vise logiquement la prévention et/ou l'inversion la plus rapide possible de cette surcharge cardiaque droite.2 Le choix du traitement est déterminé - compte tenu du rapport risques/bénéfices - par ce risque de mortalité et diffère par conséquent selon la catégorie de risque. Aux extrêmes du spectre, la prise en charge est sans équivoque : anticoagulation pour une embolie pulmonaire à bas risque (classe I) et thrombolyse systémique pour une embolie pulmonaire à haut risque (classe I) - avec opération de Trendelenburg si la thrombolyse est contre-indiquée (classe I). Dans les groupes de risque intermédiaire, les preuves sont beaucoup moins robustes, mais, en présence d'un risque intermédiaire bas, l'anticoagulation systémique seule semble généralement suffisante (avec thérapie plus agressive en cas de détérioration). La catégorie la plus floue est sans conteste le groupe RIH, à savoir les patients qui sont encore (tout juste) hémodynamique stables et qui présentent une surcharge cardiaque droite manifeste (et une mortalité à 30 jours de 10,4 % !). PEITHO et Chatterjee et al., entre autres, nous ont appris qu'une thrombolyse systémique n'a « pas de sens » dans ce groupe, étant donné que le risque hémorragique fortement augmenté annihile la récupération hémodynamique favorable (recommandation de classe III, par conséquent).3,4 Dans ce groupe, la thrombolyse systémique est réservée aux cas de détérioration hémodynamique (classe I). Dans la quête d'un rapport risques/bénéfices plus favorable, l'option d'une demi-dose de thrombolyse a également été envisagée par le passé. En dépit des données initialement positives des études de Wang et al. et de MOPETT, la vaste étude de cohorte rétrospective de Kiser et al. n'a pas été en mesure de les confirmer.5-7
Ces cinq dernières années, le manque de preuves et de stratégie thérapeutique optimale dans l'embolie pulmonaire à RIH - qui, malgré un risque de mortalité élevé, reste négligée dans les recommandations - a participé à stimuler de nombreuses recherches (fructueuses) sur les options de traitement par cathéter (catheter-directed therapy, CDT).8 De nombreux dispositifs différents ont été développés, mais seuls trois d'entre eux ont été approuvés par la FDA et la CE pour cette indication (figure 2) : EKOS ou EkoSonic, FlowTriever et Indigo.9-11 Tous les CDT agissent par dissolution (pharmaco-) mécanique du caillot, qui induit une restauration de la circulation pulmonaire et une inversion de la surcharge cardiaque droite. Les différences techniques, les principales données/études et mes arguments pour/contre personnels pour chaque dispositif sont repris au tableau 1.
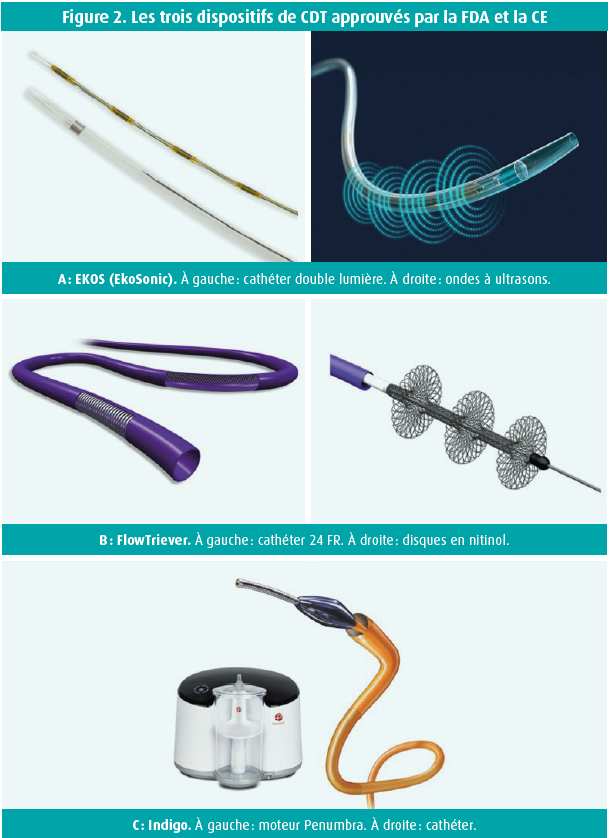
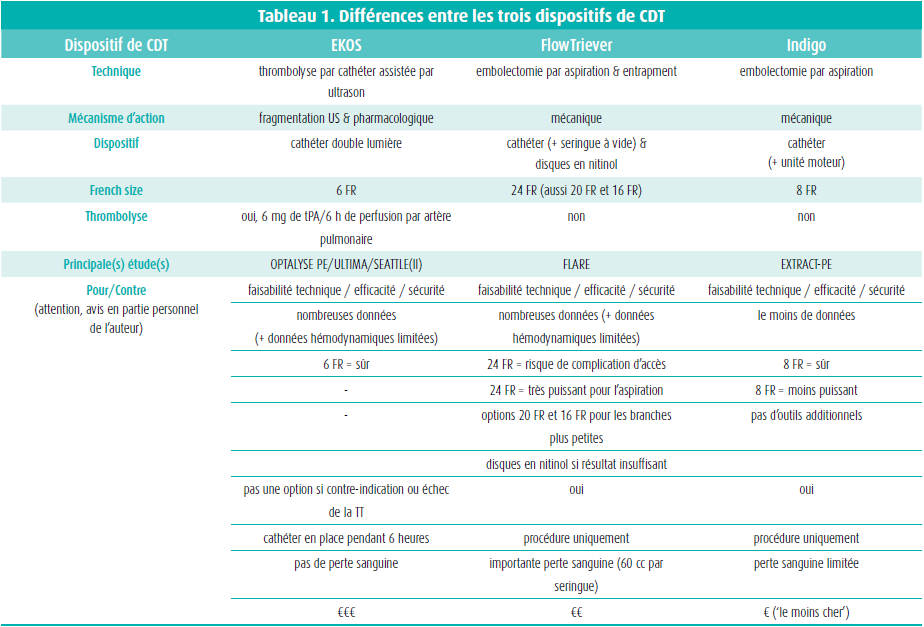
Dans tous les cas, les trois systèmes de cathéter ont largement prouvé leur faisabilité technique, leur efficacité et leur sécurité. Parmi les autres avantages du CDT, pointons son effet rapide, son invasivité limitée (contrairement à l'opération de Trendelenburg et sous anesthésie locale) et la rareté des passages en soins intensifs. Le tout a conduit à un positionnement clair du traitement par cathéter lors d'embolies pulmonaires aiguës dans les recommandations de l'ESC : classe IIa en cas de haut risque (si contre-indication ou échec de la thrombolyse systémique) et classe IIa en cas de RIH (si détérioration hémodynamique sous anticoagulation).
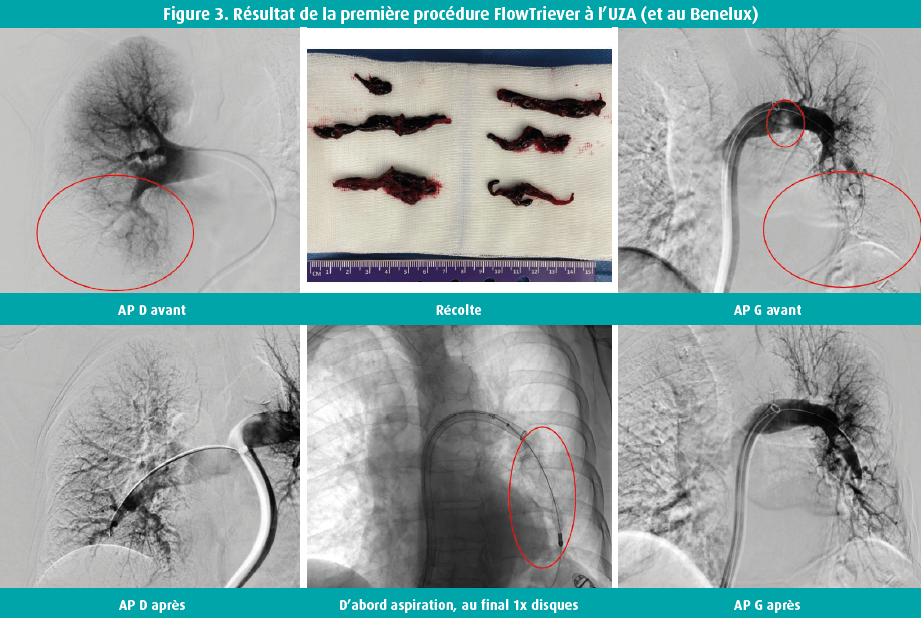
Toutefois, en dépit de l'efficacité et de la facilité d'utilisation établies (à la fois dans le cadre de vastes études et de ma propre première expérience, cf. addendum et figure 3), une certaine prudence reste de rigueur. En effet, toutes les preuves actuelles à l'appui des CDT proviennent d'études non randomisées (américaines), qui mettaient l'accent sur la faisabilité et la surcharge cardiaque droite et qui évaluaient l'efficacité à l'aune d'une TDM de contrôle (avant/après, utilisant le rapport des diamètres VD/VG comme marqueur de surcharge cardiaque droite). Aucun bénéfice clinique « robuste », tel qu'une réduction de morbidité ou de mortalité, n'a jamais été démontré.12 Malgré tout, les récentes données hémodynamique pré- et post-CDT sont prometteuses, mais nous avons besoin d'une plus grande quantité de données.13
Pour la pratique clinique belge, le défi consiste à implémenter ces techniques très onéreuses et non remboursées dans nos soins. L'ascension des CDT aux États- Unis, récemment couronnée par un accès au remboursement, fait très probablement obstacle à la conduite de vastes études de résultats randomisées. Si nous voulons convaincre l'INAMI de la plus-value de cette technique, il s'agira de combiner un maximum de données belges/ européennes avec celles de grands groupes américains afin de démontrer un bénéfice « plus robuste ». Dans le cas spécifique du FlowTriever, le registre FLASH (1 000 patients, all-comers, américains et européens), où sont également analysées des données hémodynamiques et échocardiographiques, devrait marquer un tournant.
En résumé, le traitement par cathéter est un new kid on the block prometteur et exaltant parmi les options thérapeutiques pour l'embolie pulmonaire grave aiguë. À l'heure actuelle, il a principalement sa place dans l'embolie pulmonaire à RIH − précédemment sous-traitée − et dans l'embolie pulmonaire à haut risque en cas de contre-indication à la thrombolyse. Reste à présent à voir si l'usage du CDT (et son indication) augmentera fortement au cours des années à venir.
Addendum
L'hôpital universitaire d'Anvers, pionnier du FlowTriever au Benelux
Depuis 2021, l'UZA (Universitair Ziekenhuis Antwerpen) a démarré, en partie dans la foulée de la création d'une équipe multidisciplinaire Pulmonary Embolism Response Team (PERT), un programme de CDT impliquant le FlowTriever pour le traitement des patients victimes d'une embolie pulmonaire à risque intermédiaire haut n'obtenant pas de réponse suffisante à l'anticoagulation dans les premières 24 heures. La première procédure FlowTriever du Benelux a été réalisée dans le cadre de cette étude pilote le 19 mai 2021 (figure 3). La procédure de CDT en tant que telle est une entreprise conjointe entre la radiologie et la cardiologie interventionnelles. À ce jour, 5 patients à RIH ont été traités au moyen du FlowTriever à l'UZA, tous ayant atteint une récupération très rapide de la surcharge cardiaque droite (à la fois une baisse immédiate de la pression pulmonaire mesurée de manière invasive et une normalisation du ventricule droit à l'ETT dès le jour 1). Nous espérons que le groupement des données via notre participation au registre FLASH nous fournira des informations plus nombreuses et « plus robustes » sur la technique et donnera un coup de fouet supplémentaire à notre programme CDT.
Références
- Keller, K., Hobohm, L., Ebner, M. et al. Trends in thrombolytic treatment and outcomes of acute pulmonary embolism in Germany. Eur Heart J, 2020, 41, 522529.
- Konstantinides, S.V., Meyer, G., Becattini, C. et al. The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur Respir J, 2019, 54 (3), 1901647.
- Meyer, G., Vicaut, E., Danays, T. et al. PEITHO Investigators. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med, 2014, 370 (15), 1402-1411.
- Chatterjee, S., Chakraborty, A., Weinberg, I. et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis. JAMA, 2014, 311 (23), 2414- 2421.
- Wang, C., Zhai, Z., Yang, Y. et al. China Venous Thromboembolism (VTE) Study Group. Efficacy and safety of low dose recombinant tissue-type plasminogen activator for the treatment of acute pulmonary thromboembolism: a randomized, multicenter, controlled trial. Chest, 2010, 137 (2), 254-262.
- Sharifi, M., Bay, C., Skrocki, L. et al. “MOPETT” Investigators. Moderate pulmonary embolism treated with thrombolysis ("MOPETT" Trial). Am J Cardiol, 2013, 111 (2), 73-77.
- Kiser, T.H., Burnham, E., Clark, B. et al. Half-Dose Versus Full-Dose Alteplase for Treatment of Pulmonary Embolism. Crit Care Med, 2018, 46 (10), 1617-1625.
- de Winter, M.A., Vlachojannis, G.J., Ruigrok, D. et al. Rationale for catheter-based therapies in acute pulmonary embolism. Eur Heart J Suppl, 2019, 21 (Suppl I), I16-I22. doi: 10.1093/eurheartj/suz223. Epub 2019 Nov 21.
- Tapson, V.F., Sterling, K., Jones, N. et al. A randomized trial of the optimum duration of acoustic pulse thrombolysis procedure in acute intermediate-risk pulmonary embolism: the OPTALYSE PE trial. JACC Cardiovasc Interv, 2018, 11, 1401-1410.
- Tu, T., Toma, C., Tapson, V.F. et al; FLARE Investigators. A Prospective, Single-Arm, Multicenter Trial of CatheterDirected Mechanical Thrombectomy for Intermediate- Risk Acute Pulmonary Embolism: The FLARE Study. JACC Cardiovasc Interv, 2019, 12 (9), 859-869.
- Sista, A.K., Horowitz, J.M., Tapson, V.F. et al. EXTRACT-PE Investigators. Indigo Aspiration System for Treatment of Pulmonary Embolism: Results of the EXTRACT-PE Trial. JACC Cardiovasc Interv, 2021, 14 (3), 319-329.
- Chopard, R., Ecarnot, F., Meneveau, N. Catheter-directed therapy for acute pulmonary embolism: navigating gaps in the evidence. Eur Heart J Suppl, 2019, 21 (Suppl I), I23-I30.
- Toma, C. et al. FlowTriever is Safe and Effective for Acute PE - FLASH 500 patients interim results, TCT 2021 - ahead of publication.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.