Jacqueline Bernheim Award
La mort subite à la suite de troubles du rythme cardiaque engageant le pronostic vital est et reste un problème de santé important. Les hémicanaux de Cx43 sont un nouveau mécanisme de canaux ioniques impliqué dans les arythmies menaçant la vie du patient. La Cx43, une protéine de connexine cardiaque importante, forme des hémicanaux qui s'accumulent au niveau du disque intercalaire et des jonctions communicantes. Bien que les jonctions communicantes soient essentielles pour la conduction électrique dans le coeur, le rôle des hémicanaux est peu connu. Mieux encore, on a longtemps pensé que les hémicanaux n'étaient rien de plus que des précurseurs inactifs des jonctions communicantes. Des preuves récentes permettent toutefois de penser que l'inhibition de l'ouverture des hémicanaux de Cx43 par le Gap19 possède des effets anti-arythmiques. L'utilisation de diverses techniques d'électrophysiologie, d'imagerie et de super-résolution a permis d'étudier le mécanisme de l'activation des hémicanaux de la Cx43 dans les cellules musculaires ventriculaires et son impact sur la stabilité électrique. Les hémicanaux de Cx43 sont activés durant la libération diastolique de Ca2+ dans les cellules musculaires ventriculaires. L'ouverture des hémicanaux de Cx43 provoque un influx de Ca2+ dans un microdomaine capable d'activer les récepteurs de la ryanodine. L'ouverture des hémicanaux de Cx43 engendre ainsi une libération massive de Ca2+ dans les cellules musculaires cardiaques qui contribue aux post-dépolarisations durant le potentiel d'action. Ces postdépolarisations peuvent induire des potentiels d'action prématurés qui sont arythmogènes. Une activité accrue des hémicanaux, qui contribue à l'instabilité électrique, a été observée dans le tissu du muscle cardiaque des patients au stade terminal de l'insuffisance cardiaque. L'inhibition sélective des hémicanaux de Cx43 par le Gap19 peut rétablir la stabilité électrique. En outre, d'autres groupes de recherche ont découvert un rôle joué par les hémicanaux de Cx43 et leur inhibition par le Gap19 dans les arythmies ventriculaires associées à la dystrophie musculaire de Duchenne et à la cardiomyopathie arythmogène du ventricule droit. Nous concluons que le couplage du microdomaine entre les hémicanaux de Cx43 et l'homéostasie du Ca2+ cellulaire est un nouveau mécanisme traitable, qui contribue à des troubles du rythme cardiaque susceptibles de provoquer une mort subite.
Mort subite
La mort subite est une des principales causes de décès dans le monde occidental. La mort subite, définie comme un décès naturel présumé d'origine cardiaque, est une mort soudaine généralement due à une arythmie potentiellement mortelle, telle qu'une tachycardie ventriculaire ou une fibrillation ventriculaire.1 En dépit des progrès scientifiques majeurs, l'impact médical, social et économique de la mort subite reste inacceptablement élevé.2 Malgré les compétences répandues en réanimation, les nombreux défibrillateurs automatisés externes disponibles, les progrès en matière de soins de (post)-réanimation et l'arrivée d'anti-arythmiques, de défibrillateurs internes et de l'ablation par cathéter, la mort subite continue à faire des millions de victimes chaque année dans le monde (0,1 % par an).3 Des études scientifiques innovantes sur les causes et la pathophysiologie de la mort subite et des arythmies potentiellement mortelles sont nécessaires d'urgence afin de développer de nouvelles stratégies de prévention et de traitement.2
Connexines dans le coeur
De manière générale, l'arythmie se caractérise par une activité électrique anormale du muscle cardiaque. Le coeur humain est composé de plusieurs milliards de cellules musculaires cardiaques dont les propriétés électriques et contractiles sont influencées par les interactions avec les cellules endothéliales, les fibroblastes, les cellules des muscles lisses, les cellules immunitaires et le système nerveux autonome.4 Dans cet environnement complexe, une communication intercellulaire strictement régulée est nécessaire pour le bon fonctionnement du muscle cardiaque. à cet égard, deux éléments sont cruciaux : l'excitabilité électrique des cellules du muscle cardiaque et la propagation électrique du signal électrique.5 Au niveau moléculaire, l'excitabilité électrique du tissu du muscle cardiaque est assurée par les canaux ioniques qui dépolarisent et repolarisent les cellules du muscle cardiaque et génèrent ainsi le potentiel d'action cardiaque. Les signaux électriques générés dans le noeud sinusal sont transmis via un système de conduction spécialisé, afin que le muscle cardiaque puisse se contracter de manière synchronisée et pomper le sang vers la circulation. Les protéines de connexine (Cx) sont abondantes dans le coeur, où elles se combinent en hémicanaux et en jonctions communicantes. Les jonctions communicantes cardiaques dirigent la conduction électrique et les signaux chimiques dans le tissu du muscle cardiaque et le système de conduction. Elles synchronisent ainsi le cycle cardiaque et garantissent une fonction de pompe adéquate.
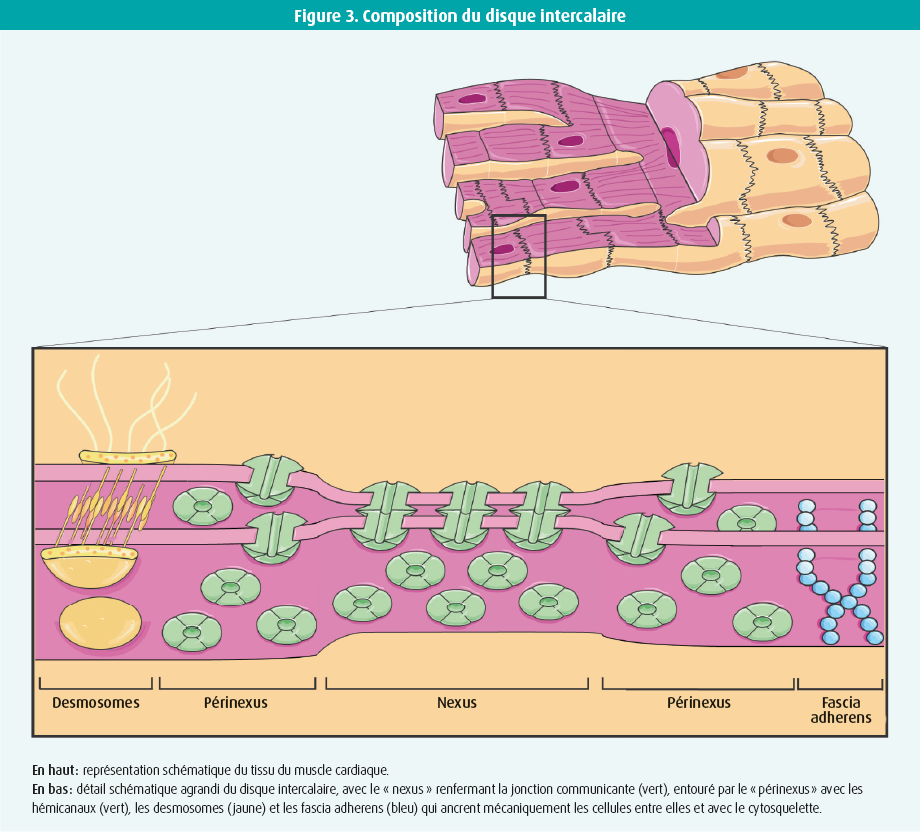
Les jonctions communicantes constituent la forme la plus directe de communication entre deux cellules, en créant une connexion directe entre le cytoplasme de cellules voisines. Les fondements de ces jonctions sont codés par 21 gènes dans le corps humain.6 Quatre isotypes de connexine sont exprimés dans le tissu du muscle cardiaque : Cx43, Cx40, Cx45 et Cx31.9 (figure 1).7 La Cx43 est la principale protéine de connexine dans les ventricules, mais elle est également exprimée dans les oreillettes et dans les fibres de Purkinje. La Cx40 est présente dans les oreillettes et dans le système de conduction intraventriculaire. La Cx45 se retrouve quant à elle dans les oreillettes et dans le système de conduction entier et la Cx31.9, exclusivement dans le noeud sinusal. Après transcription et traduction, les protéines de connexine s'oligomérisent en une structure hexamérique qui est ensuite transportée, sous forme d'hémicanal, jusqu'à la membrane plasmique via le cytosquelette. Ces hémicanaux forment des jonctions communicantes par interaction entre eux dans les cellules du muscle cardiaque, au niveau des disques intercalaires (figures 2 et 3). Bien que les hémicanaux soient normalement fermés, ils s'ouvrent durant la formation des jonctions communicantes. Les plaques de jonctions communicantes sont composées de milliers de jonctions communicantes intercellulaires d'une importance cruciale pour la transmission des signaux dans le coeur. L'organisation en plaques garantit une réserve de connexions sûre, étant donné l'importance physiologique des jonctions communicantes.8 Dans un contexte pathologique, l'expression des connexines diminue, ce qui entraîne une réduction de la réserve de connexions. Cette situation peut conduire à une perturbation de la communication intercellulaire, à un ralentissement de la propagation des impulsions et à l'apparition d'arythmies.7 étant donné le rôle essentiel des jonctions communicantes reposant sur la Cx43 dans le coeur, les variantes pathogènes provoquent souvent une fausse couche ou une mort subite du nourrisson.9, 10 Des variantes pathogènes des Cx40, Cx43 et Cx45 associées à une fibrillation atriale ou à une pathologie de la conduction ont également été décrites.11-13 En cas de pathologie acquise du muscle cardiaque, telle qu'une cardiopathie ischémique, une valvulopathie ou une cardiomyopathie, les modifications pathophysiologiques entraînent une perturbation de la fonction des canaux de connexine, qui s'accompagne d'une diminution de la densité des jonctions communicantes, des connexines qui se remodèlent et se redistribuent à partir du disque intercalaire. La conduction des impulsions est dès lors perturbée.7 Dans le passé, une relation claire et reproductible a été mise en évidence entre les jonctions communicantes cardiaques, les troubles du rythme et la mort subite. Les jonctions communicantes sont donc importantes dans le coeur tant sain que malade.

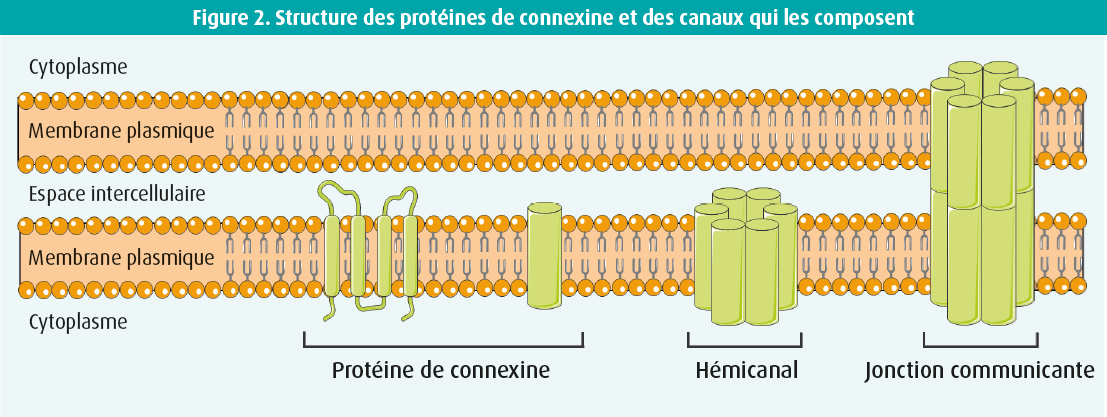
La topologie de la membrane des protéines de connexine comporte quatre domaines transmembranaires reliés par deux boucles extracellulaires et une boucle cytoplasmique. Les extrémités C- et N-terminales des connexines se trouvent dans le cytoplasme. Six protéines de connexine s'oligomérisent afin de former un hémicanal. Deux de ces hémicanaux présents sur des cellules voisines interagissent et forment ainsi une jonction communicante.
étant donné l'importance pathophysiologique des jonctions communicantes dans le coeur, différentes molécules ont été développées dans le passé afin de moduler les jonctions communicantes. Le danégaptide et le rotigaptide sont les seuls modulateurs des jonctions communicantes qui ont finalement fait l'objet d'un trajet d'étude clinique et dont il a été montré qu'ils sont sûrs lors d'études cliniques de phase I.14, 15 Des études cliniques de phase II évaluant le rotigaptide et le danégaptide comme anti-arythmiques ou comme traitement adjuvant dans l'ischémie myocardique ont débuté en 2005 mais ont été arrêtées prématurément (ClinicalTrials.gov identifiers : NCT00137332, NCT00137293).8, 16, 17 L'étude clinique de phase II portant sur le rotigaptide pour la prévention des arythmies ventriculaires a été arrêtée pour des raisons stratégiques, afin de donner la priorité au développement du danégaptide. Une étude clinique de phase II n'a pas pu mettre en évidence d'avantage du danégaptide comme traitement adjuvant à l'intervention coronaire percutanée pour limiter la taille de l'infarctus.15 Jusqu'à présent, aucun autre médicament ciblant les canaux de la connexine n'a été testé cliniquement. Les résultats décevants des études cliniques sur les modulateurs des jonctions communicantes ont fait naître un intérêt pour d'autres formes de signalisation par les connexines, comme les hémicanaux.
Hémicanaux de Cx43 et arythmies ventriculaires
Un rôle fonctionnel des hémicanaux dans les maladies cardiovasculaires a été plus récemment mis clairement en évidence. Les hémicanaux de Cx43 se manifestent à divers endroits des cellules du muscle cardiaque, notamment au niveau du disque intercalaire et dans des organites tels que les mitochondries.8, 15, 16 Bien que les hémicanaux soient normalement fermés, ils peuvent être activés par des médiateurs de l'inflammation, une augmentation de la concentration de Ca2+ intracellulaire, la dépolarisation membranaire ou des modifications post-traductionnelles.8 Un hémicanal de Cx43 ouvert agit comme un pore non sélectif à conductance élevée, permettant ainsi un influx non contrôlé d'ions tels que Na+ et Ca2+. Une perte de K+, de petits métabolites et de molécules de signalisation a également lieu.8 Il n'est donc pas étonnant que l'ouverture de quelques hémicanaux seulement puisse avoir une influence considérable sur le potentiel membranaire, l'homéostasie du Ca2+ intracellulaire et le métabolisme cellulaire. La preuve des effets cardiaques de l'ouverture des hémicanaux de Cx43 est issue d'études précliniques, avec confirmation dans le tissu du muscle cardiaque humain.
Une étude préclinique a montré que les hémicanaux de Cx43 sont impliqués dans les arythmies ventriculaires et dans la mort subite dans la dystrophie musculaire de Duchenne19, 20, ainsi que dans la cardiomyopathie arythmogène du ventricule droit.21 La pathophysiologie sous-jacente lors de ces études tendait dans la direction d'une perturbation de l'homéostasie du Ca2+ intracellulaire et d'un rôle du stress adrénergique, mais le mécanisme précis est demeuré peu clair et n'a pas été confirmé dans le myocarde humain. Des preuves récentes indiquent cependant que les hémicanaux de Cx43 sont très étroitement associés (10 nanomètres) aux récepteurs de la ryanodine (RyR), créant ainsi des microdomaines spécialisés.22, 23 Durant le couplage excitation-contraction, les canaux de RyR s'ouvrent en masse, de sorte que le Ca2+ quitte le réticulum sarcoplasmique et amorce la contraction du muscle cardiaque. Le stress adrénergique peut entraîner une surcharge du réticulum sarcoplasmique avec libération spontanée de Ca2+, qui sort via l'échangeur Na+/Ca2+ (NCX). Il en résulte des post-dépolarisations durant le potentiel d'action, appelées delayed afterdepolarizations. Si le potentiel seuil est atteint, un nouveau potentiel d'action suit prématurément, ce qui donne lieu à un battement cardiaque prématuré. Une telle activation électrique prématurée peut provoquer une arythmie ventriculaire et conduire à une mort subite. Une étude récente montre que l'ouverture des hémicanaux de Cx43 renforce ce mécanisme : les interactions moléculaires entre les RyR et les hémicanaux, en association avec une augmentation du Ca2+ intracellulaire, entraînent une ouverture des hémicanaux, de sorte que des ions tels que Na+ et Ca2+ pénètrent dans la cellule.23 Le Na⁺ possède un effet dépolarisant direct, tandis que le Ca2+ entrant quitte la cellule via le NCX et peut activer les RyR voisins, ce qui renforce encore la dépolarisation (figure 4). Il en résulte davantage de delayed afterdepolarizations, avec un risque accru de contraction prématurée. Ces observations ont été confirmées dans des cardiomyocytes ventriculaires et du tissu du muscle cardiaque humains de patients en insuffisance cardiaque au stade terminal. Chez les patients atteints d'une cardiomyopathie ischémique ou dilatée, les hémicanaux de Cx43 présentent une activité plus élevée. Le microdomaine hémicanal-RyR est ici responsable de modifications électriques pro-ayrthmiques.22, 23
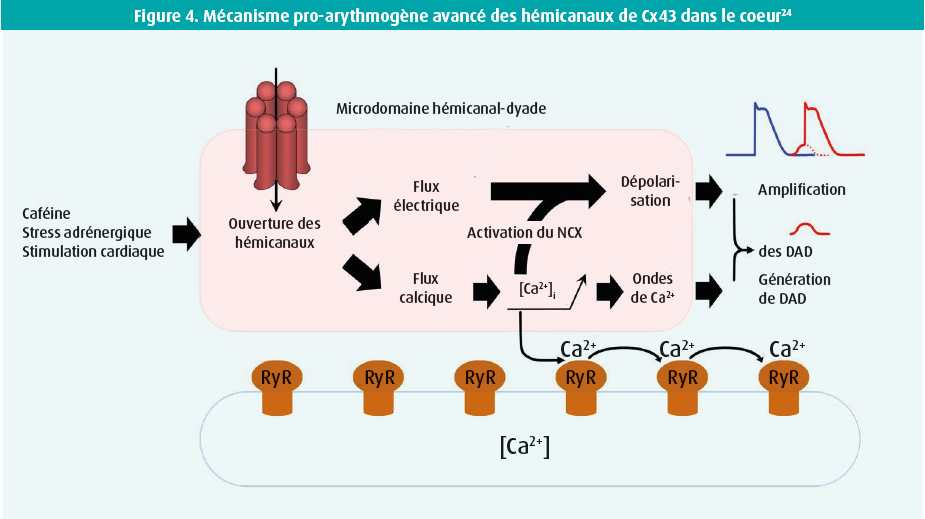
L'ouverture des hémicanaux de Cx43 provoque un flux électrique dépolarisant à la suite de l'influx d'ions chargés positivement. De plus, l'influx de Ca2+ dans le domaine hémicanal de Cx43-RyR (dyade) entraîne une augmentation locale de la concentration de Ca2+ intracellulaire pouvant provoquer des ondes de Ca2+ et l'activation du NCX, entraînant ainsi des delayed afterdepolarisations plus nombreuses et plus fortes, ainsi que des potentiels d'action prématurés pro-arythmogènes.
Pharmacologie des hémicanaux de Cx43 cardiaques : prometteur pour l'avenir
Une partie importante des études ci-dessus sur les hémicanaux de Cx43 cardiaques utilise des peptides mimétiques de la connexine basés sur une séquence spécifique de la protéine de Cx43, qui interagissent ainsi avec des domaines protéiques spécifiques afin d'influencer la fonction de ceux-ci. Ils peuvent de ce fait moduler plus spécifiquement les connexines. Une de ces molécules, le peptide Gap19, basée sur une séquence de la boucle cytoplasmique, interagit de manière spécifique avec l'extrémité C-terminale de la protéine Cx43. Le Gap19 inhibe ainsi de manière spécifique les hémicanaux de Cx43 sans inhiber les jonctions communicantes.8, 17 Ce double effet est plus marqué avec le peptide RRNYRRNY, initialement conçu pour prévenir la fermeture des jonctions communicantes.8 à l'instar du Gap19, le peptide RRNYRRNY inhibe les hémicanaux de Cx43 à la fois dans la membrane plasmique et dans les mitochondries.16 Le Gap19 et le RRNYRRNY offrent une protection contre la perfusion ischémique.16, 17 Le Gap19 prévient l'arythmie ventriculaire et la mort subite dans des modèles animaux de cardiomyopathie arythmogène du ventricule droit21 et de dystrophie musculaire de Duchenne.20 Enfin, le Gap19 prévient l'instabilité électrique dans le tissu ventriculaire des patients atteints d'une cardiomyopathie ischémique ou dilatée.23 Ces observations prometteuses soulignent que le peptide Gap19, et probablement aussi le peptide RRNYRRNY, sont des candidats potentiels à la poursuite du développement et à la confirmation dans des modèles translationnels. Il convient également de citer le RyRHCIp, un peptide qui inhibe l'hémicanal de Cx43 et qui interfère avec l'interaction entre la Cx43 et le RyR.22
Conclusion
Tant les jonctions communicantes que les hémicanaux basés sur la Cx43 s'avèrent jouer un rôle pro-arythmogène dans les arythmies ventriculaires et la mort subite. Les approches pharmacologiques ciblant le rétablissement du dysfonctionnement du canal communiquant de Cx43 dans les cardiopathies ne montrent toutefois aucun avantage dans les études cliniques. Des inhibiteurs spécifiques des hémicanaux de Cx43 sont prometteurs pour de plus amples études et pour le développement clinique.
Références
- Zeppenfeld, K., Tfelt-Hansen, J., de Riva, M., Winkel BG, Behr ER, Blom NA. et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J, 2022, 43 (40), 3997-4126.
- Marijon, E., Narayanan, K., Smith, K., Barra, S., Basso, C., Blom, M.T. et al. The Lancet Commission to reduce the global burden of sudden cardiac death: a call for multidisciplinary action. Lancet, 2023, 402 (10405), 883-936.
- Hayashi, M., Shimizu, W., Albert, C.M. The Spectrum of Epidemiology Underlying Sudden Cardiac Death. Circ Res, 2015, 116 (12), 1887-1906.
- Pinto, A.R., Ilinykh, A., Ivey, M.J., Kuwabara, J.T., D'Antoni, M.L.D., Debuque, R. et al. Revisiting Cardiac Cellular Composition. Circ Res, 2016, 118 (3), 400-409.
- van Veen, T.A.B., Stein, M., Royer, A., Le Quang, K., Charpentier, F., Colledge, W.H. et al. Impaired impulse propagation in Scn5aknockout mice: combined contribution of excitability, connexin expression, and tissue architecture in relation to aging. Circulation, 2005, 112 (13), 1927-1935.
- Willecke, K., Eiberger, J., Degen, J., Eckardt, D., Romualdi, A., Güldenagel, M. Structural and functional diversity of connexin genes in the mouse and human genome. Biol Chem, 2002, 383 (5), 725-737.
- Severs, N.J., Bruce, A.F., Dupont, E., Rothery, S. Remodelling of gap junctions and connexin expression in diseased myocardium. Cardiovasc Res, 2008, 80 (1), 9-19.
- Leybaert, L., Lampe, P.D., Dhein, S., Kwak, B.R., Ferdinandy, P., Beyer, E.C. et al. Connexins in Cardiovascular and Neurovascular Health and Disease: Pharmacological Implications. Pharmacol Rev, 2017, 69 (4), 396-478.
- Reaume, A., de Sousa, P., Kulkarni, S., Langille, B., Zhu, D., Davies, T. et al. Cardiac malformation in neonatal mice lacking connexin43. Science, 1995, 267 (5208), 1831-1834.
- Van Norstrand, D.W., Asimaki, A., Rubinos, C., Dolmatova, E., Srinivas, M., Tester, D.J. et al. Connexin43 mutation causes heterogeneous gap junction loss and sudden infant death. Circulation, 2012, 125 (3), 474-481.
- Gollob, M.H., Jones, D.L., Krahn, A.D., Danis, L., Gong, X-Q., Shao, Q. et al. Somatic mutations in the connexin 40 gene (GJA5) in atrial fibrillation. N Engl J Med, 2006, 354 (25), 2677-2688.
- Thibodeau, I.L., Xu, J., Li, Q., Liu, G., Lam, K., Veinot, J.P. et al. Paradigm of genetic mosaicism and lone atrial fibrillation: Physiological characterization of a connexin 43-deletion mutant identified from atrial tissue. Circulation, 2010, 122 (3), 236-244.
- Li, R.G., Xu, Y.J., Ye, W.G., Li, Y.J., Chen, H., Qiu, X.B., Yang, Y.Q., Bai, D. Connexin45 (GJC1) loss-of-function mutation contributes to familial atrial fibrillation and conduction disease. Heart Rhythm, 2021, 18 (5), 684-693.
- Kjølbye, A.L., Haugan, K., Hennan, J.K., Petersen, J.S. Pharmacological Modulation of Gap Junction Function with the Novel Compound Rotigaptide: A Promising New Principle for Prevention of Arrhythmias. Basic Clin Pharmacol Toxicol, 2007, 101 (4), 215-230.
- Engstrøm, T., Nepper-Christensen, L., Helqvist, S., Kløvgaard, L., Holmvang, L., Jørgensen, E. et al. Danegaptide for primary percutaneous coronary intervention in acute myocardial infarction patients: a phase 2 randomised clinical trial. Heart, 2018, 104, 1593-1599.
- Zhang, X.S., Xiang, B.R. Discontinued drugs in 2008: cardiovascular drugs. Expert Opin Investig Drugs, 2009, 18 (7), 875-885.
- De Vuyst, E., Boengler, K., Antoons, G., Sipido, K.R., Schulz, R., Leybaert L. Pharmacological modulation of connexinformed channels in cardiac pathophysiology. Br J Pharmacol, 2011, 163 (3), 469.
- Vermij, S.H., Abriel, H., van Veen, T.A.B. Refining the molecular organization of the cardiac intercalated disc. Cardiovasc Res, 2017, 113 (3), 259-275.
- Lillo, M.A., Himelman, E., Shirokova, N., Xie, L-H., Fraidenraich, D., Contreras, J.E. S-nitrosylation of Connexin43 hemichannels elicits cardiac stress induced arrhythmias in Duchenne Muscular Dystrophy mice. JCI Insight, 2019, 4 (24).
- Himelman, E., Lillo MA, Nouet J, Gonzalez JP, Zhao Q, Xie L-H. et al. Prevention of Connexin43 remodeling protects against duchenne muscular dystrophy cardiomyopathy. J Clin Invest, 2020.
- Kim, J-C., Pérez-Hernández, M., Alvarado, F.J., Maurya, S.R., Montnach, J., Yin, Y. et al. Disruption of Ca 2+ i Homeostasis and Connexin 43 Hemichannel Function in the Right Ventricle Precedes Overt Arrhythmogenic Cardiomyopathy in Plakophilin-2-Deficient Mice. Circulation, 2019, 140 (12), 1015-1030.
- Lissoni, A., Hulpiau, P., Martins-Marques, T., Wang, N., Bultynck, G., Schulz, R. et al. RyR2 regulates Cx43 hemichannel intracellular Ca2+-dependent activation in cardiomyocytes. Cardiovasc Res, 2021, 117 (1), 123-136.
- De Smet, M.A.J., Lissoni, A., Nezlobinsky, T., Wang, N., Dries, E., Pérez-Hernández, M. et al. Cx43 hemichannel microdomain signaling at the intercalated disc enhances cardiac excitability. J Clin Invest, 2021, 131 (7).
- Wang, N., De Vuyst, E., Ponsaerts, R., Boengler, K., Palacios-Prado, N., Wauman, J. et al. Selective inhibition of Cx43 hemichannels by Gap19 and its impact on myocardial ischemia/reperfusion injury. Basic Res Cardiol, 2013, 108 (1), 309.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.