In de werkgroepsessie van de Belgian Heart Rhythm Association (BeHRA) op het congres van Belgian Society of Cardiology werd dit jaar gefocust op voorkamerfibrillatie (VKF) en het risico op beroerte. In het eerste deel ging prof. Mattias Duytschaever van het AZ Sint-Jan Brugge dieper in op het anticoagulatiebeleid tijdens en na een ablatieprocedure. Nadien bediscussieerde prof. dr. John Camm van de St.-George's University and Imperial College of London of VKF slechts een risicofactor dan wel een risicomerker voor beroerte is.
1 Preventie van beroerte tijdens en na ablatie voor voorkamerfibrillatie
Periprocedurele anticoagulatie
De periprocedurele incidentie van een beroerte of TIA bij VKF-ablatie bedraagt 0,5-1 %, afhankelijk van de CHADS2- score. Voor de optimale preventie van beroerte adviseren de guidelines inname van orale anticoagulatie 1 maand vóór tot minstens 2 maanden na de ablatieprocedure, ongeacht de CHADS2-score.1 Voor patiënten die met vitamine K-antagonisten behandeld worden, geldt de aanbeveling deze niet te onderbreken voor de ablatieprocedure (INR 2-3), aangezien de COMPARE-studie duidelijk aantoonde dat ononderbroken periprocedurele inname van vitamine K-antagonisten superieur was aan overbrugging met subcutane heparine.2 Continueren van vitamine K-antagonisten leidde tot een significante reductie van zowel beroertes als van mineure bloedingen (figuur 1). Of het ook aangewezen is om behandeling met NOACs ononderbroken verder te zetten, werd nog niet in gerandomiseerde gecontroleerde studies onderzocht. Meta-analyses wijzen wel in de richting dat ononderbroken inname van NOACs even effectief is als bij vitamine K-antagonisten, maar het optimale moment van de laatste dosisinname is nog onzeker.3 Voor VKF-ablatieprocedures onder inname van NOACs wordt in afwachting van de resultaten van prospectieve studies dan ook aanbevolen dat elk centrum een eigen protocol opstelt. Twee kleine studies rapporteerden afwezigheid van beroerte bij patienten met laag tromboemboligeen risico (CHADS2-score 0-1) die postprocedureel alleen met aspirine nabehandeld werden,4, 5 maar volgens de guidelines is een nabehandeling met orale anticoagulatie gedurende 2 maanden ook bij deze patiënten de regel.

Anticoagulatie na succesvolle ablatie van VKF
Vaak wordt de vraag gesteld of anticoagulantia gestopt kunnen worden na een succesvolle ablatieprocedure. In de dagelijkse praktijk blijkt dan ook dat 30-60 % van de hoogrisicopatiënten 1 jaar na ablatie met de inname van vitamine K-antagonisten stopte.6, 7 Er zijn enerzijds echter aanwijzingen dat VKF niet alleen een directe oorzaak, maar ook een merker van verhoogd risico op beroerte is. Bovendien kan recidief van VKF asymptomatisch en ongemerkt verlopen, en zijn laattijdige recidieven van VKF mogelijk. Anderzijds weten we uit device-studies dat de burden van VKF correleert met het risico op beroerte en een ablatieprocedure VKF elimineert of minstens de burden ervan reduceert. Er zijn al beperkte, niet-gerandomiseede klinische gegevens dat ablatie - onafhankelijk van het continueren van warfarine - het risico op beroerte vermindert, en het succes van de ablatie een onafhankelijke predictor van het risico op beroerte is, naast de leeftijd en de CHA2DS2-VAScscore.8, 9 Verder zijn er beperkte gegevens dat als anticoagulantia bij laagrisicopatiënten (CHADS2-score 1 en 2) na ablatie gestopt worden, de incidentie van beroerte zeer laag is, en dit meestal gerelateerd is aan recidief van VKF.10 Zolang echter nog niet in grotere, gerandomiseerde gecontroleerde studies onderzocht werd of anticoagulantia veilig gestopt kunnen worden na een succesvolle ablatieprocedure stellen de guidelines terecht dat onafhankelijk van het succes van de ablatie, anticoagulantia nadien gecontinueerd moeten worden in alle patiënten met een CHA2DS2-VASc-score ≥ 2,1.
2 Voorkamerfibrillatie: risicofactor of risicomerker
Het is welbekend dat patiënten met VKF een verhoogde kans op een beroerte hebben. De vraag is of VKF werkelijk een oorzakelijk verband houdt met beroerte of dat VKF alleen een uiting van een verhoogd risico op beroerte is door cardiovasculaire ziekte. Met andere woorden: maakt het blijvend optreden van VKF een wezenlijk therapeutisch verschil in de preventie van beroerte bij patiënten met verhoogd cardiovasculair risico en voorgeschiedenis van VKF? Professor John Camm van de St.-George's University and Imperial College of London onderbouwde drie hypothesen aan de hand van de bekende literatuurgegevens.
Hypothese 1: VKF is het voornaamste mechanisme voor de vorming van trombo- embolie
Indien VKF een kritisch mechanisme voor de vorming van bloedklonters zou zijn, zouden trombo-embolie en beroerte alleen optreden wanneer VKF gelijktijdig of recent optrad. Het risico op beroerte zou dan gerelateerd zijn aan de burden van VKF en tromboprofylaxe zou dan obsoleet zijn zodra VKF volledig verdwenen is.
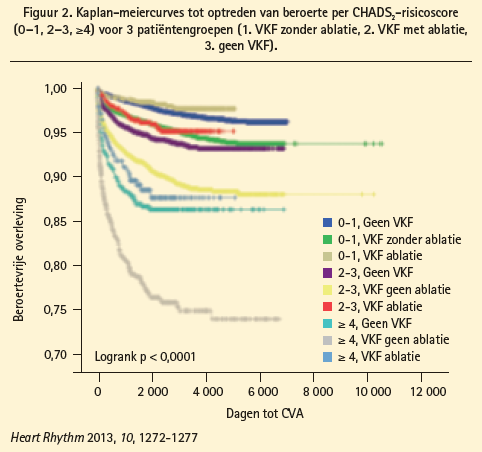
Enkele observationele studies toonden aan dat VKF behandeld met ritmecontrole resulteerde in een lagere mortaliteit en een lagere incidentie van beroerte ten opzichte van hartfrequentiecontrole. 11 Zowel voor medicamenteuze als voor interventionele ritmecontrolestrategie zijn er gegevens bekend. In de ATHENA-studie resulteerde toevoeging van dronedaron aan de standaardbehandeling met hartfrequentiecontrole en anticoagulantia in een relatieve risicoreductie van 34 % op het optreden van beroerte.12 Bunch et al. vergeleek het risico op beroerte tussen patiënten die een VKF-ablatie ondergingen, patiënten met conservatief behandelde VKF en patiënten zonder VKF.13 Voor alle CHADS2-profielen gold dat het risico op beroerte lager was in de geableerde dan in de conservatief behandelde patiëntengroep met VKF (figuur 2). Bovendien was in deze studie het risico op beroerte na ablatie gelijk aan dat van patiënten die nooit VKF hadden, en dit eveneens voor alle CHADS2-profielen.
In tegenstelling tot wat lange tijd aangenomen werd, blijkt uit recente analyse van de AVERROES- en ACTIVEA-studies dat het patroon van VKF het risico op beroerte toch beinvloedt.14 Patiënten met permanente VKF hadden namelijk een beduidend hoger risico op beroerte dan patiënten met paroxysmale VKF.14 De burden van VKF blijkt dus bij te dragen tot het risico op systemische trombo-embolie.
Deze bevindingen pleiten ervoor dat VKF niet slechts een merker, maar een mechanisme voor het ontstaan van beroerte is.
Hypothese 2: VKF is slechts een merker voor beroerte in patiënten met cardiovasculaire morbiditeit
Volgens deze stelling zou er bij patiënten met een cardiovasculaire ziekte geen sluitend verband tussen het optreden op trombo-embolie en de aan- of afwezigheid van VKF zijn. In een grote studiepopulatie van hartfalenpatiënten bleken patiënten met klassieke cardiovasculaire risicofactoren (leeftijd, NYHA-klasse, diabetes mellitus, eerdere beroerte, BNP) zonder VKF een even groot risico op beroerte te hebben als hartfalenpatiënten met VKF.15 Ook in de DANPACE en in de MOST-studiepopulatie (patiënten met sinusknoopdisfunctie en een DDD-pacemaker) was de CHA2DS2-VASc-score een onafhankelijke predictor voor het beroerterisico, ongeacht het al of niet ooit optreden van VKF.16, 17 Verder voorspelde de CHA2DS2-VASc-score het risico op (recidief) beroerte in patiënten met coronairlijden (APPROACH-registry) en in patiënten die al een beroerte doormaakten (Athens stroke-registry) zonder aan VKF te lijden.18, 19 Bijgevolg zou een studie die de benefit van anticoagulantia onderzoekt in een populatie met hoog risico op beroerte zonder aan VKF te lijden van groot klinisch belang kunnen zijn.
In de TRENDS- en de ASSERT-studie werd geen directe tijdsrelatie tussen het optreden van VKF en het optreden van beroerte aangetoond. De TRENDS-studie onderzocht de tijdsrelatie tussen het optreden van trombo-embolie en optreden van VKF in patiënten met minstens 1 cardiovasculaire risicofactor en een indicatie voor een implanteerbaar recording device. Slechts 50 % van de patiënten die een tromboembolisch event ontwikkelden, hadden voorafgaand hieraan VKF. Van deze patiënten vertoonde 45 % geen VKF-episode in de 30 dagen voorafgaand aan het tromboembolisch event. Bijgevolg had in deze studie 73 % van de patiëntenpopulatie 0 % VKF burden in de maand voorafgaand aan een trombo-embolie.20 De gelijkaardige ASSERT-studie includeerde 65-plussers met arteriële hypertensie en een pacemaker of ICD zonder voorgeschiedenis van VKF. Bij slechts 51 % van de patiënten die trombo-embolie ontwikkelde, werd VKF (> 6 min) gediagnosticeerd. Slechts bij 8%van de patiënten trad VKF op in de maand voorafgaand aan het tromboembolisch event (en slechts bij 2 % op het moment zelf).21
Deze bevindingen pleiten ervoor dat VKF slechts een risicomerker, en niet de mechanistische oorzaak voor beroerte is.
Hypothese 3: VKF is beide, namelijk risicomerker en risicofactor voor een beroerte bij patiënten met cardiovasculaire aandoeningen
Zoals hierboven besproken zijn er talrijke argumenten om VKF zowel als een risicofactor en als een risicomerker te beschouwen.
In tegenstelling tot de ASSERT- en TRENDS-studie werd in de Carelink/VA-studie wel een zeker temporele relatie tussen VKF en het optreden van beroerte aangetoond.22 Deze studie onderzocht de temporele relatie met VKF in patiënten met een pacemaker of ICD die minstens 120 dagen gemonitord werden voorafgaand aan het doormaken van een CVA. Een VKF-burden van ≥ 5,5 uur tijdens ≥ 1 dag gedurende de periode van 30 dagen voorafgaand aan hun beroerte, verhoogde het risico op beroerte met een factor x 4. Het risico op beroerte was het hoogst in de eerste 5 dagen na het optreden van VKF (risico x 17), maar nam nadien exponentieel af. Deze gegevens suggereren dat VKF mechanistisch oorzakelijk is voor beroerte die optreedt in de eerstvolgende dagen, in tegenstelling tot beroerte die later optreedt. Er kan dus aangenomen worden dat reductie van de VKF-burden het risico op CVA doet afnemen.Of VKF-ablatie ook effectief het risico op beroerte vermindert, wordt momenteel in verschillende grootschalige multicentrische gerandomiseerde studies onderzocht, maar deze resultaten kunnen nog enkele jaren op zich laten wachten.
Gezien de evidentie dat cardiovasculaire ziekte ook in de afwezigheid van VKF het trombo-emboligeen risico verhoogt, is er nood aan een nieuwe risicoscore waarin de aanwezigheid van VKF slechts 1 risicofactor vormt, naast andere klassieke cardiovasculaire risicofactoren.
Besluit
VKF is een belangrijk mechanisme van trombo-embolie, maar het is niet de enige oorzaak. Onderliggende cardiovasculaire ziekte verhoogt evenzeer het trombo-emboligeen risico in afwezigheid van VKF. Bijgevolg kunnen therapieën gericht op eliminatie van VKF gedeeltelijk het risico op CVA reduceren,maar is een meer holistische aanpak aangewezen bij patiënten met naast VKF meerdere cardiovasculaire morbiditeiten.
Referenties
- Calkins, H., Kuck, K.H., Cappato, R., Brugada, J., Camm, A.J., Chen, S.A., et al. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Hearth Rhythm, 2012, 9, 632-696.
- Di Biase, L., Burkhardt, J.D., Santangeli, P.,Mohanty, P., Sanchez, J.E., Horton, R., et al. Periprocedural stroke and bleeding complications in patients undergoing catheter ablation of atrial fibrillation with different anticoagulation management: results from the Role of Coumadin in Preventing Thromboembolism in Atrial Fibrillation (AF) Patients Undergoing Catheter Ablation (COMPARE) randomized trial. Circulation, 2014, 129, 2638-2644.
- Providência, R., Albenque, J.P., Combes, S., Bouzeman, A., Casteigt, B., Combes, N., et al. Safety and efficacy of dabigatran versus warfarin in patients undergoing catheter ablation of atrial fibrillation: a systematic review and meta-analysis. Heart, 2014, 100, 324-335.
- Bunch, T.J., Crandall, B.G., Weiss, J.P., May, H.T., Bair, T.L., Osborn, J.S., et al.Warfarin is not needed in lowrisk patients following atrial fibrillation ablation procedures. J Cardiovasc Electrophysiol, 2009, 20, 988-993.
- Duytschaever, M., Berte, B., Acena, M., De Meyer, G., Bun, S.S., Van Heuverswyn, F., et al. Catheter ablation of atrial fibrillation in patients at low thrombo- embolic risk: efficacy and safety of a simplified periprocedural anticoagulation strategy. J Cardiovasc Electrophysiol, 2013, 24, 855-860.
- Karasoy, D., Gislason, G.H., Hansen, J., Johannessen, A., Køber, L., Hvidtfeldt, M., et al. Oral anticoagulation therapy after radiofrequency ablation of atrial fibrillation and the risk of thromboembolism and serious bleeding: long-term follow-up in nationwide cohort of Denmark. Eur Heart J, 2015, 36, 307-314a.
- Noseworthy, P.A., Yao, X., Deshmukh, A.J., Van Houten, H., Sangaralingham, L.R., Siontis, K.C., et al. Patterns of Anticoagulation Use and Cardioembolic Risk After Catheter Ablation for Atrial Fibrillation. J Am Heart Assoc, 2015; 4 (11), doi: 10.1161/JAHA.115.002597.
- Reynolds, M.R., Gunnarsson, C.L., Hunter, T.D., Ladapo, J.A., March, J.L., Zhang, M., Hao, S.C. Health outcomes with catheter ablation or antiarrhythmic drug therapy in atrial fibrillation: results of a propensity-matched analysis. Circ Cardiovasc Qual Outcomes, 2012, 5, 171-181.
- Hunter, R.J.,McCready, J., Diab, I., Page, S.P., Finlay,M., Richmond, L., et al.Maintenance of sinus rhythmwith an ablation strategy in patientswith atrial fibrillation is associated with a lower risk of stroke and death. Heart, 2012, 98, 48-53.
- Themistoclakis, S., Corrado, A., Marchlinski, F.E., Jais, P., Zado, E., Rossillo, A., et al. The risk of thromboembolism and need for oral anticoagulation after successful atrial fibrillation ablation. J Am Coll Cardiol, 2010, 55, 735-743.
- Tsadok,M.A., Jackevicius, C.A., Essebag, V., Eisenberg, M.J., Rahme, E., Humphries, K.H., et al. Rhythm versus rate control therapy and subsequent stroke or transient ischemic attack in patients with atrial fibrillation. Circulation, 2012, 126, 2680-2687.
- Connolly, S.J., Crijns, H.J., Torp-Pedersen, C., van Eickels, M., Gaudin, C., Page, R.L., et al. Analysis of stroke in ATHENA: a placebo-controlled, double-blind, parallel- arm trial to assess the efficacy of dronedarone 400 mg BID for the prevention of cardiovascular hospitalization or death from any cause in patients with atrial fibrillation/atrial flutter. Circulation, 2009, 120, 1174-1180.
- Bunch, T.J., May, H.T., Bair, T.L., Weiss, J.P., Crandall, B.G., Osborn, J.S., et al. Atrial fibrillation ablation patients have long-term stroke rates similar to patients without atrial fibrillation regardless of CHADS2 score. Heart Rhythm, 2013, 10, 1272-1277.
- Vanassche, T., Lauw,M.N., Eikelboom, J.W., Healey, J.S., Hart, R.G., Alings, M., et al. Risk of ischaemic stroke according to patten of atrial fibrillation: analysis of 6563 aspirin-treated patients in ACTIVE-A and AVERROES. Eur Heart J, 2015, 36, 281-287a.
- Abdul-Rahim, A.H., Perez, A.C., Fulton, R.L., Jhund, P.S., Latini, R., Tognoni, G. Risk of Stroke in Chronic Heart Failure Patients Without Atrial Fibrillation: Analysis of the Controlled Rosuvastatin in Multinational Trial Heart Failure (CORONA) and the Gruppo Italiano per lo Studio della Sopravvivenza nell'Insufficienza Cardiaca-Heart Failure (GISSI-HF) Trials. Circulation, 2015, 131, 1486-1494
- Svendsen, J.H., Nielsen, J.C., Darkner, S., Jensen, G.V., Mortensen, L.S., Andersen, H.R. CHADS2 and CHA2DS2- VASc score to assess risk of stroke and death in patients paced for sick sinus syndrome. Heart, 2013, 99, 843-848.
- Glotzer, T.V., Hellkamp, A.S., Lee, K.L. Lamas, G.A. CHA2DS2-VAS(C) and CHADS2 Scores Predict Adverse Clinical Events in PatientsWith Pacemakers and Sinus Node Dysfunction Independent of Atrial Fibrillation. Can J Cardiol, 2015, 131, 1004-1011.
- Mitchell, L.B., Southern, D.A., Galbraith, D., Ghali, W.A., Knudtson, M., Wilton, S.B. Prediction of stroke or TIA in patients without atrial fibrillation using CHADS2 and CHA2DS2-VASc scores. Heart, 2014, 100, 1524-1530.
- Ntaios, G., Lip, G.Y.H.,Makaritsis, K., Papavasileiou, V., Vemmou, A., Koroboki, E. CHADS2, CHA2S2DS2-VASc, and long-term stroke outcome in patients without atrial fibrillation. Neurology, 2013, 80, 1009-1017.
- Daoud, E.G., Glotzer, T.V.,Wyse, D.G., Ezekowitz,M.D., Hilker, C., Koehler, J. Temporal relationship of atrial tachyarrhythmias, cerebrovascular events, and systemic emboli based on stored device data: a subgroup analysis of TRENDS. Heart Rhythm, 2011, 8, 1416-1423.
- Healey, J.S., Connolly, S.J., Gold, M.R., Israel, C.W., Van Gelder, I.C., Capucci, A., et al. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med, 2012, 366, 120-129
- Singer, D., Ziegler, P., Schmitt, S., Chang, Y., Fan, J., Claire, T.T., et al. Paroxysmal atrial fibrillation poses a large but transient increase in ischemic stroke risk: a case-crossover study. J Am Coll Cardiol, 2015, 65, 10_S.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.