Cette année, lors de la session du groupe de travail de la Belgian Heart Rhythm Association (BeHRA) organisée pendant le congrès de la Société Belge de Cardiologie, l'accent a été mis sur la fibrillation auriculaire (FA) et le risque d'accidents vasculaires cérébraux (AVC). Lors de la première partie, le Prof. Mattias Duytschaever de l'AZ Sint-Jan de Bruges a traité plus en détail de la stratégie d'anticoagulation pendant et après une procédure d'ablation. Par la suite, le Prof. Dr John Camm, St.-George's University et Imperial College of London, a analysé si la FA doit être conidéré comme un simple facteur de risque ou au contraire comme un marqueur de risque pour les AVC?
1. Prévention des AVC pendant et après l'ablation d'une fibrillation auriculaire
Anticoagulation périprocédurale
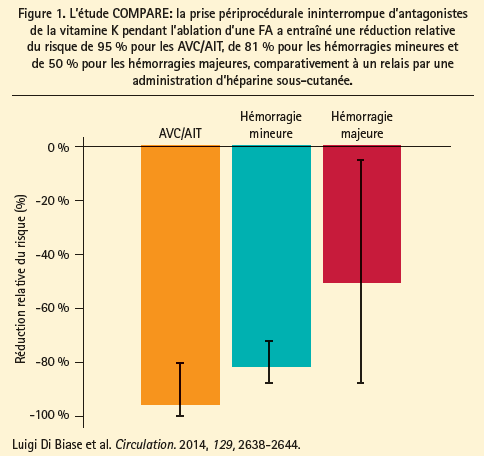
L'incidence périprocédurale d'AVC ou d'AIT lors d'une ablation de FA s'élève à 0,5-1 %, en fonction du score CHADS2. Pour la prévention optimale des AVC, les recommandations préconisent un traitement par anticoagulants oraux, dont la prise doit débuter 1 mois avant la procédure d'ablation, et se poursuivre au moins 2 mois après celle-ci, et ce, quel que soit le score CHADS2.1 Chez les patients traités par antagonistes de la vitamine K, il est recommandé de ne pas les interrompre avant la procédure d'ablation (INR 2-3), étant donné que l'étudeCOMPARE a clairement démontré que la prise périprocédurale ininterrompue d'antagonistes de la vitamine K était supérieure à un relais par héparine sous-cutanée.2 La poursuite des antagonistes de la vitamineKétait associée à une réduction significative des AVC et des hémorragies mineures (figure 1). On n'a pas encore examiné, au moyen d'études randomisées contrôlées, s'il est également indiqué de poursuivre un traitement par NOAC sans interruption. Les méta-analyses indiquent bien que la prise ininterrompue de NOAC est aussi efficace que celle des antagonistes de la vitamine K, mais le moment optimal de la dernière prise est encore indéterminé.3 Dès lors, dans l'attente des résultats d'études prospectives, il est recommandé que chaque centre établisse son propre protocole en ce qui concerne les procédures d'ablation de FA sous NOAC. Deux petites études ont rapporté l'absence d'AVC chez des patients courant un risque thrombo-emboligène faible (score CHADS2 0-1), qui n'étaient traités que par aspirine après la procédure4,5 mais, selon les recommandations, un traitement postprocédural par anticoagulants oraux pendant 2 mois est également la règle chez ces patients.
Anticoagulation après une ablation fructueuse de FA
On se demande souvent si les anticoagulants peuvent être arrêtés après une procédure d'ablation fructueuse. En pratique quotidienne, il s'avère que 30-60 % des patients à haut risque ont arrêté la prise d'antagonistes de la vitamine K 1 an après l'ablation.6, 7 Toutefois, certains éléments indiquent que la FA est non seulement une cause directe d'AVC, mais aussi un marqueur de risque accru d'AVC. En outre, une récidive de FA peut être asymptomatique et passer inaperçue, et des récidives tardives de FA sont possibles. D'autre part, les études portant sur les dispositifs (devices) nous ont appris que le fardeau de la FA est corrélé avec le risque d'AVC et qu'une procédure d'ablation supprime la FA, ou du moins qu'elle en réduit le fardeau. On dispose déjà de données cliniques limitées, non randomisées, indiquant que l'ablation - indépendamment de la poursuite de la warfarine - réduit le risque d'AVC, et que le succès de l'ablation est un facteur prédictif indépendant du risque d'AVC, en plus de l'âge et du score CHA2DS2-VASc.8, 9 Par ailleurs, des données limitées indiquent que, si on arrête les anticoagulants après l'ablation, chez des patients courant un faible risque (scores CHADS2 de 1 et 2), l'incidence d'AVC est très faible, et qu'elle est le plus souvent liée à une récidive de la FA.10 Toutefois, tant qu'on n'a pas encore évalué dans de plus grandes études randomisées contrôlées si les anticoagulants peuvent être arrêtés en toute sécurité après une procédure d'ablation fructueuse, les recommandations affirment à juste titre que les anticoagulants doivent être poursuivis, indépendamment du succès de l'ablation, chez tous les patients ayant un score CHA2DS2-VASc ≥ 2,1.
2 La fibrillation auriculaire: facteur de risque ou marqueur de risque?
Il est bien connu que les patients souffrant de FA courent un risque accru d'AVC. Le tout est de savoir s'il existe véritablement un lien causal entre la FA et les AVC, ou si la FA constitue seulement la manifestation d'un risque accru d'AVC suite à une maladie cardiovasculaire. En d'autres termes: la survenue permanente d'une FA fait-elle une réelle différence thérapeutique sur le plan de la prévention des AVC chez les patients courant un risque cardiovasculaire élevé, et ayant des antécédents de FA? Le Professeur John Camm, St.-George's University et Imperial College of London, a étayé trois hypothèses à l'aide des données connues de la littérature.
Hypothèse 1: la FA est le principal mécanisme pour la formation de thrombo-embolies
Si la FA était un mécanisme critique pour la formation de caillots de sang, les thrombo-embolies et les AVC ne se produiraient que si la FA est simultanée ou récente. Le risque d'AVC serait alors lié au fardeau de la FA et la prophylaxie des thromboses deviendrait dès lors obsolète, dès la disparition totale de la FA.
Quelques études observationnelles ont montré que le traitement de la FA visant le contrôle du rythme entraînait unemortalité moindre et une incidence moindre d'AVC, comparativement à une stratégie basée sur le contrôle de la fréquence cardiaque.11 On dispose de données tant au sujet d'une stratégie médicamenteuse de contrôle du rythme que d'une stratégie interventionnelle. Dans l'étude ATHENA, l'ajout de dronédarone au traitement standard par agents visant à contrôler la fréquence cardiaque et par anticoagulants entraînait une réduction relative du risque de 34 % de la survenue d'AVC.12 Bunch et al. ont comparé le risque d'AVC entre des patients ayant subi une ablation de FA, des patients souffrant de FA traitée de manière conservatrice et des patients indemnes de FA.13 Pour tous les profils CHADS2, le risque d'AVC était moindre chez les patients traités par ablation que dans le groupe de patients ayant bénéficié d'un traitement conservateur (figure 2). En outre, dans cette étude, le risque d'AVC après l'ablation était identique à celui enregistré chez les patients n'ayant jamais souffert de FA, et ce, également pour tous les profils CHADS2.

Contrairement à ce qu'on a longtemps admis, il ressort d'une analyse récente des études AVERROES et ACTIVE-A que le type de FA influence malgré tout le risque d'AVC.14 Les patients souffrant de FA permanente couraient en l'occurrence un risque considérablement plus élevé d'AVC que les patients souffrant de FA paroxystique.14 Le fardeau de la FA contribue dès lors au risque de thrombo- embolies systémiques.
Ces observations plaident en faveur du fait que la FA n'est pas seulement un marqueur, mais aussi un mécanisme pour la survenue d'un AVC.
Hypothèse 2: la FA n'est un marqueur d'AVC que chez les patients présentant une comorbidité cardiovasculaire
D'après cette hypothèse, il n'existerait pas de relation convaincante entre la survenue de thrombo-embolies et la présence - ou l'absence - de FA chez les patients souffrant de maladies cardiovasculaires. Dans une vaste population d'étude impliquant des patients souffrant d'insuffisance cardiaque, il est apparu que les patients présentant les facteurs de risque cardiovasculaire classiques (âge, classe NYHA, diabète, antécédent d'AVC, BNP), indemnes de FA, couraient un risque d'AVC aussi important que les patients souffrant d'insuffisance cardiaque et de FA.15 Dans les populations des études DANPACE et MOST (patients souffrant d'une dysfonction du noeud sinusal, porteurs d'un pacemaker DDD), le score CHA2DS2-VASc était un élément prédictif indépendant du risque d'AVC, et ce, indépendamment de tout antécédent - ou non - de FA.16, 17 Par ailleurs, le score CHA2DS2-VASc prédisait le risque (de récidive) d'AVC chez les patients souffrant de maladies coronariennes (registre APPROACH) et chez les patients ayant déjà souffert d'un AVC (registre Athens stroke), mais indemnes de FA.18, 19 Par conséquent, une étude évaluant le bénéfice des anticoagulants dans une population courant un risque élevé d'AVC, indemne de FA, pourrait avoir une grande importance clinique.
Dans les études TRENDS et ASSERT, on n'a pas démontré de relation temporelle directe entre la survenue d'une FA et celle d'un AVC. L'étude TRENDS a examiné la relation temporelle entre la survenue de thrombo-embolies et l'apparition de FA chez des patients présentant au moins 1 facteur de risque cardiovasculaire et ayant une indication de moniteur cardiaque implantable. Seuls 50 % des patients ayant développé un événement thrombo-embolique souffraient préalablement de FA. Parmi ces patients, 45% n'avaient pas présenté d'épisode de FA au cours des 30 jours précédant l'événement thrombo-embolique. Par conséquent, dans cette étude, 73 % de la population de patients avaient un fardeau de FA égal à 0 % au cours du mois précédant une thrombo-embolie.20 L'étude ASSERT, comparable, a inclus des sujets de plus de 65 ans, souffrant d'hypertension artérielle, porteurs d'un pacemaker ou d'un DCI, n'ayant pas d'antécédents de FA. On n'a diagnostiqué une FA (> 6 min) que chez 51 % des patients ayant développé une thrombo-embolie. La FA n'est survenue au cours du mois précédant l'événement thrombo-embolique que chez 8 % des patients (et chez seulement 2 % au moment même).21
Ces observations plaident en faveur du fait que la FA ne constitue qu'un marqueur de risque, et qu'elle n'est pas la cause mécanistique d'un AVC.
Hypothèse 3: la FA constitue à la fois un marqueur de risque et un facteur de risque pour un AVC chez les patients souffrant de maladies cardiovasculaires
Comme nous l'avons analysé ci-dessus, il existe de nombreux arguments pour considérer la FA à la fois comme un facteur de risque et comme unmarqueur de risque.
Contrairement aux études ASSERT et TRENDS, l'étude Carelink/VA a pu démontrer une certaine relation temporelle entre la FA et la survenue d'un AVC.22 Cette étude a examiné la relation temporelle avec la FA, chez des patients porteurs d'un pacemaker ou d'un DCI, qui avaient été suivis pendant au moins 120 jours avant la survenue de leur AVC. Un fardeau de FA ≥ 5,5 heures pendant ≥ 1 jour, au cours des 30 jours précédant l'AVC augmentait le risque d'AVC d'un facteur 4. Le risque d'AVC étaitmaximal au cours des 5 premiers jours suivant l'apparition de la FA (risque x 17), mais il diminuait exponentiellement par la suite. Ces données suggèrent que la FA est mécanistiquement la cause des AVC qui se produisent au cours des jours suivants, et ce, contrairement aux AVC qui se produisent plus tardivement. On peut donc admettre que la réduction du fardeau de la FA diminue le risque d'AVC. Quant à savoir si l'ablation de FA diminue également effectivement le risque d'AVC, ce point est actuellement examiné dans plusieurs vastes études multicentriques randomisées, mais les résultats ne seront sans doute pas disponibles avant quelques années.
étant donné les preuves indiquant que les maladies cardiovasculaires augmentent le risque thrombo-emboligène, même en l'absence de FA, il est nécessaire de disposer d'un nouveau score de risque dans lequel la présence de FA ne constituerait qu'un facteur de risque, à côté des autres facteurs de risque cardiovasculaire classiques.
Conclusion
La FA constitue un important mécanisme d'apparition de thrombo-embolies, mais elle n'est assurément pas la seule cause. Une maladie cardiovasculaire sous-jacente augmente tout autant le risque thrombo-emboligène en l'absence de FA. Par conséquent, les traitements ciblés sur l'élimination de la FA peuvent partiellement réduire le risque d'AVC, mais une approche plus holistique est indiquée chez les patients présentant plusieurs comorbidités cardiovasculaires, en plus de la FA.
Références
- Calkins, H., Kuck, K.H., Cappato, R., Brugada, J., Camm, A.J., Chen, S.A., et al. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Hearth Rhythm, 2012, 9, 632-696.
- Di Biase, L., Burkhardt, J.D., Santangeli, P.,Mohanty, P., Sanchez, J.E., Horton, R., et al. Periprocedural stroke and bleeding complications in patients undergoing catheter ablation of atrial fibrillation with different anticoagulation management: results from the Role of Coumadin in Preventing Thromboembolism in Atrial Fibrillation (AF) Patients Undergoing Catheter Ablation (COMPARE) randomized trial. Circulation, 2014, 129, 2638-2644.
- Providência, R., Albenque, J.P., Combes, S., Bouzeman, A., Casteigt, B., Combes, N., et al. Safety and efficacy of dabigatran versus warfarin in patients undergoing catheter ablation of atrial fibrillation: a systematic review and meta-analysis. Heart, 2014, 100, 324-335.
- Bunch, T.J., Crandall, B.G., Weiss, J.P., May, H.T., Bair, T.L., Osborn, J.S., et al.Warfarin is not needed in lowrisk patients following atrial fibrillation ablation procedures. J Cardiovasc Electrophysiol, 2009, 20, 988-993.
- Duytschaever, M., Berte, B., Acena, M., De Meyer, G., Bun, S.S., Van Heuverswyn, F., et al. Catheter ablation of atrial fibrillation in patients at low thrombo- embolic risk: efficacy and safety of a simplified periprocedural anticoagulation strategy. J Cardiovasc Electrophysiol, 2013, 24, 855-860.
- Karasoy, D., Gislason, G.H., Hansen, J., Johannessen, A., Køber, L., Hvidtfeldt, M., et al. Oral anticoagulation therapy after radiofrequency ablation of atrial fibrillation and the risk of thromboembolism and serious bleeding: long-term follow-up in nationwide cohort of Denmark. Eur Heart J, 2015, 36, 307-314a.
- Noseworthy, P.A., Yao, X., Deshmukh, A.J., Van Houten, H., Sangaralingham, L.R., Siontis, K.C., et al. Patterns of Anticoagulation Use and Cardioembolic Risk After Catheter Ablation for Atrial Fibrillation. J Am Heart Assoc, 2015; 4 (11), doi: 10.1161/JAHA.115.002597.
- Reynolds, M.R., Gunnarsson, C.L., Hunter, T.D., Ladapo, J.A., March, J.L., Zhang, M., Hao, S.C. Health outcomes with catheter ablation or antiarrhythmic drug therapy in atrial fibrillation: results of a propensity-matched analysis. Circ Cardiovasc Qual Outcomes, 2012, 5, 171-181.
- Hunter, R.J.,McCready, J., Diab, I., Page, S.P., Finlay,M., Richmond, L., et al.Maintenance of sinus rhythmwith an ablation strategy in patientswith atrial fibrillation is associated with a lower risk of stroke and death. Heart, 2012, 98, 48-53.
- Themistoclakis, S., Corrado, A., Marchlinski, F.E., Jais, P., Zado, E., Rossillo, A., et al. The risk of thromboembolism and need for oral anticoagulation after successful atrial fibrillation ablation. J Am Coll Cardiol, 2010, 55, 735-743.
- Tsadok,M.A., Jackevicius, C.A., Essebag, V., Eisenberg, M.J., Rahme, E., Humphries, K.H., et al. Rhythm versus rate control therapy and subsequent stroke or transient ischemic attack in patients with atrial fibrillation. Circulation, 2012, 126, 2680-2687.
- Connolly, S.J., Crijns, H.J., Torp-Pedersen, C., van Eickels, M., Gaudin, C., Page, R.L., et al. Analysis of stroke in ATHENA: a placebo-controlled, double-blind, parallel- arm trial to assess the efficacy of dronedarone 400 mg BID for the prevention of cardiovascular hospitalization or death from any cause in patients with atrial fibrillation/atrial flutter. Circulation, 2009, 120, 1174-1180.
- Bunch, T.J., May, H.T., Bair, T.L., Weiss, J.P., Crandall, B.G., Osborn, J.S., et al. Atrial fibrillation ablation patients have long-term stroke rates similar to patients without atrial fibrillation regardless of CHADS2 score. Heart Rhythm, 2013, 10, 1272-1277.
- Vanassche, T., Lauw,M.N., Eikelboom, J.W., Healey, J.S., Hart, R.G., Alings, M., et al. Risk of ischaemic stroke according to patten of atrial fibrillation: analysis of 6563 aspirin-treated patients in ACTIVE-A and AVERROES. Eur Heart J, 2015, 36, 281-287a.
- Abdul-Rahim, A.H., Perez, A.C., Fulton, R.L., Jhund, P.S., Latini, R., Tognoni, G. Risk of Stroke in Chronic Heart Failure Patients Without Atrial Fibrillation: Analysis of the Controlled Rosuvastatin in Multinational Trial Heart Failure (CORONA) and the Gruppo Italiano per lo Studio della Sopravvivenza nell'Insufficienza Cardiaca-Heart Failure (GISSI-HF) Trials. Circulation, 2015, 131, 1486-1494
- Svendsen, J.H., Nielsen, J.C., Darkner, S., Jensen, G.V., Mortensen, L.S., Andersen, H.R. CHADS2 and CHA2DS2- VASc score to assess risk of stroke and death in patients paced for sick sinus syndrome. Heart, 2013, 99, 843-848.
- Glotzer, T.V., Hellkamp, A.S., Lee, K.L. Lamas, G.A. CHA2DS2-VAS(C) and CHADS2 Scores Predict Adverse Clinical Events in PatientsWith Pacemakers and Sinus Node Dysfunction Independent of Atrial Fibrillation. Can J Cardiol, 2015, 131, 1004-1011.
- Mitchell, L.B., Southern, D.A., Galbraith, D., Ghali, W.A., Knudtson, M., Wilton, S.B. Prediction of stroke or TIA in patients without atrial fibrillation using CHADS2 and CHA2DS2-VASc scores. Heart, 2014, 100, 1524-1530.
- Ntaios, G., Lip, G.Y.H.,Makaritsis, K., Papavasileiou, V., Vemmou, A., Koroboki, E. CHADS2, CHA2S2DS2-VASc, and long-term stroke outcome in patients without atrial fibrillation. Neurology, 2013, 80, 1009-1017.
- Daoud, E.G., Glotzer, T.V.,Wyse, D.G., Ezekowitz,M.D., Hilker, C., Koehler, J. Temporal relationship of atrial tachyarrhythmias, cerebrovascular events, and systemic emboli based on stored device data: a subgroup analysis of TRENDS. Heart Rhythm, 2011, 8, 1416-1423.
- Healey, J.S., Connolly, S.J., Gold, M.R., Israel, C.W., Van Gelder, I.C., Capucci, A., et al. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med, 2012, 366, 120-129
- Singer, D., Ziegler, P., Schmitt, S., Chang, Y., Fan, J., Claire, T.T., et al. Paroxysmal atrial fibrillation poses a large but transient increase in ischemic stroke risk: a case-crossover study. J Am Coll Cardiol, 2015, 65, 10_S.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.