Op de 10de Belgian Heart Rhythm Meeting gaven prof. dr. Sébastien Knecht (AZ Sint-Jan Brugge) en prof. dr. Mark O'Neill (St. Thomas' Hospital and King's College Londen) een state-of-the-artlezing over de behandeling van persistente atriale fibrillatie (AF).
Huidige behandelingsmodaliteiten voor persistente AF
Preventie en behandeling van cardiale risicofactoren
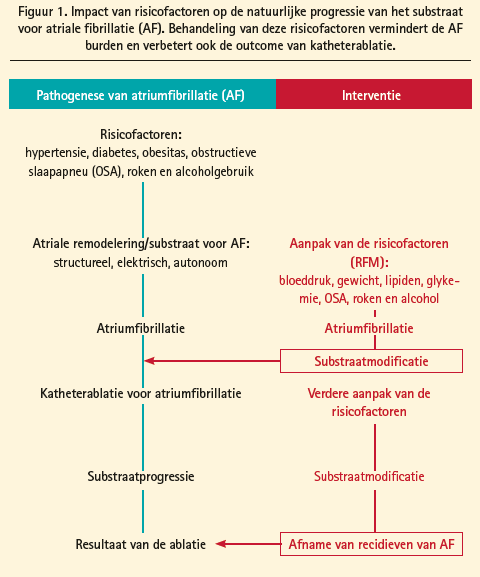
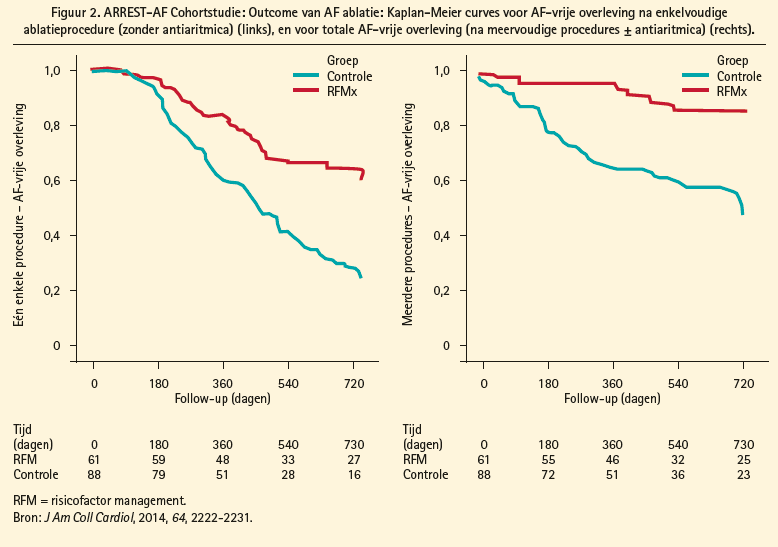
De therapeutische aanpak van persistente AF begint met de behandeling van geassocieerde aandoeningen en risicofactoren die atriale remodelering veroorzaken, zoals slaapapnoesyndroom, pulmonale arteriële hypertensie, systemische arteriële hypertensie, veroudering, obesitas en condities gepaard met atriale dilatatie. Het behandelen van deze risicofactoren leidt niet alleen tot gunstige substraatmodificatie en een verminderde AF burden, maar verbetert ook de outcome van katheterablatie (figuur 1). In de ARREST-AF- Cohortstudie ondergingen 149 patiënten met obesitas (BMI ≥ 27 kg/m2) en een bijkomende cardiale risicofactor katheterablatie voor AF.1 61 van deze patiënten ondergingen nadien behandeling van deze risicofactoren, wat leidde tot een significante daling van het lichaamsgewicht en een betere controle van de bloeddruk en van het glykemieen lipidenprofiel ten opzichte van de controlegroep die alleen een ablatieprocedure zonder lifestylemodificatie onderging. Een ingrijpende aanpak van deze risicofactoren leidde tot een hogere aritmievrije overleving, zowel na een enkelvoudige ablatieprocedure, als na meerdere ingrepen (figuur 2), met eveneens minder nood tot het herstarten van antiaritmica (bij 16 % tegenover 42 % van de patiënten met en zonder risicofactormanagement respectievelijk). Het belang van gewichtsreductie bij obesitas in de behandeling van AF werd nogmaals aangetoond in de LEGACY-studie.2 In deze cohortstudie met langetermijnopvolging ondergingen 355 patiënten met AF en obesitas (BMI ≥ 27 kg/m2) gewichtsreductie door lifestylemodificatie. Dit resulteerde in een duidelijke toename in aritmievrije overleving, zowel met als zonder specifieke antiaritmische behandeling (medicatie of ablatie) (figuur 3). Hoe meer uitgesproken de gewichtsreductie, hoe beter het resultaat. Zo was het risico op aritmievrije overleving 6 x hoger bij een gewichtsverlies met ≥ 10 % ten opzichte van een meer gematigd gewichtsverlies. Bij gewichtsverlies met fluctuaties van > 5 % werd dit effect gedeeltelijk tenietgedaan.

Katheterablatie
Ook in de ESC-richtlijnen van 2016 voor de behandeling van AF geldt er een klasse IIA-aanbeveling om ablatie te verrichten bij symptomatische persistente en longstanding persistente AF die refractair aan antiaritmische medicatie is. Hierbij moet rekening gehouden worden met het individueel te verwachten succes en risico van de ingreep, alsook met de patiëntkeuze.3
Selectie van de beste responder en timing voor ablatie
Wat de patiëntenselectie voor succesvolle katheterablatie van persistente AF betreft, zijn er enkele eenvoudige predictoren voor de outcome. De linkeratriumdiameter is een dominante predictor, niet alleen omdat belangrijke dilatatie wijst op significante aantasting van het substraat met fibrosevorming, maar ook omdat dit de kathetermanipulatie en stabiliteit tijdens de procedure negatief beïnvloedt. Een tweede belangrijke predictor is de cycluslengte van de AF, die de complexiteit van het substraat reflecteert. Deze cycluslengte kan door middel van het oppervlakte-ecg aan de hand van de fibrillatiegolven gemeten worden. Een AF-cycluslengte < 140 ms is indicatief voor een slechtere outcome. Ook de afwezigheid van fibrillatiegolven op het oppervlakte-ecg wijst op extensieve fibrose en is een sterke merker voor een negatieve prognose. Een derde onafhankelijke predictor voor AF-herval is de duur van continu AF-ritme. Een lange continue AF-duur leidt immers tot structurele remodelering op cellulair en weefselniveau. Matsuo et al. rapporteerden een beduidend hoger risico op AF-herval na ablatie als de continue AF-duur meer dan 21 maanden bedroeg;4 andere studies toonden al een verhoogd hervalrisico bij een continue AF-duur langer dan 6 maanden.5 Bijgevolg is het belangrijk om langdurig persistente AF te vermijden en een symptomatische patiënt tijdig voor ablatie te verwijzen. Bij AF van ongekende duur kan herstel van sinusritme door elektrische cardioversie en antiaritmica (amiodaron) tot omgekeerde remodelering leiden met opnieuw afname van de linkeratriumdiameter en eventuele verlenging van de AFcycluslengte, en zo het succes van een electieve ablatie enkele maanden later vergroten. Bovendien laat het herstel van sinusritme toe het verschil in symptomatologie ten opzichte van het continue AFritme van ervoor te beoordelen. Vanwege de slechtere prognose valt bij een asymptomatische patiënt met herval van AF al kort na cardioversie ratecontrole te overwegen (zeker in combinatie met overige negatieve prognostische factoren).
Andere klinische factoren geassocieerd met een slechtere outcome van katheterablatie van persistente AF zijn diabetes, COPD, nierinsufficiëntie, congestief hartfalen, hypertrofe cardiomyopathie en mitralisklepstenose. Ook patiënten met primaire persistente AF hebben een slechtere prognose dan patiënten met persistente AF die geëvolueerd is vanuit paroxismale AF.6 Deze primaire persistente AF vormt een aparte entiteit met diffuse biatriale aantasting en reentrydrivers die voornamelijk buiten de longvenen gelegen zijn.7
Ook tijdens de ablatieprocedure zelf worden predictoren voor het risico op herval onderzocht, zoals de invasief gemeten AF-cycluslengte, de kwantificatie van atriale fibrose aan de hand van voltagemapping en het al dan niet verkrijgen van AFterminatie door middel van ablatie. Deze bevindingen worden mee in beschouwing genomen als een bijkomende ablatieprocedure overwogen moet worden. Vaak vormt een recidive onder de vorm van atriale tachycardie een tussenstap naar een succesvol behoud van sinusritme en dat wettigt bijna altijd een bijkomende ablatieprocedure.
Empirische substraatablatie
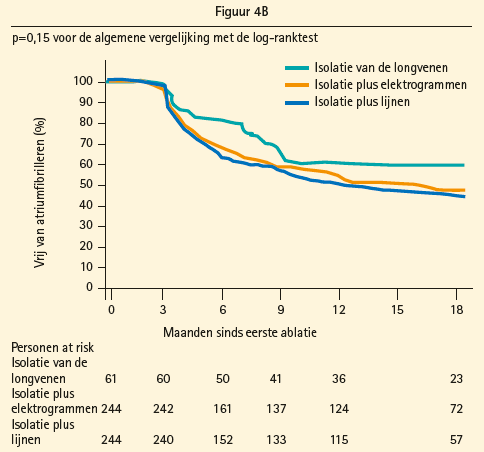
Het succes van katheterablatie voor paroxismale AF onder vorm van pulmonalevene- isolatie (PVI) is intussen stellig aangetoond, maar voor persistente AF wordt hiermee niet hetzelfde resultaat bereikt.8 Aangezien het atriale substraat voor paroxismale en persistente AF verschilt, werden de voorbije tien jaar verscheidene andere adjuvante ablatiestrategieën, gericht op de modificatie van dit atriale substraat, onderzocht: 1) lineaire laesies, naar analogie met de chirurgische cox-mazeprocedure; 2) ablatie van complexe gefractioneerde atriale elektrogrammen (CFAE), die correleren met zones van geleidingsvertraging en pivotpunten van re-entrygolven; 3) de stepwise approach, die PVI, CFAE-ablatie en lineaire laesies sequentieel toepast met als procedureel eindpunt het bereiken van AF-terminatie; 4) BOX-isolatie van de posteriorwand van het linkeratrium; en 5) ablatie van niet-pulmonalevenetriggers. Het gemiddelde succespercentage van deze verschillende technieken bedraagt voor long-standing persistente AF slechts 47 % na een enkele procedure na een gemiddelde follow-up van 14 ± 8 maanden, dit zonder inname van antiaritmica. 9 Met bijkomende procedures en in combinatie met antiaritmica stijgt het succesresultaat naar respectievelijk 65 en 79 %.9 Echter, in 2015 rapporteerde de STAR AF II-studie, een grote multicentrische gerandomiseerde gecontroleerde studie, dat noch de toevoeging van atriale lijnen, noch van CFAE-ablatie bij een index-ablatieprocedure aanleiding gaf tot een bijkomende reductie van herval van AF t.o.v. alleen PVI (figuur 4A en B),10 waardoor de zoektocht naar meer doelgerichte en selectieve substraatablatie continueert.

Substraatgerichte selectieve ablatie: atriale fibrose
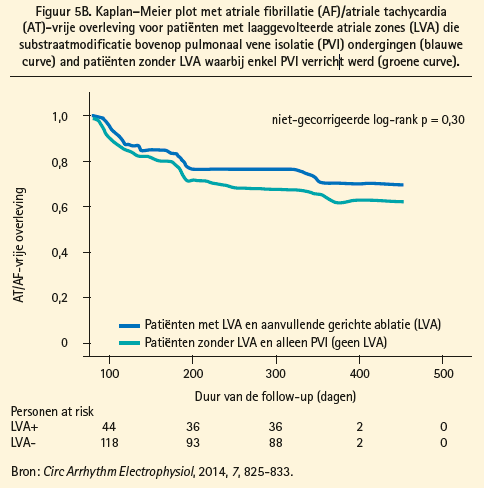
Nieuwere, geïndividualiseerde technieken voor selectieve atriale substraatmodificatie op basis van atriale fibrose werden in verschillende recente studies onderzocht: Rolf et al. rapporteerden een lager succespercentage van PVI voor AF als lagevoltagezones in het linker atrium (wijzend op fibrose) aangetoond werden. Door middel van selectieve modificatie van deze lagevoltagezones, bovenop PVI, kon de aritmievrije overleving van deze patiënten verbeterd worden (figuur 5A).11 In de afwezigheid van lagevoltagezones (atriale fibrose) lijkt PVI als ablatiestrategie voldoende (figuur 5B). Yamaguchi et al. rapporteerden dezelfde bevindingen, specifiek in een populatie met persistente AF;12 en Jadidi et al. rapporteerden een betere outcome bij toevoeging van selectieve substraatablatie van signalen met ofwel continue fractionatie ofwel een lokale kortere cycluslengte gelegen in lagevoltagezones, bovenop PVI.13 Zoals eerder gesteld is het behoud van sinusritme na elektrische cardioversie een prognostisch gunstige merker. Dit werd ondersteund in de studie van Jadidi et al. waar patiënten die voorafgaand aan ablatie sinusritme behielden gedurende 10 weken na cardioversie slechts weinig lagevoltagezones vertoonden, en een hoge aritmievrije overleving hadden met alleen PVI.13

Mechanismegerichte selectieve ablatie: drivers
Een andere selectieve ablatiestrategie richt zich op de lokalisatie van individuele driverregio's die persistente AF mechanistisch zouden onderhouden. Momenteel zijn 2 innovatieve mappingtechnieken ter beschikking: 1) een multielektrodenvest die lichaamsoppervlaktepotentialen integreert met anatomische data verkregen via een CT-scan (Ecvue, Medtronic) en 2) een biatriale multi-elektrodenbasketkatheter die elektrogrammen van het biatriale endocardium registreert, die nadien verwerkt worden met een phase mapping-algoritme (RhythmView, Abbott). Haïssaguerre et al. rapporteerden met het Ecvue-systeem aanwezigheid van onstabiele rotors in een beperkt aantal segmenten tijdens de eerste maanden van persistente AF. Ablatie van enkel deze drivers resulteerde in AF-terminatie bij 75 % van de persistente AF-patiënten, maar slechts bij 15 % in geval van long-standing persistente AF. Van de patiënten waarbij AF-terminatie verkregen werd, was 85 % na 1 jaar nog altijd in sinusritme. Van de volledige studiepopulatie bedroeg het percentage in sinusritme na 1 jaar 64 %.14
Narayan et al. rapporteerden met het RhythmView-systeem een hoge prevalentie van een klein aantal stabiele rotors15 (dus met verschillende elektrofysiologische eigenschappen van de transiënte rotors beschreven door Haïssaguerre). Met ablatie van deze drivers (Focal Impulse and Rotor Modulation, FIRM) bovenop conventionele ablatie rapporteerden Narayan et al. in de CONFIRM-studie beloftevolle resultaten: 56 % AF-terminatie tijdens ablatie15 en behoud van sinusritme bij 77,8 % van de patiënten in de FIRM-groep na een follow-up van 29 maanden, tegenover bij slechts 38,5 % van de patiënten die conventionele ablatie ondergingen.16 Kritiek wordt echter geuit op het weinig transparante phase mapping-algoritme waarmee de atriale elektrogrammen bij de FIRM-techniek worden verwerkt. Benharash et al. rapporteerden niet alleen slechtere procedurele resultaten met slechts AF-terminatie bij 4 % van de patiënten (tegenover 56 % in de CONFIRM-studie), maar kwantitatieve analyse van de atriale elektrogrammen ter hoogte van de rotorsites, geïdentificeerd door het RhythmView-systeem, verschilden niet van overige atriale locaties en toonden in 23/24 patiënten geen rotationele activiteit.17 Verder is er grote discrepantie tussen FIRM-geïdentificeerde rotorlokalisaties en lagevoltageregio's.18 Ook de klinische resultaten van FIRM-guided ablatie werden door latere studies tegengesproken, 19 waardoor het wachten is op verdere confirmatiestudies alvorens de echte waarde van rotormapping kan ingeschat worden.
Besluit: stapsgewijze ablatiestrategie voor persistente AF
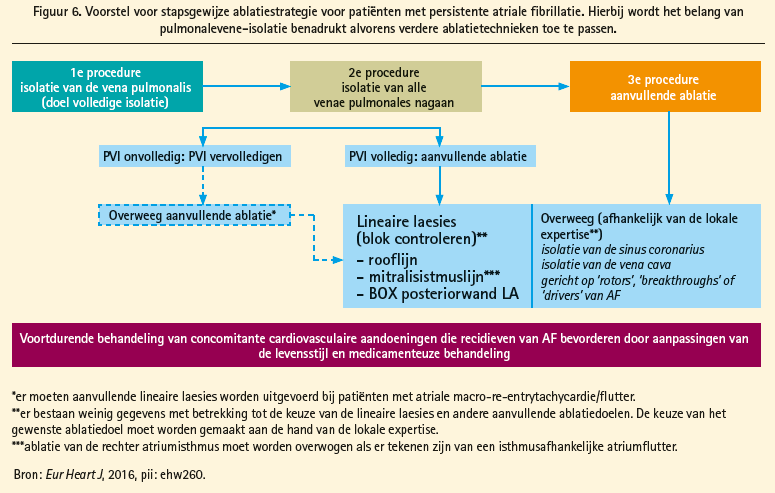
Op basis van de huidige gegevens stelden Paulus Kirchhof en Hugh Calkins in een recent reviewartikel een stapsgewijze ablatiestrategie voor de katheterablatie van persistente AF voor (figuur 6).20 Hierbij wordt het belang van duurzame isolatie van de longvenen benadrukt, alsook de implementatie van lifestylemodificatie. Voor een eerste procedure wordt PVI als 'stand alone' techniek voorgesteld; bij volgende ingrepen zou in eerste instantie blijvende longvene-isolatie moeten nagegaan worden alvorens verdere substraatablatie te overwegen. In afwachting van prospectieve multicentrische studies omtrent de beste techniek voor substraatablatie, wordt voorlopig in de keuze rekening gehouden met de ervaring van de operator.
Referenties - Pathak, R.K., Middeldorp, M.E., Lau, D.H., Mehta, A.B., Mahajan, R., Twomey, D. et al. Aggressive risk factor reduction study for atrial fibrillation and implications for the outcome of ablation: the ARREST-AF cohort study. J Am Coll Cardiol, 2014, 64, 2222-2231.
- Pathak, R.K., Middeldorp, M.E., Meredith, M., Mehta, A.B., Mahajan, R., Wong, C.X. et al. Long-Term Effect of Goal-Directed Weight Management in an Atrial Fibrillation Cohort: A Long-Term Follow-Up Study (LEGACY). J Am Coll Cardiol, 2015, 65, 2159-2169.
- Kirchhof, P., Benussi, S., Kotecha, D., Ahlsson, A., Atar, D., Casadei, B. et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Europace, 2016, 18, 1609-1678.
- Matsuo, S., Lellouche, N., Wright, M., Bevilacqua, M., Knecht, S., Nault, I. et al. Clinical predictors of termination and clinical outcome of catheter ablation for persistent atrial fibrillation. J Am Coll Cardiol, 2009, 54, 788-795.
- Rostock, T., Salukhe, T.V., Steven, D., Drewitz, I., Hoffmann, B.A., Bock, K. et al. Long-term single- and multiple-procedure outcome and predictors of success after catheter ablation for persistent atrial fibrillation. Heart Rhythm, 2011, 8, 1391-1397.
- Konrad, T., Theis, C., Mollnau, H., Sonnenschein, S., Ocete, B.Q., Bock, K. et al. Primary Persistent Atrial Fibrillation: A Distinct Arrhythmia Subentity of an Ablation Population. J Cardiovasc Electrophysiol, 2015, 26, 1289-1294.
- Lim, H.S., Denis, A., Middeldorp, M.E., Lau, D.H., Mahajan, R., Derval, N. et al. Persistent Atrial Fibrillation from the Onset: A Specific Subgroup of Patients With Biatrial Substrate Involvement and Poorer Clinical Outcome. JACCCEP, 2016, 2, 129-139.
- Tilz, R.R., Rillig, A., Thum, A.M., Arya, A., Wohlmuth, P., Metzner, A. et al. Catheter ablation of long-standing persistent atrial fibrillation: 5-year outcomes of the Hamburg Sequential Ablation Strategy. J Am Coll Cardiol, 2012, 60, 1921-1929.
- Brooks, A.G., Stiles, M.K., Laborderie, J., Lau, D.H., Kuklik, P., Shipp, N.J. et al. Outcomes of long-standing persistent atrial fibrillation ablation: a systematic review. Heart Rhythm, 2010, 7, 835-846.
- Verma, A., Jiang, C.Y., Betts, T.R., Chen, J., Deisenhofer, I., Mantovan, R. et al. Approaches to catheter ablation for persistent atrial fibrillation. N Engl J Med, 2015, 372, 1812-1822.
- Rolf, S., Kircher, S., Arya, A., Eitel, C., Sommer, P., Richter, S. et al. Tailored atrial substrate modification based on low-voltage areas in catheter ablation of atrial fibrillation. Circ Arrhythm Electrophysiol, 2014, 7, 825-833.
- Yamaguchi, T., Tsuchiya, T., Nakahara, S., Fukui, A., Nagamoto, Y., Murotani, K. et al. Efficacy of Left Atrial Voltage-Based Catheter Ablation of Persistent Atrial Fibrillation. J Cardiovasc Electrophysiol, 2016, 27, 1055-1063.
- Jadidi, A.S., Lehrmann, H., Keyl, C., Sorrel, J., Markstein, V., Minners, J. et al. Ablation of Persistent Atrial Fibrillation Targeting Low-Voltage Areas With Selective Activation Characteristics. Circ Arrhythm Electrophysiol, 2016, 9, pii: e002962.
- Haissaguerre, M., Hocini, M., Denis, A., Shah, A.J., Komatsu, Y., Yamashita, S. et al. Driver domains in persistent atrial fibrillation. Circulation, 2014, 130, 530-538.
- Narayan, S.M., Krummen, D.E., Rappel, W.J. Clinical mapping approach to diagnose electrical rotors and focal impulse sources for human atrial fibrillation. J Cardiovasc Electrophysiol, 2012, 23, 447-454.
- Narayan, S.M., Baykaner, T., Clopton, P., Schricker, A., Lalani, G.G., Krummen, D.E. et al. Ablation of rotor and focal sources reduces late recurrence of atrial fibrillation compared with trigger ablation alone: extended follow-up of the CONFIRM trial (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation). J Am Coll Cardiol, 2014, 63, 1761-1768.
- Benharash, P., Buch, E., Frank, P., Share, M., Tung, R., Shivkumar, K. et al. Quantitative analysis of localized sources identified by focal impulse and rotor modulation mapping in atrial fibrillation. Circ Arrhythm Electrophysiol, 2015, 8, 554-561.
- Schade, A., Nentwich, K., Costello-Boerrigter, L.C., Halbfass, P., Mueller, P., Roos, M. et al. Spatial Relationship of Focal Impulses, Rotors and Low Voltage Zones in Patients With Persistent Atrial Fibrillation. J Cardiovasc Electrophysiol, 2016, 27, 507-514.
- Mohanty, S., Gianni, C., Mohanty, P., Halbfass, P., Metz, T., Trivedi, C. et al. Impact of Rotor Ablation in Nonparoxysmal Atrial Fibrillation Patients: Results From the Randomized OASIS Trial. J Am Coll Cardiol, 2016, 68, 274-282.
- Kirchhof, P., Calkins, H. Catheter ablation in patients with persistent atrial fibrillation. Eur Heart J, 2016, pii: ehw260.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.