Lors du 10ème Belgian Heart Rhythm Meeting, le Prof. Dr Sébastien Knecht (AZ Sint-Jan, Bruges) et le Prof. Dr Mark O'Neill (St. Thomas' Hospital & King's College, Londres) ont présenté un exposé state-of-the-art au sujet du traitement de la fibrillation auriculaire (FA) persistante.
Modalités thérapeutiques actuelles pour une FA persistante
Prévention et traitement des facteurs de risque cardiaque
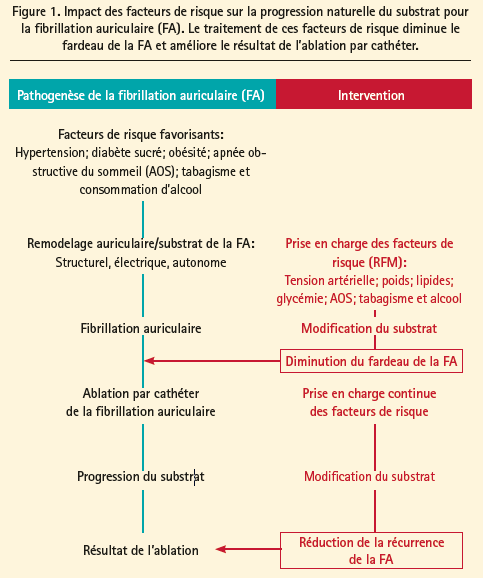
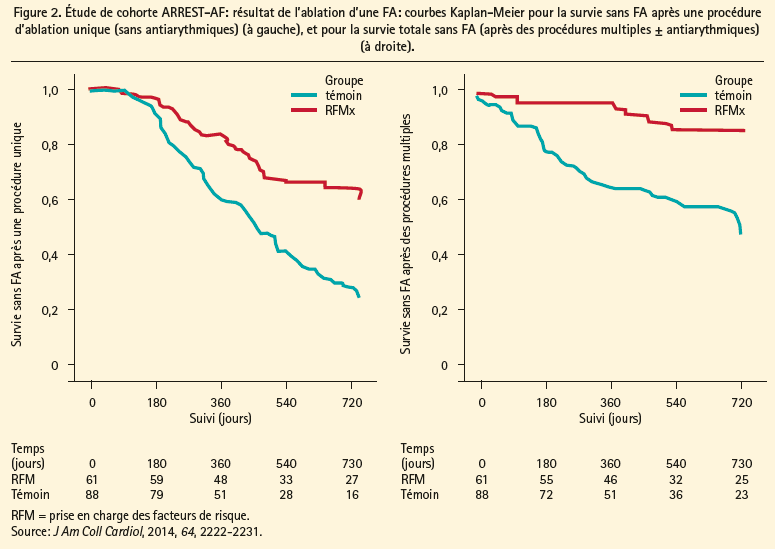
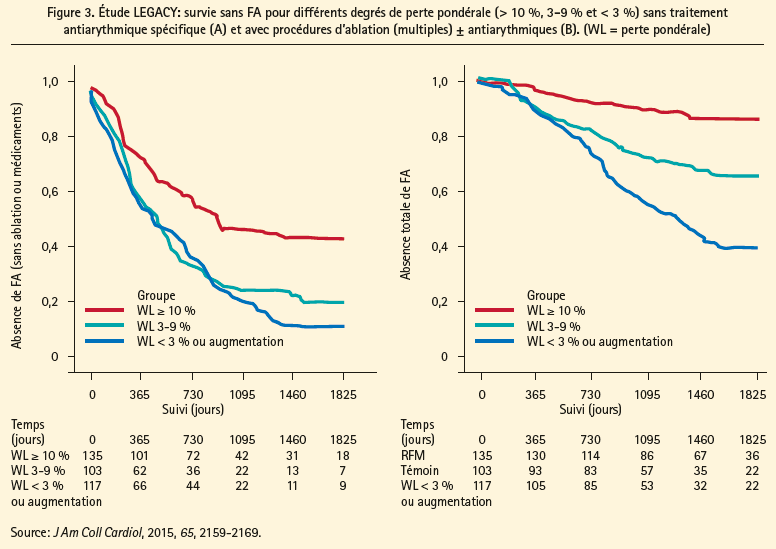
La prise en charge thérapeutique de la FA persistante débute par le traitement des affections associées et des facteurs de risque à l'origine du remodelage auriculaire, tels que le syndrome des apnées du sommeil, l'hypertension artérielle pulmonaire, l'hypertension artérielle systémique, le vieillissement, l'obésité et les affections associées à une dilatation auriculaire. Le traitement de ces facteurs de risque entraîne non seulement une modification bénéfique du substrat et une diminution du fardeau de la FA, mais il améliore également le résultat de l'ablation par cathéter (figure 1). Dans l'étude de cohorte ARREST-AF, 149 patients souffrant d'obésité (IMC ≥ 27 kg/m2) et présentant un facteur de risque cardiaque supplémentaire ont subi une ablation par cathéter pour une FA.1 Par la suite, 61 de ces patients ont bénéficié du traitement de ces facteurs de risque, ce qui a entraîné une diminution significative du poids corporel et un meilleur contrôle de la tension artérielle et du profil glycémique et lipidique, comparativement au groupe témoin, traité uniquement au moyen d'une procédure d'ablation, sans modification du mode de vie. Une prise en charge énergique de ces facteurs de risque a été associée à une survie plus élevée sans arythmies, tant après une procédure d'ablation unique qu'après des interventions multiples (figure 2), et il était également moins souvent nécessaire de réinstaurer des antiarythmiques (chez 16 % vs 42 % des patients, respectivement avec et sans prise en charge des facteurs de risque). L'importance de la réduction pondérale en cas d'obésité, lors du traitement de la FA, a été démontrée une fois de plus dans l'étude LEGACY.2 Dans cette étude de cohorte impliquant un suivi à long terme, 355 patients souffrant de FA et d'obésité (IMC ≥ 27 kg/m2) ont perdu du poids grâce à une modification du mode de vie. Ceci a entraîné une nette augmentation de la survie sans arythmies, tant avec un traitement antiarythmique spécifique (médicaments ou ablation) que sans ce traitement (figure 3). Plus la réduction pondérale était importante, meilleur était le résultat. Ainsi, la probabilité de survie sans arythmies était 6 fois plus élevée en cas de perte pondérale ≥ 10 %, comparativement à une perte pondérale plus modérée. Cet effet était partiellement neutralisé en cas de perte pondérale avec des fluctuations > 5 %.
Ablation par cathéter
Les recommandations 2016 de l'ESC, relatives au traitement de la FA, attribuent également une recommandation de classe IIA à l'ablation en cas de FA persistante symptomatique et de FA persistante prolongée, réfractaires aux antiarythmiques. Sur ce plan, il faut tenir compte du succès individuel escompté et des risques de l'intervention, ainsi que du choix du patient.3
Sélection du meilleur répondeur et timing de l'ablation
En ce qui concerne la sélection des patients pour une ablation fructueuse par cathéter d'une FA persistante, quelques éléments simples permettent de prédire le résultat. Le diamètre de l'oreillette gauche est un élément prédictif dominant, non seulement parce qu'une dilatation importante indique une atteinte significative du substrat, avec formation de fibrose, mais aussi parce que cela influence négativement la manipulation du cathéter et la stabilité durant la procédure. Un deuxième élément prédictif important est la longueur du cycle de FA, qui reflète la complexité du substrat, et qui peut être mesurée sur un ecg de surface à l'aide des ondes de fibrillation. Une longueur du cycle de FA < 140 ms est associée à un moins bon résultat. L'absence d'ondes de fibrillation sur l'ecg de surface indique également une fibrose étendue, et constitue un solide marqueur de pronostic défavorable. Un troisième élément prédictif indépendant d'une récidive de la FA est la durée de la FA continue. Une FA continue de longue durée entraîne en effet un remodelage structurel au niveau cellulaire et tissulaire. Matsuo et al. ont rapporté un risque considérablement plus élevé de récidive de la FA après l'ablation si la durée continue de la FA était supérieure à 21 mois,4 tandis que d'autres études ont déjà montré un risque de récidive accru si la durée continue de la FA était supérieure à 6 mois.5 Par conséquent, il est important d'éviter une FA persistante prolongée et de réorienter à temps un patient symptomatique en vue d'une ablation. En cas de FA de durée inconnue, le rétablissement du rythme sinusal par cardioversion électrique et antiarythmiques (amiodarone) peut entraîner un remodelage inverse, avec à nouveau une diminution du diamètre de l'oreillette gauche et un allongement éventuel de la longueur du cycle de FA, et ainsi augmenter le succès d'une ablation élective, quelques mois plus tard. En outre, le rétablissement du rythme sinusal permet d'évaluer la différence, en termes de symptomatologie, par rapport au rythme de FA continue existant auparavant. En raison du moins bon pronostic, il faut envisager un contrôle de la fréquence chez un patient asymptomatique présentant une récidive de FA peu après la cardioversion (surtout en cas de coexistence d'autres facteurs pronostiques negatifs).
D'autres facteurs cliniques associés à un moins bon résultat de l'ablation par cathéter d'une FA persistante sont le diabète, une BPCO, l'insuffisance rénale, l'insuffisance cardiaque congestive, une cardiomyopathie hypertrophique et une sténose valvulaire mitrale. Les patients souffrant de FA persistante primaire ont également un moins bon pronostic que les patients souffrant de FA persistante résultant de la transformation d'une FA paroxystique.6 Cette FA persistante primaire constitue une entité distincte avec une atteinte biauriculaire diffuse et des drivers de réentrée essentiellement situés en dehors des veines pulmonaires.7
On examine également les éléments prédictifs du risque de récidive au cours de la procédure d'ablation elle-même, comme la longueur du cycle de FA mesurée de manière invasive, la quantification de la fibrose auriculaire à l'aide de la réalisation d'une carte de voltage (mapping) et la cessation ou non de la FA grâce à l'ablation. Ces résultats sont également pris en considération si on doit envisager une procédure d'ablation complémentaire. Souvent, une récidive sous la forme d'une tachycardie auriculaire constitue une étape intermédiaire vers le maintien fructueux du rythme sinusal, et cela justifie presque toujours une procédure d'ablation supplémentaire.
Ablation empirique du substrat
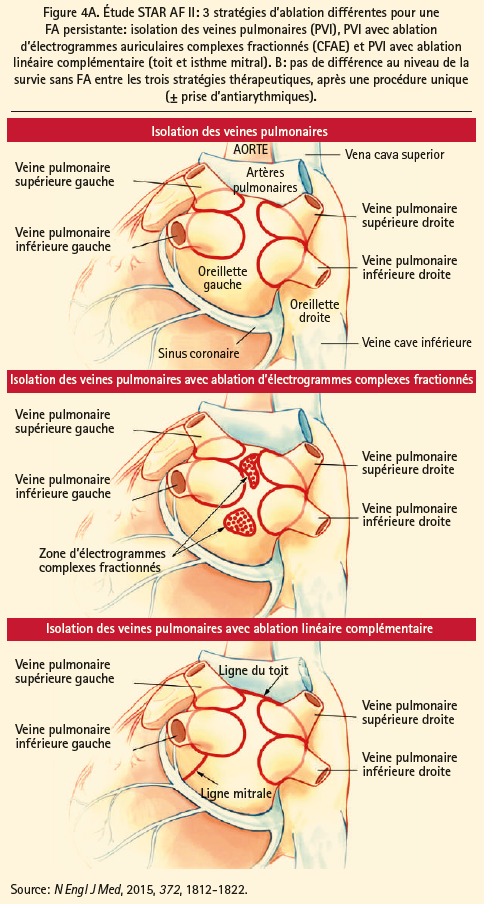
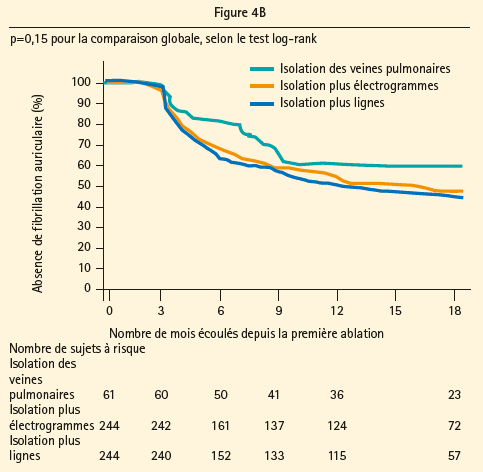
Le succès de l'ablation par cathéter pour une FA paroxystique, sous la forme de l'isolation des veines pulmonaires (PVI), est entre-temps formellement démontré, mais en cas de FA persistante, les résultats ne sont pas les mêmes.8 Étant donné que le substrat auriculaire diffère en cas de FA paroxystique et persistante, plusieurs autres stratégies d'ablation adjuvantes, ciblées sur la modification de ce substrat auriculaire, ont été examinées ces dix dernières années: 1) les lésions linéaires, par analogie avec la procédure chirurgicale de Cox-Maze; 2) l'ablation d'électrogrammes auriculaires complexes fractionnés (CFAE), corrélés avec des zones de ralentissement de conduction et des pivots d'ondes de réentrée; 3) l'approche séquentielle, qui utilise séquentiellement la PVI, l'ablation de CFAE et les lésions linéaires avec, comme critère d'évaluation procédurale, la cessation de la FA; 4) l'isolation BOX de la paroi postérieure de l'oreillette gauche; et 5) l'ablation de gâchettes indépendantes des veines pulmonaires. Le taux de succès moyen de ces différentes techniques n'atteint que 47 % en cas de FA persistante prolongée après une procédure unique, au bout d'un suivi moyen de 14 ± 8 mois, et ce, sans prise d'antiarythmiques.9 Avec des procédures complémentaires et en combinaison avec des antiarythmiques, le taux de succès passe à respectivement 65 et 79 %.9 Toutefois, en 2015, l'étude STAR AF II, une vaste étude multicentrique, randomisée, contrôlée, a rapporté que ni l'ajout de lignes atriales, ni l'ablation de CFAE lors d'une procédure d'ablation index n'entraînait de réduction supplémentaire des récidives de FA, comparativement à la PVI seule (figures 4A et B),10 ce qui explique que la quête d'une ablation plus ciblée et sélective du substrat continue.
Ablation sélective ciblée sur le substrat: fibrose auriculaire
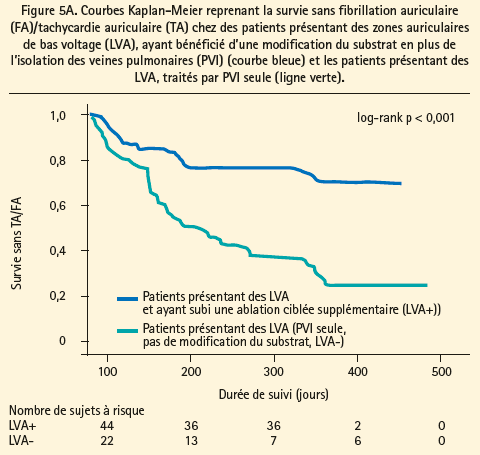
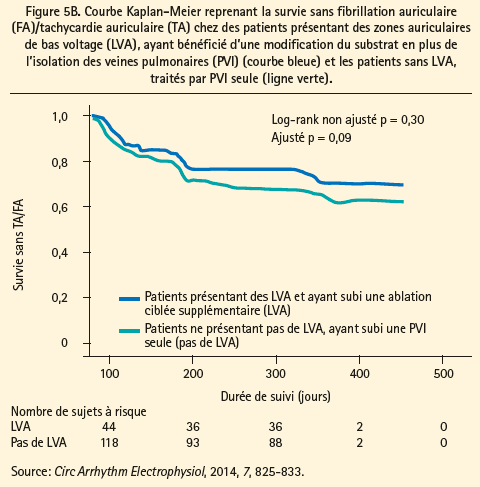
Des techniques individualisées plus récentes pour la modification sélective du substrat auriculaire, basée sur la fibrose auriculaire, ont été évaluées dans plusieurs études récentes: Rolf et al. ont rapporté un taux de succès moindre de la PVI pour une FA si on mettait en évidence des zones de bas voltage au niveau de l'oreillette gauche (indiquant une fibrose). Une modification sélective de ces zones de bas voltage, en plus de la PVI, a permis d'améliorer la survie sans arythmie de ces patients (figure 5A).11 En l'absence de zones de bas voltage (fibrose auriculaire), la PVI semble suffisante en tant que stratégie d'ablation (figure 5B). Yamaguchi et al. ont rapporté les mêmes résultats, spécifiquement dans une population souffrant de FA persistante,12 et Jadidi et al. ont rapporté de meilleurs résultats lors de l'ajout d'une ablation - sélective du substrat - de signaux, soit avec un fractionnement continu, soit avec une longueur de cycle localement plus courte, située dans les zones de bas voltage, en plus de la PVI.13 Comme nous l'avons déjà signalé, le maintien du rythme sinusal après une cardioversion électrique est un marqueur pronostique favorable. Ceci a été étayé dans l'étude de Jadidi et al., lors de laquelle des patients ayant conservé un rythme sinusal pendant 10 semaines après la cardioversion présentaient peu de zones de bas voltage avant l'ablation, et obtenaient une survie élevée sans arythmies avec la PVI seule.13
Ablation sélective ciblée sur le mécanisme: drivers
Une autre stratégie d'ablation sélective se cible sur la localisation de régions driver individuelles qui entretiendraient de façon mécanistique la FA persistante. Pour le moment, deux techniques de mapping innovantes existent: 1) une veste multiélectrodes qui intègre les potentiels de surface du corps avec les données anatomiques obtenues au départ d'un CT scan (Ecvue, Medtronic) et 2) un cathéter Basket multiélectrodes biauriculaire qui enregistre les électrogrammes de l'endocarde biauriculaire, lesquels seront par la suite traités avec un algorithme de phase mapping (Rhythm- View, Abbott). Avec le système Ecvue, Haïssaguerre et al. ont rapporté la présence de rotors instables dans un nombre limité de segments au cours des premiers mois de FA persistante. L'ablation de ces seuls drivers a mis fin à la FA chez 75 % des patients souffrant de FA persistante, mais dans seulement 15 % des cas de FA persistante de longue durée. Parmi les patients chez qui on a pu mettre fin à la FA, 85 % étaient toujours en rythme sinusal au bout d'un an. Parmi la population totale de l'étude, le pourcentage de sujets en rythme sinusal au bout d'un an atteignait 64 %.14
Avec le système RhythmView, Narayan et al. ont rapporté une prévalence élevée d'un petit nombre de rotors stables15 (ayant donc des propriétés électrophysiologiques différentes des rotors transitoires décrits par Haïssaguerre). En cas d'ablation de ces drivers (Focal Impulse and Rotor Modulation, FIRM) en plus d'une ablation conventionnelle, Narayan et al. ont rapporté des résultats prometteurs dans l'étude CONFIRM: 56 % de cessation de la FA pendant l'ablation15 et maintien du rythme sinusal chez 77,8 % des patients du groupe FIRM après un suivi de 29 mois, contre seulement 38,5 % des patients ayant subi une ablation conventionnelle.16 Toutefois, des critiques ont été formulées au sujet de l'algorithme de phase mapping, peu transparent, avec lequel les électrogrammes auriculaires ont été traités en cas de technique FIRM. Benharash et al. ont rapporté non seulement de moins bons résultats procéduraux, avec une cessation de la FA chez seulement 4 % des patients (vs 56 % dans l'étude CONFIRM), mais l'analyse quantitative des électrogrammes auriculaires au niveau des sites des rotors, identifiés grâce au système RhythmView, ne différait pas des autres localisations auriculaires et chez 23 patients sur 24, elle n'a pas montré d'activité rotatoire.17 Par ailleurs, il existe une importante discordance entre les localisations des rotors identifiés par la technique FIRM et les régions de bas voltage.18 Les résultats cliniques de l'ablation guidée par FIRM ont également été contredits par des études ultérieures,19 ce qui explique qu'il faut attendre les études de confirmation ultérieures avant de pouvoir évaluer véritablement la valeur du mapping des rotors.
Conclusion: la stratégie d'ablation par étapes pour une FA persistante
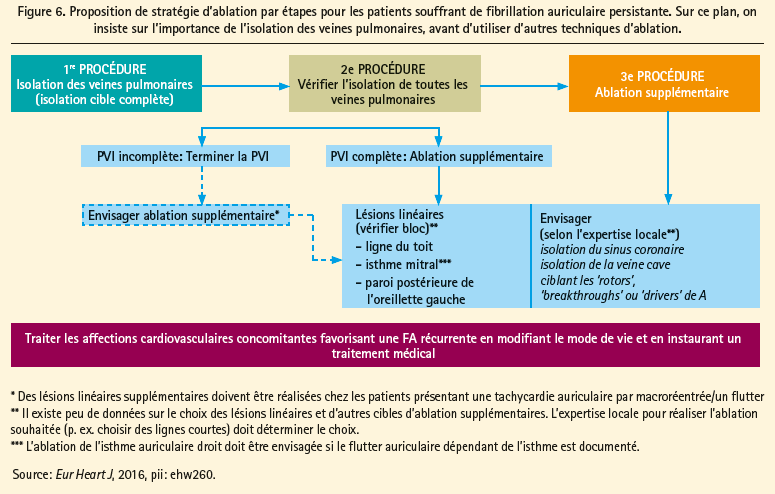
Sur la base des données actuelles, Paulus Kirchhof et Hugh Calkins ont proposé, dans un récent article de revue, une stratégie d'ablation par étapes pour l'ablation par cathéter d'une FA persistante (figure 6).20 À cet égard, ils ont souligné l'importance de l'isolation durable des veines pulmonaires ainsi que de la mise en oeuvre de la modification du mode de vie. Pour une première procédure, la PVI est proposée comme technique 'stand alone'; lors des interventions suivantes, il faudrait en premier lieu évaluer l'isolation permanente des veines pulmonaires avant d'envisager une plus ample ablation du substrat. Dans l'attente d'études prospectives multicentriques au sujet de la meilleure technique pour l'ablation du substrat, le choix est pour le moment guidé par l'expérience de l'opérateur.
Références
- Pathak, R.K., Middeldorp, M.E., Lau, D.H., Mehta, A.B., Mahajan, R., Twomey, D. et al. Aggressive risk factor reduction study for atrial fibrillation and implications for the outcome of ablation: the ARREST-AF cohort study. J Am Coll Cardiol, 2014, 64, 2222-2231.
- Pathak, R.K., Middeldorp, M.E., Meredith, M., Mehta, A.B., Mahajan, R., Wong, C.X. et al. Long-Term Effect of Goal-Directed Weight Management in an Atrial Fibrillation Cohort: A Long-Term Follow-Up Study (LEGACY). J Am Coll Cardiol, 2015, 65, 2159-2169.
- Kirchhof, P., Benussi, S., Kotecha, D., Ahlsson, A., Atar, D., Casadei, B. et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Europace, 2016, 18, 1609-1678.
- Matsuo, S., Lellouche, N., Wright, M., Bevilacqua, M., Knecht, S., Nault, I. et al. Clinical predictors of termination and clinical outcome of catheter ablation for persistent atrial fibrillation. J Am Coll Cardiol, 2009, 54, 788-795.
- Rostock, T., Salukhe, T.V., Steven, D., Drewitz, I., Hoffmann, B.A., Bock, K. et al. Long-term single- and multiple-procedure outcome and predictors of success after catheter ablation for persistent atrial fibrillation. Heart Rhythm, 2011, 8, 1391-1397.
- Konrad, T., Theis, C., Mollnau, H., Sonnenschein, S., Ocete, B.Q., Bock, K. et al. Primary Persistent Atrial Fibrillation: A Distinct Arrhythmia Subentity of an Ablation Population. J Cardiovasc Electrophysiol, 2015, 26, 1289-1294.
- Lim, H.S., Denis, A., Middeldorp, M.E., Lau, D.H., Mahajan, R., Derval, N. et al. Persistent Atrial Fibrillation from the Onset: A Specific Subgroup of Patients With Biatrial Substrate Involvement and Poorer Clinical Outcome. JACCCEP, 2016, 2, 129-139.
- Tilz, R.R., Rillig, A., Thum, A.M., Arya, A., Wohlmuth, P., Metzner, A. et al. Catheter ablation of long-standing persistent atrial fibrillation: 5-year outcomes of the Hamburg Sequential Ablation Strategy. J Am Coll Cardiol, 2012, 60, 1921-1929.
- Brooks, A.G., Stiles, M.K., Laborderie, J., Lau, D.H., Kuklik, P., Shipp, N.J. et al. Outcomes of long-standing persistent atrial fibrillation ablation: a systematic review. Heart Rhythm, 2010, 7, 835-846.
- Verma, A., Jiang, C.Y., Betts, T.R., Chen, J., Deisenhofer, I., Mantovan, R. et al. Approaches to catheter ablation for persistent atrial fibrillation. N Engl J Med, 2015, 372, 1812-1822.
- Rolf, S., Kircher, S., Arya, A., Eitel, C., Sommer, P., Richter, S. et al. Tailored atrial substrate modification based on low-voltage areas in catheter ablation of atrial fibrillation. Circ Arrhythm Electrophysiol, 2014, 7, 825-833.
- Yamaguchi, T., Tsuchiya, T., Nakahara, S., Fukui, A., Nagamoto, Y., Murotani, K. et al. Efficacy of Left Atrial Voltage-Based Catheter Ablation of Persistent Atrial Fibrillation. J Cardiovasc Electrophysiol, 2016, 27, 1055-1063.
- Jadidi, A.S., Lehrmann, H., Keyl, C., Sorrel, J., Markstein, V., Minners, J. et al. Ablation of Persistent Atrial Fibrillation Targeting Low-Voltage Areas With Selective Activation Characteristics. Circ Arrhythm Electrophysiol, 2016, 9, pii: e002962.
- Haissaguerre, M., Hocini, M., Denis, A., Shah, A.J., Komatsu, Y., Yamashita, S. et al. Driver domains in persistent atrial fibrillation. Circulation, 2014, 130, 530-538.
- Narayan, S.M., Krummen, D.E., Rappel, W.J. Clinical mapping approach to diagnose electrical rotors and focal impulse sources for human atrial fibrillation. J Cardiovasc Electrophysiol, 2012, 23, 447-454.
- Narayan, S.M., Baykaner, T., Clopton, P., Schricker, A., Lalani, G.G., Krummen, D.E. et al. Ablation of rotor and focal sources reduces late recurrence of atrial fibrillation compared with trigger ablation alone: extended follow-up of the CONFIRM trial (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation). J Am Coll Cardiol, 2014, 63, 1761-1768.
- Benharash, P., Buch, E., Frank, P., Share, M., Tung, R., Shivkumar, K. et al. Quantitative analysis of localized sources identified by focal impulse and rotor modulation mapping in atrial fibrillation. Circ Arrhythm Electrophysiol, 2015, 8, 554-561.
- Schade, A., Nentwich, K., Costello-Boerrigter, L.C., Halbfass, P., Mueller, P., Roos, M. et al. Spatial Relationship of Focal Impulses, Rotors and Low Voltage Zones in Patients With Persistent Atrial Fibrillation. J Cardiovasc Electrophysiol, 2016, 27, 507-514.
- Mohanty, S., Gianni, C., Mohanty, P., Halbfass, P., Metz, T., Trivedi, C. et al. Impact of Rotor Ablation in Nonparoxysmal Atrial Fibrillation Patients: Results From the Randomized OASIS Trial. J Am Coll Cardiol, 2016, 68, 274-282.
- Kirchhof, P., Calkins, H. Catheter ablation in patients with persistent atrial fibrillation. Eur Heart J, 2016, pii: ehw260.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.