Inleiding
IJzertekort is een van de meest voorkomende comorbiditeiten bij patiënten met hartfalen, met een prevalentie van rond de 50 %.1 IJzertekort, gedefinieerd als een ferritinegehalte van < 100 μg/l of een ferritinegehalte tussen de 100-300 μg/l in aanwezigheid van een transferrinesaturatie van < 20 %, is geassocieerd met een verminderde kwaliteit van leven, afgenomen inspanningstolerantie en een hoger risico op hartfalen, hospitalisatie en mortaliteit,2 zelfs zonder anemie.3 De pathofysiologie van ijzertekort binnen hartfalen is multifactorieel. Enerzijds kunnen verschillende mechanismen, zoals verminderde gastro-intestinale opname (theegebruik, protonpompinhibitie …) of chronisch gastro-intestinaal bloedverlies, aanleiding geven tot een reëel lichaamstekort van ijzer (absoluut ijzertekort).4 Anderzijds zorgt chronische upregulatie van ontstekingsmediatoren voor een verminderde biobeschikbaarheid van ijzer (functioneel ijzertekort). Tot op heden hebben enkele dubbelblind gerandomiseerde studies aangetoond dat behandeling met intraveneus ijzer (ijzer(III)carboxymaltose) de levenskwaliteit en inspanningstolerantie verbeteren bij patiënten met hartfalen en een verminderde ejectiefractie (HFrEF).5-7 Dit heeft ertoe geleid dat de 2016 Europese richtlijnen voor de behandeling van hartfalen adviseren om te screenen naar ijzertekort met een IC-evidentie en te behandelen met intraveneus ijzer(III) carboxymaltose (Injectafer©) met een IIa-evidentie.8 Dit artikel bespreekt de plaats van twee recentelijk gepubliceerde artikels in de behandeling van ijzertekort bij patiënten met HFrEF.9, 10
De rol van peroraal ijzer: de IRONOUT-HF-studie
Sinds 2009 is er evidentie van de FAIRHF- studie dat intraveneus ijzer de levenskwaliteit en inspanningstolerantie verbetert bij patiënten met HFrEF en ijzertekort.5 Desalniettemin was er tot op heden geen gerandomiseerde studie die het effect van peroraal ijzer voor dit doel testte. Eén kleine retrospectieve analyse bij HFrEF-patiënten deed vermoeden dat peroraal ijzer slechts een beperkte stijging van het ferritinegehalte en de transferrinesaturatie teweegbracht.11 De IRONOUT-HF-studie is de eerste prospectieve dubbelblind gerandomiseerde studie die het effect van perorale ijzertherapie bij HFrEF-patiënten evalueert.10 In totaal werden 225 patiënten over een periode van 14 maanden in 23 participerende Amerikaanse centra geïncludeerd. Patiënten met symptomatisch hartfalen (≥ New York Heart Association class II) en een ejectiefractie onder de 40 % met bewezen ijzertekort (zoals supra gedefinieerd) werden gerandomiseerd naar placebo of perorale ijzertherapie (polysacharide-ijzercomplex 150 mg 2 ×/dag). Alleen patiënten die een kwalitatieve cyclo-ergospirometrie konden afleggen werden gerandomiseerd, aangezien het primaire eindpunt de verandering in de maximale zuurstofopnamevermogen (VO2max) was. Na 16 weken therapie vertoonde de perorale-ijzertherapiegroep geen significante verandering in VO2max ten opzichte van de controlegroep. Dit neutraal effect van peroraal ijzer werd ook weerspiegeld in de secundaire eindpunten, namelijk geen significante verandering in NT-proBNP, 6 minutenwandeltest, hartfalenscores (Kansas City Cardiomyopathy Questionnaire), of andere cyclo-ergospirometriemetingen. Bijzonder boeiend aan de IRONOUT-HF- studie was de ontrafeling van het mechanisme, verantwoordelijk voor het falen van de perorale ijzertherapie. De IRONOUT-HF-studie toonde dat de concentratie van hepcidine in het bloed bij hartfalen gestegen is. Hepcidine wordt geüpreguleerd bij chronische inflammatie en zorgt onder andere voor een verminderde enterale opname van ijzer. Bovendien zorgde perorale ijzertherapie zelfs voor een verdere upregulatie van hepcidine bij hartfalenpatiënten, wat de inefficiëntie verklaart van peroraal ijzer om de ijzerreserves te alimenteren, ook al was de totale dosis van de perorale ijzertherapie 15 maal hoger dan van de intraveneuze ijzertherapie in de FAIR-HF- studie (33,6 g vs. 2 g respectievelijk).
Het potentieel van ijzer(III) carboxymaltose op harde eindpunten
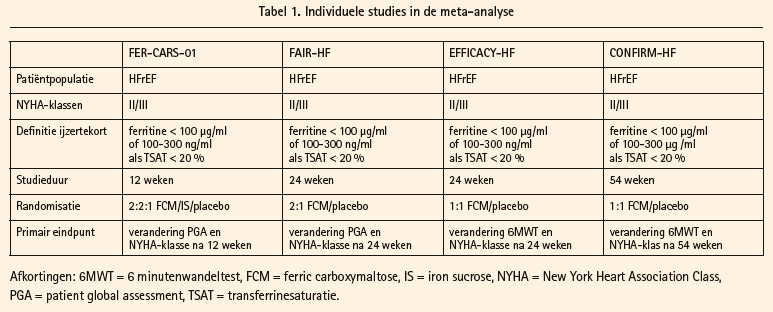
Ondanks het overtuigend gunstige effect van ijzer(III)carboxymaltose op hartfalensymptomen, kwaliteit van leven en inspanningstolerantie blijft het effect op harde eindpunten onbekend. Een vorige meta-analyse die verschillende preparaten van intraveneus ijzer onderzocht, suggereerde naast een verbetering van surrogaateindpunten ook een reductie van het gecombineerde eindpunt cardiovasculaire mortaliteit en cardiovasculaire hospitalisatie.12 Echter, deze meta-analyse bestudeerde een heterogene populatie aangezien het studies met verschillende definities van ijzertekort includeerde. In een nieuwe meta-analyse, gepubliceerd in The European Journal of Heart Failure, bestuderen prof. Anker en collega's het effect van ijzer(III)carboxymaltose op harde eindpunten binnen hartfalen en dit in een homogene patiëntenpopulatie.9 Alleen placebogecontroleerde studies met gelijkaardige patiëntenpopulatie, inclusiecriteria en interventie werden geïncludeerd in de meta-analyse (tabel 1). Bovendien beschikten de auteurs over de volledige dataset van de individuele studies wat een meer robuuste statistische evaluatie toeliet (herhaalde eventanalyse naast de klassieke tijd tot eerste eventanalyse). In totaal werden 844 HFrEF-patiënten geanalyseerd in de meta-analyse, waarvan 504 blootgesteld aan intraveneus ijzer(III)carboxymaltose en 335 aan placebo. Over een gemiddelde follow-upperiode van 31 weken, was de proportie van HFrEF-patiënten die het gecombineerde eindpunt cardiovasculaire hospitalisatie en cardiovasculaire mortaliteit doormaakten significant lager in de intraveneus-ijzerarm (rate ratio = 0,59, CI = 0,40-0,88, p = 0,009), wat voornamelijk gedreven werd door een reductie in hospitalisaties. Dit gunstige effect van ijzer(III)carboxymaltose werd zowel bewezen in de herhaald-eventanalyse als in de klassieke tijd tot eersteeventanalyse. Deze laatste houdt geen rekening met herhaalde episodes van hartfalen. Het is duidelijk uit deze metaanalyse dat de aanwezigheid van een chronische comorbiditeit (ijzertekort) het risico op repetitieve hartfalenhospitalisaties verhoogt. Als er toch een hospitalisatie optrad, was de duur van de hartfalenhospitalisatie korter in de ijzer(III) carboxymaltosegroep dan in de placebogroep (mediane duur van 10 vs. 12 dagen respectievelijk). Bovendien was de incidentie van nevenwerkingen dezelfde in zowel de placebogroep als in de ijzer(III) carboxymaltosegroep. Historisch gezien wordt toediening van intraveneus ijzer benaderd met de nodige voorzichtigheid. Dit is vooral gebaseerd op de bevinding dat de eerste generatie van intraveneuze ijzerpreparaten geassocieerd waren met anafylactische reacties. Belangrijk om te begrijpen is echter dat het niet het ijzer zelf is dat de anafylactische reacties uitlokt, maar de zetmeelmantel die het ijzer in de molecule omgeeft. Elk intraveneus ijzerpreparaat bestaat uit moleculen met een kern van ijzer en een mantel van zetmeel. De eerste generaties van intraveneus ijzer maakten gebruik van dextranen die geassocieerd waren met anafylactische reacties. Dit is niet het geval bij ijzer(III)carboxymaltose, waar de zetmeelmantel bestaat uit een carboxymaltose.
Besluit
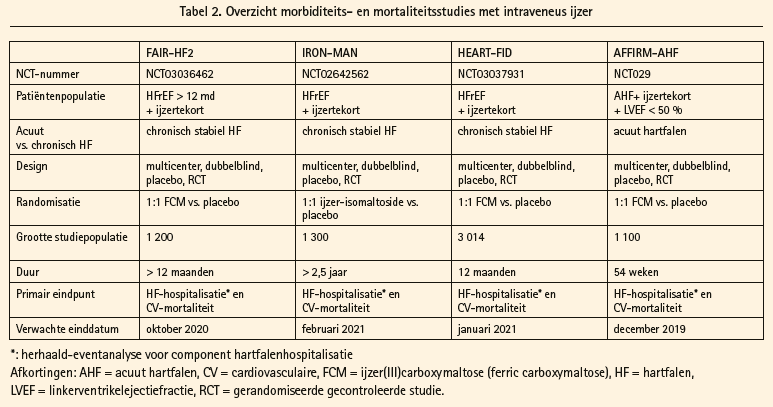
Zowel de IRONOUT-HF-studie als de meta-analyse scheppen meer duidelijkheid over de behandeling van ijzertekort bij de HFrEF-patiënt.9, 10 De IRONOUT-HF- studie toont onbetwistbaar aan dat peroraal ijzer niet opgenomen wordt. De enige juiste weg naar het opheffen van ijzertekort bij de HFrEF-patiënten is dan ook via intraveneuze alimentatie. De meta-analyse van de verschillende studies met ijzer(III)carboxymaltose schept de hoop dat intraveneus ijzer niet enkel surrogaateindpunten verbetert, maar ook harde eindpunten kan beïnvloeden. Er moet echter benadrukt worden dat de meta-analyse bestond uit individuele studies die elk op zich niet over de statistische power beschikten om een effect op harde eindpunten te evalueren. Het finaal antwoord of intraveneus ijzer een effect heeft op hartfalenhospitalisatie of cardiovasculaire mortaliteit zal uit adequaat gepowerde gerandomiseerde studies moeten komen. Momenteel zijn er vier zulke multicentrische gerandomiseerde studies lopende, waarvan tabel 2 de details weergeeft.
Financiële ondersteuning: Pieter Martens is onderzoeker verbonden aan het Limburg Clinical Research Program (LCRP) UHasselt-ZOL-Jessa, met financiële steun van Limburg Sterk Merk (LSM), Universiteit Hasselt, Ziekenhuis Oost- Limburg en Jessa Ziekenhuis. Pieter Martens heeft een unrestricted research grant ontvangen van Vifor Pharma.
Referenties
- Martens, P., Nijst, P., Verbrugge, F.H., Smeets, K., Dupont, M., Mullens, W. Impact of iron deficiency on exercise capacity and outcome in heart failure with reduced, mid-range and preserved ejection fraction. Acta Cardiol, 2017, 1-9.
- Iron deficiency: an ominous sign in patients with systolic chronic heart failure. Eur Heart J, 2010, 31, 1872-1880.
- Martens, P., Verbrugge, F., Nijst, P., Dupont, M., Tang, W.H., Mullens, W. Impact of Iron Deficiency on Response to and Remodeling After Cardiac Resynchronization Therapy. Am J Cardiol, 2017, 119 (1), 65-70.
- Jankowska, E.A., von Haehling, S., Anker, S.D., Macdougall, I.C., Ponikowski, P. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J, 2013, 34, 816-829.
- Anker, S.D., Comin, C.J., Filippatos, G. et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med, 2009, 361, 2436-2448.
- Ponikowski, P., van Veldhuisen, D.J., Comin-Colet, J. et al. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiencydagger. Eur Heart J, 2015, 36, 657-668.
- van Veldhuisen, D.J., Ponikowski, P., van der Meer, P. et al. Effect of Ferric Carboxymaltose on Exercise Capacity in Patients with Chronic Heart Failure and Iron Deficiency. Circulation, 2017, doi: 117.027497.
- Ponikowski, P., Voors, A.A., Anker, S.D. et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J, 2016, 18 (8), 891-975.
- Anker, S.D., Kirwan, B.A., van Veldhuisen, D.J. et al. Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data meta-analysis. Eur J Heart Fail, 2017, doi: 10.1002/ejhf.823. [Epub ahead of print].
- Lewis, G.D., Malhotra, R., Hernandez, A.F. et al. Effect of Oral Iron Repletion on Exercise Capacity in Patients With Heart Failure With Reduced Ejection Fraction and Iron Deficiency: The IRON-OUT HF Randomized Clinical Trial. JAMA, 2017, 317, 1958-1966.
- Niehaus, E.D., Malhotra, R., Cocca-Spofford, D., Semigran, M., Lewis, G.D. Repletion of Iron Stores With the Use of Oral Iron Supplementation in Patients With Systolic Heart Failure. J Card Fail, 2015, 21, 694-697.
- Jankowska, E.A., Tkaczyszyn, M., Suchocki, T. et al. Effects of intravenous iron therapy in iron-deficient patients with systolic heart failure: a meta-analysis of randomized controlled trials. Eur J Heart Fail, 2016, 18 (7), 786-795.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.