Over welke patiënten gaat het?
Pulmonale hypertensie wordt gedefinieerd als een gemiddelde rustdruk in de arteria pulmonalis van 25 mmHg of meer. Zowel linkszijdige hartproblemen (kleplijden, HF-REF/PEF, outflowtractobstructie …), longlijden/hypoxemie (COPD, interstitieel, OSAS …), chronische longembolie en een hele reeks zeldzamere aandoeningen kunnen pulmonale hypertensie veroorzaken.
Als de pulmonary capillary wedge-druk laag (PCW 15 mmHg of minder) en de pulmonale vaatweerstand hoog is (meer dan 3 wood units), dan spreken we van precapillaire pulmonale hypertensie. Vervolgens dienen we via technische onderzoeken oorzakelijk linkszijdig hartlijden, longlijden, chronische longembolen en een aantal andere aandoeningen uit te sluiten. Blijkt een patiënt met precapillaire pulmonale hypertensie aan geen van de bovengenoemde aandoeningen te lijden, dan heeft hij/zij een pulmonale arteriële hypertensie (PAH). Binnen deze PAH-groep vinden we regelmatig geen eenduidige oorzaak voor de aandoening (idiopathische vorm). Nochtans kan PAH te wijten zijn aan reumatische (voornamelijk sclerodermie), hepatische (vooral bij portale hypertensie), infectieuze (hiv en schistosomiasis) en congenitaal cardiale (vooral septumdefecten/shunts) aandoeningen. Tot slot zijn ook genetische en toxische vormen goed bekend. De aandoeningen die voldoen aan de PAH-definitie vertonen gelijkaardige afwijkingen in de microcirculatie van de longen, die de target vormen voor de medicamenteuze behandeling. (ESC/ ERS guidelines on pulmonary hypertension. Galiè, EHJ, 2015, 37, 67-119).
Wat is de prognose van PAH en hoe evalueren we het risico?
Onbehandeld overlijdt ongeveer 70 % van de patiënten binnen de 3 jaar. De overleving hangt deels samen met de onderliggende oorzaak van PAH, waarbij aan sclerodermie gerelateerde PAH de somberste prognose heeft en PAH door een congenitale hartaandoening, gerekend vanaf het moment van de diagnose, gemiddeld een langere overleving kent. De individuele inschatting van het 1 jaarsmortaliteitsrisico gebeurt op basis van een multiparameterevaluatie bestaande uit:
- symptomen: WHO-klasse, evolutie en eventuele syncopes;klinisch onderzoek: tekens van rechter hartfalen;
- fysiek inspanningsvermogen: 6 minutenwandeltestafstand of VO2-max en VE/VCO2-slope bij ergospirometrie;
- (NT-pro-)BNP;
- echocardiografische parameters: rechter atriumoppervlak, pericardvocht;
- invasief hemodynamische parameters: rechteratriumdruk, cardiac index en gemengde veneuze saturatie.
In functie van het resultaat wordt voor elke parameter een lage, intermediaire of hoge risicoscore toegekend. De combinatie van al deze parameters geeft een idee over het risico bij initiële evaluatie zoals geïllustreerd in figuur 1.
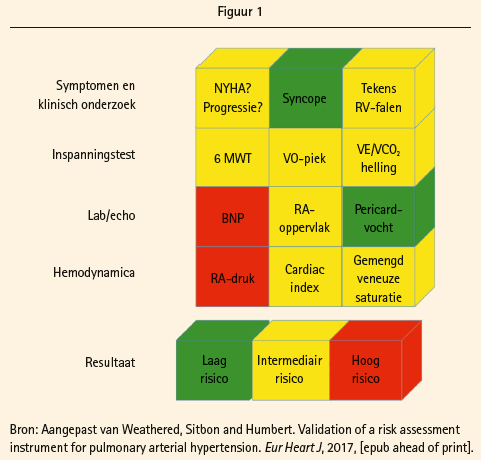
Bij patiënten in de laagrisicogroep bedraagt het mortaliteitsrisico minder dan 5 %, terwijl dit voor de intermediaire- en de hoogrisicogroep respectievelijk 5-10 % en >10 % bedraagt. Het belang van de risico-inschatting, zowel bij aanvang als tijdens opvolging onder behandeling, wordt uitgebreid toegelicht door prof. Humbert. De eventuele gunstige evolutie onder behandeling maar ook de kans op progressie van de onderliggende pathologie, co-morbiditeit, toenemende leeftijd en complexiteit van de behandeling wordt geïllustreerd in figuur 2. De ESC guidelines adviseren, zelfs bij stabiele patiënten, een drie- tot zesmaandelijkse evaluatie van de klinische status met wandeltest en jaarlijkse volledige risico inschatting. Bij de publieksstemming blijkt dat 10% van de aanwezige collega's geen systematische opvolging verricht en 20% enkel testen uitvoert bij klinische verslechtering, een wat discrepant resultaat vergeleken met de adviezen uit de guidelines.
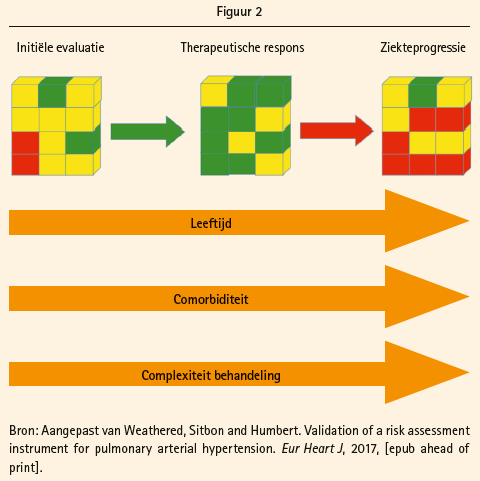
Het doel van behandeling is niet alleen het verbeteren van symptomen en het inspanningsvermogen, wat vaak het eindpunt van klinische trials is, maar bovendien het behouden of bereiken van een laagrisicostatus zoals ingeschat op basis van voornoemde parameters. De laagrisicostatus gaat immers gepaard met een betere overleving en een lagere kans op hospitalisatie. Het bereiken van een intermediair risico is een onvoldoende goed resultaat, gaat prof. Humbert verder. Deze uitspraak wordt gestaafd aan de hand van zeer recente uitgebreide Franse, Zweedse en Duitse registerdata (Boucly A, ERJ 2017; Kylhammar EHJ 2017; Hoeper ERJ 2017). De overleving in de laagrisicocategorie bedraagt meer dan 80 % op vijf jaar, maar deze daalt naar 60 % in de intermediair-risicogroep terwijl de hoogrisicogroep slechts een 10-40 % transplantvrije vijfjaarsoverleving kent. Helaas bevindt in realiteit slechts 23 % van de PAH-populatie zich in de laagrisicocategorie op het moment van de diagnose en bedraagt dit cijfer 29 % in de follow-up onder behandeling, vult prof. Rosenkranz later aan. De meerderheid van de PAH-patiënten blijft dus een intermediair tot hoog risico lopen, ondanks behandeling.
Welke medicamenteuze opties zijn beschikbaar?
Momenteel beschikken we over geneesmiddelen die ingrijpen op één van de volgende 3 pathways:
- de NO-pathway: fosfodiësterase 5-inhibitoren (PD5i) of riociguat, een guanylaatcyclasestimulator,
- de endotheline-pathway: endothelinereceptorantagonisten (ERA),
- de prostacycline-pathway: prostanoïden of selexipag, een IP-receptoragonist.
Behandelingsbeslissingen, zowel bij het starten als uitbreiden van de medicatie, worden geïndividualiseerd op basis van de risicocategorie, de evolutie, de onderliggende aandoening, eventuele comorbiditeiten en de leeftijd van de patiënt.
Waarom combinatietherapie?
Daar slechts een minderheid van de PAH-patiënten zich na 1 jaar in de laagrisicogroep bevindt, ondanks de ingestelde behandeling, lijkt het zinvol om medicijnen die ingrijpen op verschillende pathways te combineren om een beter resultaat te verkrijgen. Uit de SERAPHIN-studie bleek dat het toevoegen van macitentan, een ERA, bij de subgroep van patiënten die reeds behandeld werd met een PD5i een significante risicoreductie voor het gecombineerd eindpunt van tijdstip tot overlijden, septostomie, longtransplantatie, starten van behandeling met prostanoïden of verergering van de PAH inhield. In de AMBITION-trial werd eveneens een risicoreductie vastgesteld als al bij aanvang combinatietherapie bestaande uit tadalafil (een PD5i) en ambrisentan, (een ERA) gestart werd ten opzichte van monotherapie met slechts één van de producten. Ofschoon het resultaat van de combinatietherapie beter was dan monotherapie ondervond zowel in SERAPHIN als in AMBITION meer dan 20 % van de patiënten in de combinatiegroep een event binnen de 2 jaar (Seraphin: Pulido, NEJM, 2013, 369, 809-818. Ambition: Galiè, NEJM, 2015, 373, 834-844).
Triple therapie: voor wie, wanneer en welke combinatie?
Behandeling met triple combinatietherapie was tot op heden relatief onfrequent toont prof. Rosenkranz aan: slechts 4 % van de PAH-patiënten in Europa kreeg de afgelopen jaren triple therapie, 7 % in de USA en 17 % in Japan. Ondanks dat de guidelines behandeling met een parenteraal prostanoïd adviseren in de hoogrisicoklasse, krijgt meer dan 33 % van de hoogrisico-PAH-patiënten deze behandeling niet. Bij de stemming of triple therapie deel is van het routinebehandelingsarsenaal van de aanwezige collega's blijkt slechts de helft over deze mogelijkheid te beschikken, een kwart geen toegang te hebben tot prostanoïden of selexipag en een kwart misschien wel toegang te hebben, maar in de praktijk geen triple therapie te gebruiken. In de subgroep van de GRIPHON-trial waar selexipag, een IP-receptoragonist, werd toegevoegd bovenop een reeds lopende combinatietherapie met een ERA en een PD5i, bleek er opnieuw een significante risicoreductie, uitgedrukt als overlijden of een aan PAH gerelateerde complicatie. Bovendien werd in de GRIPHON-trial vastgesteld dat de risicoreductie even groot is of selexipag nu als monotherapie werd gegeven, toegevoegd werd aan ERA of PD5i, of bovenop de combinatie van een ERA en PD5i werd toegediend (Griphon Sitbon, NEJM, 2015, 373, 2522-33). Dit levert een bijkomend argument op voor het gelijktijdig inhiberen van verschillende pathways bij PAH.
Het publiek reageert gemengd op de vraag of ze triple therapie zouden geven aan PAH-patiënten in de intermediairrisicogroep: 25 % zou al van bij aanvang triple therapie starten (terwijl er nog geen data voor upfront-behandeling zijn), 25 % zou geen triple therapie overwegen en 50 % zou triple therapie sequentieel geven, zo nodig. Of het meteen starten van triple therapie hemodynamische of fysieke verbetering oplevert in vergelijking met dubbeltherapie bij laagtot intermediair-risicopatiënten wordt momenteel onderzocht in de TRITON-trial.
Tot slot wordt ook aangehaald dat bij inadequate respons onder combinatietherapie geschikte patiënten verwezen moeten worden voor longtransplantatie. De mediane overleving na longtransplantatie voor idiopathische PAH bedraagt immers een kleine 6 jaar, wat alvast stuk beter lijkt dan louter medicamenteuze behandeling in de hoogrisicogroep.
Samengevat illustreerde deze sessie eerst het uitzonderlijke belang van een systematische nauwkeurige multiparameteropvolging bij PAH en lijkt triple therapie zinvol voor de volgende situaties:
- van bij aanvang voor de hoogrisico-PAH-patiënt (IV prostanoïd);
- sequentieel bij de intermediair-risico-PAH-patiënt die onder behandeling met een PD5i/riociguat én een ERA de laagrisicostatus niet bereikt (PO selexipag);
- sequentieel bij verslechtering van de PAH (toevoeging van of switch naar IV prostanoïd).
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.