Naar de voordracht 'From the new guidelines to clinical practice: interactive case presentations of high risk MI patients with diabetes or CKD' van prof. W. Desmet en prof. O. Gach, gehouden op het 37ste congres van de Belgian Society of Cardiology op 9 februari 2018
In 2017 verschenen de nieuwe ESC-richtlijnen voor het gebruik van duale antiplaatjestherapie (DAPT).1 De mogelijkheid om DAPT 1 jaar na een acuut coronair syndroom (ACS) verder te zetten onder de vorm van een gereduceerde dosis ticagrelor (2 x 60 mg/dag) in combinatie met acetylsalicylzuur werd in deze richtlijn opgenomen en kreeg een klasse IIb-aanbeveling. Deze optie geldt echter enkel voor de hoogrisicopatiënten: patiënten boven 65 jaar, patiënten met diabetes mellitus, meertakslijden (> 50 % stenose in minstens 2 vaten), patiënten met een voorgeschiedenis van myocardinfarct en patiënten met chronisch nierlijden. De evidentie omtrent 2 van deze hoogrisicogroepen werd op de BSC-sessie aan de hand van casuïstiek toegelicht door prof. W. Desmet en prof. O. Gach.
De patiënt met chronische nierinsufficiëntie (prof. W. Desmet)
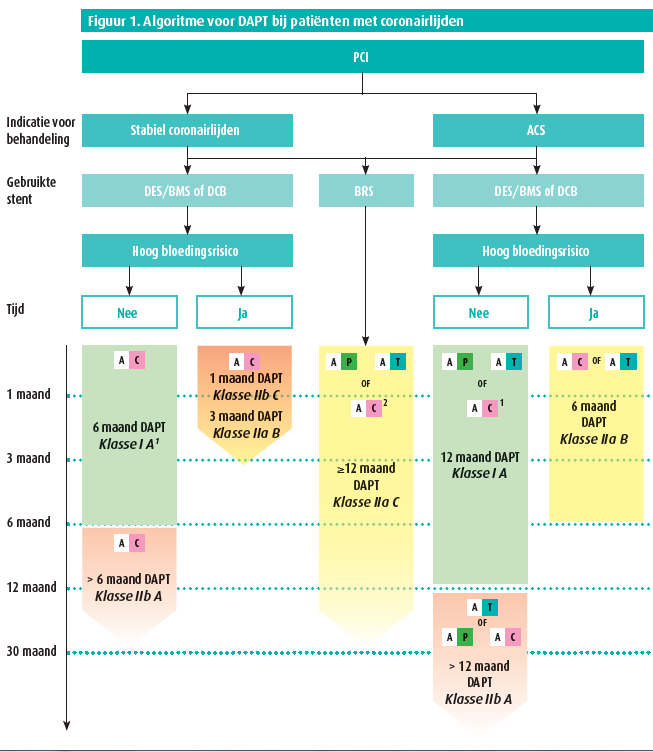
Prof. Desmet toonde een eerste casus van een 72-jarige patiënt met een matige nierfunctiebeperking en een NSTEMI. Verschillende criteria zijn in de richtlijnen opgenomen om patiënten met acuut coronair syndroom (ACS) met een zeer hoog cardiovasculair risico te onderscheiden van de hoog-, intermediair- en laagrisicogroep. Deze risicostratificatie bepaalt onder andere de noodzaak en timing van invasieve procedures. Nierinsufficiëntie op zich wordt als een intermediaire risicofactor aanzien. Verschillende scores zijn beschikbaar om de klinische praktijk verder te sturen. Zo geeft de SYNTAX-score een indruk van het ischemisch risico van de patiënt en worden de PRECISE-DAPT- en de DAPT-score vermeld om het bloedingsrisico van de individuele patiënt te evalueren en de duur van DAPT eventueel aan te passen.1 Zoals prof. Desmet illustreerde, kunnen deze scores echter op korte termijn variëren ten gevolge van kleine dagelijkse schommelingen in de bepalende parameters, en blijft een klinische inschatting waardevol.
Op basis van de resultaten van de PEGASUS- studie wordt in de DAPT-richtlijn van 2017 een gereduceerde DAPT op basis van ticagrelor 2 x 60 mg daags in combinatie met acetylsalicylzuur aangeraden bij hoogrisicopatiënten na een myocardinfarct op voorwaarde dat zich geen bloedingscomplicaties voordeden in de eerste 12 maanden (tabel 1).1, 2 Hoogrisicopatiënten werden hier tot maximaal 2 jaar na een acuut myocardinfarct geïncludeerd en behandeld met acetylsalicylzuur-monotherapie of acetylsalicylzuur en een gereduceerde dosis van ticagrelor (2 x 60mg/dag), en dit tot 3 jaar na het infarct. Een relatieve risicoreductie van 20 % werd bereikt in het gecombineerd primair eindpunt van cardiovasculaire mortaliteit, myocardinfarct en CVA. Dit ging gepaard met een significante toename aan TIMI-majeure bloedingen, maar evenwel zonder significant verschil in fatale of intracraniële bloedingen. Het grootste voordeel werd overigens bereikt bij voortzetting van de gereduceerde DAPT op 1 jaar na het myocardinfarct. Voor patiënten met chronisch nierlijden is de reductie in primair eindpunt zelfs groter dan bij de groep met een normale nierfunctie, maar zoals kan worden verwacht, gaat dit gaat hier gepaard met een toename aan bloedingen, weliswaar evenredig in beide groepen en opnieuw zonder significant verschil tussen ticagrelor en acetylsalicylzuur.3 Prof. Desmet benadrukte dan ook het belang om bloedingsrisico en ischemisch risico tijdens de indexhospitalisatie goed af te wegen en op dat ogenblik ook reeds de kandidaten voor gereduceerde DAPT te signaleren. Hier geldt uiteraard de voorwaarde van een goede tolerantie van de 'hoge dosis' DAPT gedurende het eerste jaar.
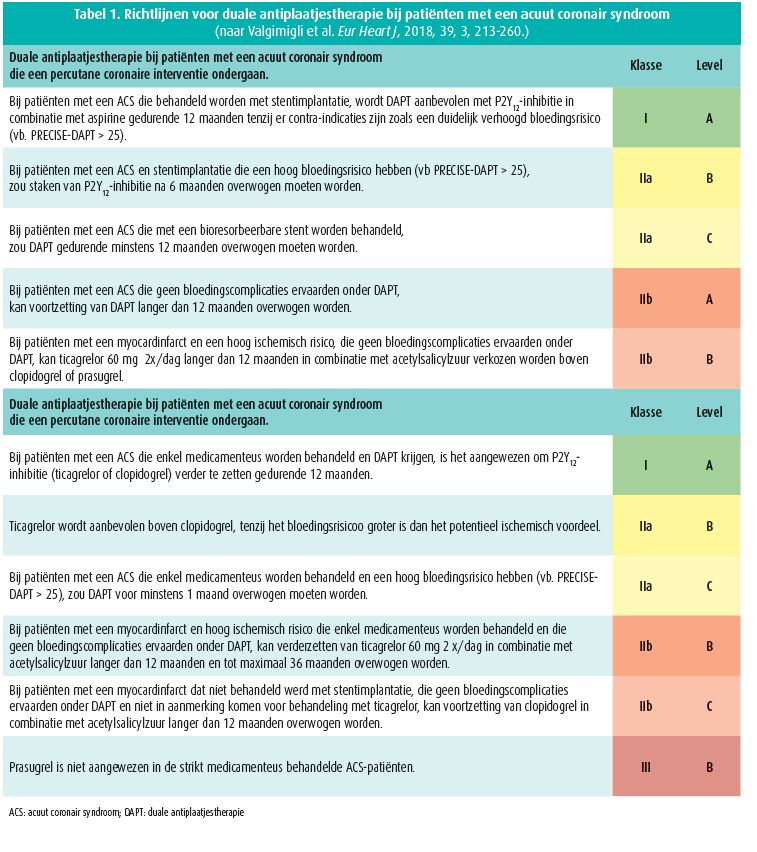
In een tweede casus werd een acuut STEMI voorgesteld bij een patiënt met een chronische nierfunctiebeperking en een indicatie voor orale anticoagulatie (CHA2DS2VASc-score 3/9). Conform de richtlijnen was er in het publiek eensgezindheid om de patiënt in de acute behandeling met antiplaatjestherapie op te laden alvorens te verwijzen voor urgente diagnostische coronarografie. Hiervoor gebruikt 33 % van de aanwezigen in deze omstandigheden clopidogrel, terwijl de rest evenwel ticagrelor verkiest. De opties inzake langetermijnbehandeling waren echter meer divers, en varieerden tussen combinaties met clopidogrel (33 %) of ticagrelor (43 %) en dit zowel in schema's van bi- als tritherapie met acetylsalicylzuur en orale anticoagulatie. Bij gebruik van ticagrelor zou 66 % deze therapie bovendien ook tot 1 jaar verderzetten. Bij patiënten met een indicatie voor orale anticoagulatie en PCI worden in de richtlijnen tot heden nochtans voorlopig enkel combinaties van clopidogrel met vitamine K-antagonisten of lage dosis NOAC vermeld1 (tabel 2). Vanwege de voorlopig beperkte gegevens omtrent het gebruik van het krachtigere ticagrelor of prasugrel in combinatie met vitamine K-antagonisten, behouden deze combinaties tot heden een klasse IIIc-indicatie. Het probleem van de onvoorspelbaarheid van clopidogrel inzake plaatjesinhibitie (cf. non-responders) werd door prof. W. Desmet echter als beperkende factor van clopidogrel aangewezen, en zou kunnen aangewend worden als argument in het voordeel van ticagrelor of prasugrel. Toekomstige studies zullen hier meer inzicht moeten brengen.
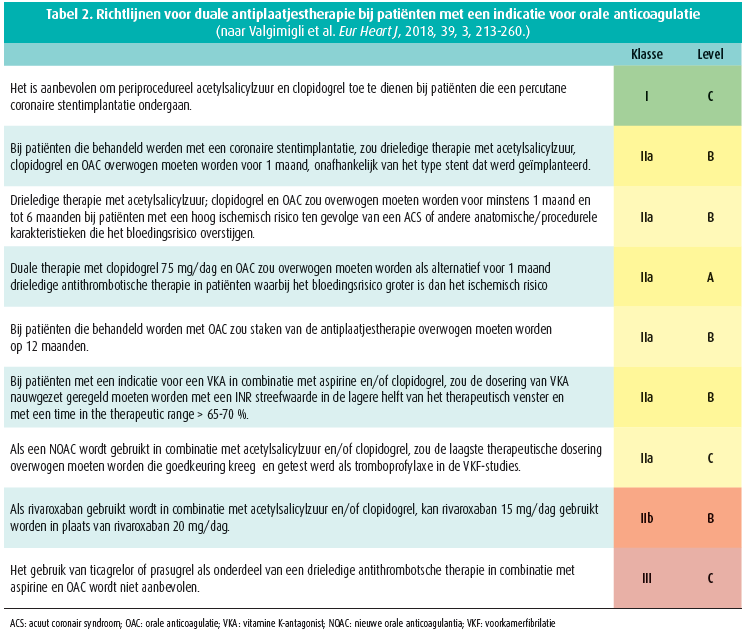
Bij noodzaak tot anticoagulatie wordt verder in de huidige richtlijn de duur van eventuele tri- of bitherapie niet duidelijk vastgelegd, maar blijft deze afhankelijk van de inschatting van enerzijds het bloedingsrisico en anderzijds het ischemisch risico van de individuele patiënt. Deze afweging blijft in de praktijk vaak complex, en verschillende criteria bepalen zowel het ischemisch risico als het bloedingsrisico. Een correcte klinische inschatting blijft dus primordiaal, en kan bij een individuele patiënt dan ook leiden tot een therapeutische beslissing die afwijkt van de gangbare richtlijnen.
De patiënt met diabetes mellitus (prof. O. Gach)
Prof. O. Gach stelde een diabetespatiënt voor met een acuut voorwand-STEMI. Het zo snel mogelijk opladen van een STEMI- patiënt met een P2Y12-inhibitor krijgt in de huidige richtlijn een klasse Ia-aanbeveling.1 Ondanks eerder beperkte evidentie volgden alle aanwezig deze richtlijn. In de ATLANTIC-studie zagen we dat prehospitaal opladen met ticagrelor bij STEMI-patiënten niet leidde tot een significant betere reperfusie.4 De vertraagde gastro-intestinale absorptie tijdens een ACS, met een trager instellend antiaggregerend effect van ticagrelor, zou hiervoor een mogelijke verklaring kunnen zijn. Bovendien was de door-to-balloon time in deze studie bijzonder kort: er was slechts een verschil van 31 min. tussen de groep die prehospitaal werd opgeladen en de groep die werd opgeladen in het cathlab. Wel was er een significant voordeel in de preventie van vroegtijdige stenttrombose, wat indirect toch in het voordeel kan pleiten van vroegtijdig opladen. Ook in de ACCOAST-studie bleek geen voordeel van pehospitaal opladen met prasugrel, al betrof het hier een NSTEMI-populatie.5 Prof. Gach kon verder met eigen data de huidige 2017-richtlijn ondersteunen. Hij toonde met eigen data aan dat prehospitaal opladen met de krachtigere P2Y12-inhibitoren bij STEMI- patiënten die met PCI worden behandeld een mortaliteitsvoordeel gaf zonder significante toename in bloedingscomplicaties, en dit in een periode met slechts 10 % radiale procedures (personal communication, in press).
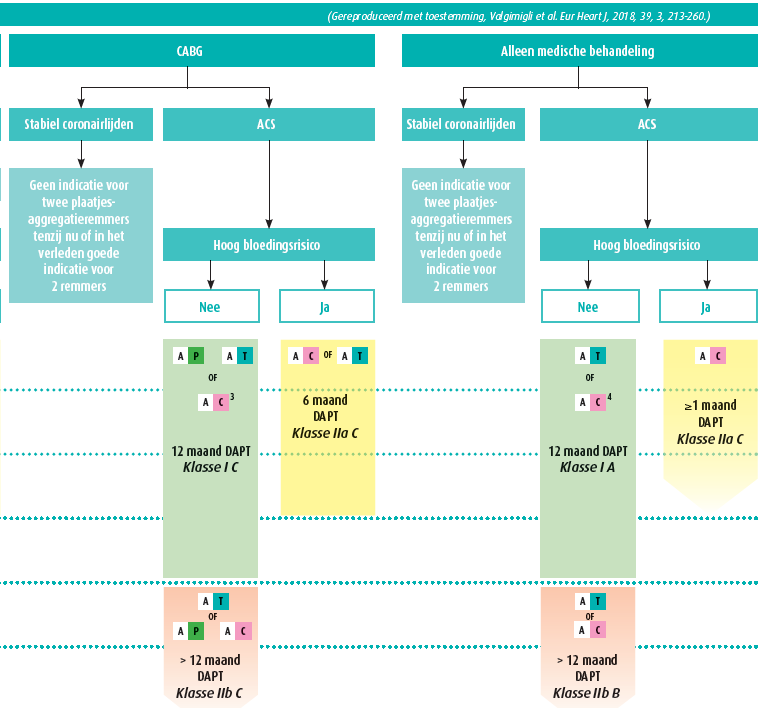
Voor de langetermijnbehandeling tot 12 maanden toonde zowel ticagrelor als prasugrel een significant voordeel ten opzichte van clopidogrel.6, 7 Voorzichtigheid is echter geboden bij het onderling vergelijken van ticagrelor en prasugrel. Zo zaten in de PLATO-studie meer STEMI-patiënten dan in de TRITON-TIMI 38-studie, en kregen patiënten uit de clopidogrel-arm in PLATO doorgaans een hogere oplaaddosis. Prasugrel gaf significant minder myocardinfarcten en minder stenttrombose, terwijl ticagrelor bovendien ook een lagere totale mortaliteit kon aantonen. Continueren van DAPT langer dan 12 maanden bleek echter langere tijd niet efficiënt en gaf bovendien een hoger bloedingsrisico. Het aantal ACS-patiënten dat geïncludeerd werd in studies was echter klein en er werden vaak nog geen drug-eluting stents van de tweede generatie gebruikt. Bovendien bemoeilijken de verschillende bloedingsdefinities een onderlinge vergelijking van DAPT-studies. In 2014 en 2015 konden de DAPT- en PEGASUS TIMI 54-studie echter voor het eerst gerandomiseerd en placebogecontroleerd, een reductie van ischemische events aantonen met verlengde DAPT langer dan 12 maanden, zonder significante toename aan majeure bloedingen.2, 8
Diabetes is een onafhankelijke risicofactor voor ischemische events. Een actievere staat van de bloedplaatjes, een versnelde turnover van bloedplaatjes en een noodzaak aan hogere dosissen antiplaa tjestherapie bij diabetici kan hiervoor een verklaring bieden. Diabetespatiënten zouden dan ook mogelijk meer voordeel kunnen halen uit een intensievere antiplaatjestherapie. Deze hypothese wordt ondersteund door de GPIIb-IIIa-studies in NSTEMI-patiënten en uit de TRITON-TIMI 38-studie, waarbij geen toename in bloedingscomplicaties werd gezien.
Prof. Gach vestigde daarnaast ook de aandacht op het feit dat de prognose van hartfalenpatiënten mét diabetes slechter is dan deze van hartfalenpatiënten zonder diabetes en dat er omgekeerd een 10 x hogere mortaliteit is bij diabetespatiënten mét hartfalen vergeleken met de groep zonder hartfalen. In dat opzicht zijn ook de resultaten van de EMPAREG- en CANVAS-studie veelbelovend, en hebben we sedert kort naast de antiplaatjestherapie ook op het vlak van diabetesbehandeling een medicatieklasse beschikbaar waarmee cardiologen en endocrinologen samen een 14 %-relatieve risicoreductie kunnen bereiken in cardiovasculaire mortaliteit.9, 10 Toekomstige studies zullen het ware potentieel moeten bevestigen van de SGLT2-inhibitoren in zowel primaire als secundaire cardiovasculaire preventie bij diabetici.
Conclusie
In lijn met de resultaten uit recentere trials bieden de huidige DAPT-richtlijnen voor het eerst meer houvast voor een verlengde DAPT, langer dan 12 maanden. Deze richtlijn geldt voorlopig voor een geselecteerde groep hoogrisicopatiënten met ACS, op voorwaarde dat zich in het eerste jaar geen bloedingscomplicaties hebben voorgedaan. Een vroegtijdige signalisatie van patiënten die in aanmerking kunnen komen lijkt belangrijk, en hiervoor blijft een individuele inschatting van bloedings- en ischemierisico primordiaal.
Referenties
- Valgimigli, M., Bueno, H., Byrne, R. A., Collet, J. P., Costa, F., Jeppsson, A., et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J, 2018, 39 (3), 213-260.
- Bonaca, M. P., Bhatt, D. L., Cohen, M., Steg, P. G., Storey, R. F., Jensen, E. C., et al. Longterm use of ticagrelor in patients with prior myocardial infarction. N Engl J Med, 2015, 372, 19, 1791-1800.
- Magnani, G., Storey, R. F., Steg, G., Bhatt, D. L., Cohen, M., Kuder, J., et al. Efficacy and safety of ticagrelor for long-term secondary prevention of atherothrombotic events in relation to renal function: insights from the PEGASUS-TIMI 54 trial. Eur Heart J, 2016, 37, 4, 400-408.
- Montalescot, G., van 't Hof, A. W., Lapostolle, F., Silvain, J., Lassen, J. F., Bolognese, L., et al. Prehospital ticagrelor in ST-segment elevation myocardial infarction. N Engl J Med, 2014, 371 (11), 1016-1027.
- Montalescot, G., Bolognese, L., Dudek, D., Goldstein, P., Hamm, C., Tanguay, J. F., et al. Pretreatment with prasugrel in non-ST-segment elevation acute coronary syndromes. N Engl J Med, 2013, 369 (11), 999-1010.
- Wallentin, L., Becker, R. C., Budaj, A., Cannon, C. P., Emanuelsson, H., Held, C., et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med, 2009, 361 (11), 1045-1057.
- Wiviott, S. D., Braunwald, E., McCabe, C. H., Montalescot, G., Ruzyllo, W., Gottlieb, S., et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med, 2007, 357 (20), 2001-2015.
- Mauri, L., Kereiakes, D. J., Yeh, R. W., Driscoll-Shempp, P., Cutlip, D. E., Steg, P. G., et al. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med, 2014, 371 (23), 2155-2166.
- Scirica, B. M., Bhatt, D. L., Braunwald, E., Steg, P. G., Davidson, J., Hirshberg, B., et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med, 2013, 369 (14), 1317-1326
- Neal, B., Perkovic, V., Mahaffey, K. W., de Zeeuw, D., Fulcher, G., Erondu, N., et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med, 2017, 377 (7), 644-657.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.