Op 23 en 24 februari organiseerde de dienst Elektrofysiologie van het AZ Sint-Jan Brugge voor de derde maal een internationale workshop rond de nieuwste fundamentele inzichten in de interpretatie van intracardiale signalen en hoe die aangewend worden voor de optimalisatie van ablatie van ritmestoornissen. Dit artikel focust zich op de sessies rond signaalinterpretatie en ablatiestrategieën in persistente atriale fibrillatie.
Signaalinterpretatie en ablatie bij persistente atriale fibrillatie
Pulmonalevenenisolatie (PVI) wordt algemeen beschouwd als de hoeksteen voor succesvolle ablatie van paroxismale atriale fibrillatie (AF), aangezien de longvenen doorgaans de bron van AF-oorzakelijke triggers zijn. Met optimale en duurzame isolatie van de longvenen kan dan ook tot 90 % vrijheid van recidief van voorkamerfibrillatie verkregen worden 1 jaar na een enkele ingreep.1
De ablatiestrategieën voor persistente AF zijn echter minder goed gedefinieerd, maar aangenomen wordt dat, wegens structurele veranderingen in het atriale myocard, bijkomende ablatie van het atriale substraat verantwoordelijk voor het onderhouden van AF noodzakelijk is om de slaagkans tot het succesvol behoud van sinusritme te verhogen. Klassieke bijkomende substraatablatiestrategieën zijn onder andere:
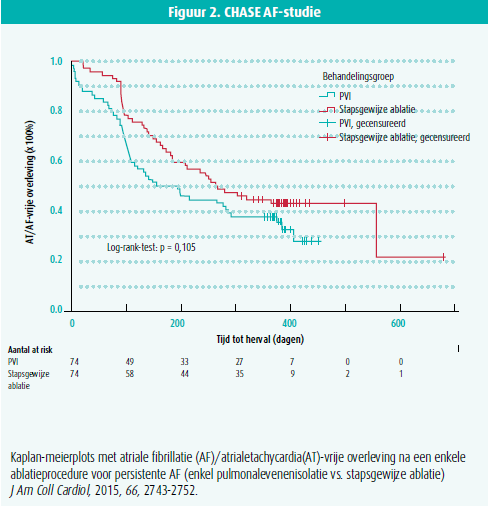
bijkomende lijnen in het linkeratrium, ablatie van complexe gefractioneerde elektrogrammen (CFAE) en stapsgewijze ablatie van gefractioneerde elektrogrammen en atriale lijnen in beide atria tot conversie van AF naar atriale tachycardie of sinusritme gekomen wordt. Het nut van deze bijkomende ablatiestrategieën voor een eerste ablatieprocedure is echter in opspraak gekomen door de STAR AF 2- en de CHASE AF-studie. In deze twee multicentrische gerandomiseerde gecontroleerde studies gaf noch de toevoeging van CFAE-ablatie of atriale lijnen, noch de stapsgewijze ablatie aanleiding tot een betere aritmievrije overleving na een enkele procedure, in vergelijking met enkel PVI (figuur 1 en 2).2-3 Kritiek op deze studies is echter dat de bijkomende substraatablatie mogelijk suboptimaal was, enerzijds omdat bij 26 % van de patiënten de linker atriale lijnen niet geblokkeerd waren (2), anderzijds omdat de bijkomende substraatablatie niet zorgde voor de verwachte transformatie van aritmierecidief in de vorm van AF naar reguliere atriale tachycardie.

Toch vereisen deze studieresultaten een kritische evaluatie van de ware betekenis van complexe signaalfractionatie. Traditioneel werden CFAE's geacht kritische locaties voor het onderhoud van AF aan te duiden. Meerdere studies toonden inmiddels echter aan dat de meerderheid van CFAE's passieve fenomenen zijn die dus niet kritisch zijn voor het onderhouden van AF. Toenemende data op basis van optische mappingstudies pleiten voor het concept dat de niet-georganiseerde activiteit tijdens AF door ruimtelijk geordende mechanismen onderhouden wordt, meestal in de vorm van gelokaliseerde AF-drivers. De strategie van het mappen en ableren van alle CFAE's is dan ook zo goed als zeker obsoleet en enkel een betere identificatie van die AF driver regio's verantwoordelijk voor het persisteren van AF heeft het potentieel om de resultaten van ablatie van persistente AF te verbeteren.
Verschillende technieken om een meer selectieve AF-driverablatie te verkrijgen werden dan ook ontwikkeld: a) substraatgerichte ablatie op basis van voltage (fibrose), b) identificatie van AF-drivers/rotors door middel van phase mapping, c) identificatie van AF-drivers door middel van spatiotemporele elektrogramdispersie aangetoond met multi-elektrodecontact-mapping.
Substraatgerichte selectieve ablatie op basis van atriale fibrose
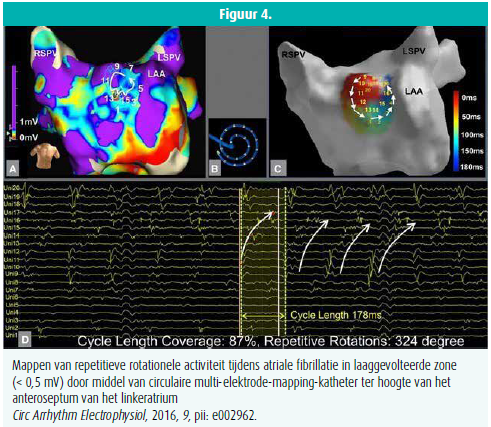
Technieken voor selectieve atriale substraatmodificatie (individueel voor elke patiënt) op basis van atriale fibrose werden in verschillende recente studies onderzocht: Rolf et al. rapporteerden een lager succespercentage van PVI in geval van fibrose in het linkeratrium, aangetoond door aanwezigheid van laaggevolteerde zones. Verder toonden zij aan dat een selectieve ablatie van deze laaggevolteerde zones boven op isolatie van de longvenen de aritmievrije overleving van deze patiënten verbeterde (figuur 3).4 Ook Yamaguchi et al. rapporteerden dezelfde bevindingen, meer specifiek in een populatie met persistente AF5. Jadidi et al. gingen nog een stap verder en rapporteerden een betere outcome t.o.v. longvenenisolatie door toevoeging van selectieve ablatie van enkel die laaggevolteerde zones waarin repetitieve gefractioneerde activatiepatronen voorkomen (figuur 4).6 Deze bijkomende selectieve ablatie na PVI resulteerde in beeïndiging van AF bij 73 % van de patiënten, met een aritmievrije overleving van 69 % na 13 maanden (t.o.v. 47 % in een controlegroep met enkel PVI).6

Identificatie en selectieve ablatie van AF-drivers op basis van phase mapping
Het mappen van het elektrische activatiepatroon tijdens AF op basis van lokale endocardiale elektrogrammen is moeilijk vanwege de gefractioneerde en lage amplitudesignalen en de gevoeligheid voor artefacten. Een techniek die hiervoor een oplossing biedt, is de zogenaamde phase transformation. Deze phase mapping laat het toe om circulerende wavefronts (rotors) te identificeren. Deze rotors worden beschouwd als individuele driverregio's die het persisteren van AF mechanistisch zouden onderhouden.7 Een selectieve ablatie van deze AF-drivers zou dan ook het resultaat van ablatie van persistente AF kunnen verbeteren.
Momenteel zijn twee innovatieve mappingtechnieken ter beschikking voor de identificatie van deze rotors:
een multi-elektrodenvest die lichaamsoppervlaktepotentialen integreert met anatomische data verkregen via een CT-scan (Ecvue, Medtronic) en een multi-elektrodenbasketkatheter die endocardiale elektrogrammen van beide atria registreert (RhythmView, Abbott). In beide systemen worden de geregistreerde signalen nadien verwerkt met een phase transformation-algoritme. Voor sommige activatiepatronen genereert de phase transformation echter ook valse rotors en dit verklaart mogelijk de wisselende resultaten van rotorablatie in de literatuur. Haïssaguerre et al. rapporteerden met het Ecvue-systeem aanwezigheid van een beperkt aantal onstabiele rotors tijdens de eerste maanden van persistente AF. Ablatie van enkel deze drivers resulteerde in terminatie van AF door ablatie bij 75 % van de patiënten. Van de patiënten waarbij AF-terminatie door ablatie verkregen werd, was 85 % na 1 jaar nog steeds in sinusritme. Van de volledige studiepopulatie bedroeg het percentage in sinusritme na 1 jaar 64 %.8 Narayan et al. rapporteerden met het RhythmView-systeem een hoge prevalentie van een klein aantal stabiele rotors9 (dus met elektrofysiologische eigenschappen verschillend van de onstabiele rotors beschreven door Haïssaguerre). Met ablatie van deze drivers (Focal Impulse and Rotor Modulation, FIRM) boven op conventionele ablatie rapporteerden Narayan et al. in de CONFIRM- studie beloftevolle resultaten: 56 % AF-terminatie tijdens ablatie9 en behoud van sinusritme bij 77,8 % van de patiënten in de FIRM-groep na een follow-up van 29 maanden, tegenover bij slechts 38,5 % van de patiënten die conventionele ablatie ondergingen.10 Kritiek wordt echter geuit op het weinig transparante phase mapping-algoritme waarmee de atriale elektrogrammen bij de FIRM-techniek worden verwerkt. Benharash et al. rapporteerden niet alleen slechtere procedurele resultaten met slechts
AF-terminatie bij 4 % van de patiënten (tegenover 56 % in de CONFIRM-studie), maar kwantitatieve analyse van de atriale elektrogrammen ter hoogte van de rotorsites, geïdentificeerd door het RhythmView-systeem, verschilde niet van overige atriale locaties en toonde bij 23/24 patiënten geen rotationele activiteit.11 Verder is er grote discrepantie tussen FIRM-geïdentificeerde rotorlokalisaties en lage voltageregio's.12 Ook de klinische resultaten van FIRM-guided ablatie werden door latere studies tegengesproken,13 waardoor het afwachten is op verdere confirmatiestudies vooraleer de echte waarde van rotormapping ingeschat kan worden.
Identificatie en ablatie van AF-drivers op basis van spatiotemporele elektogramdispersie
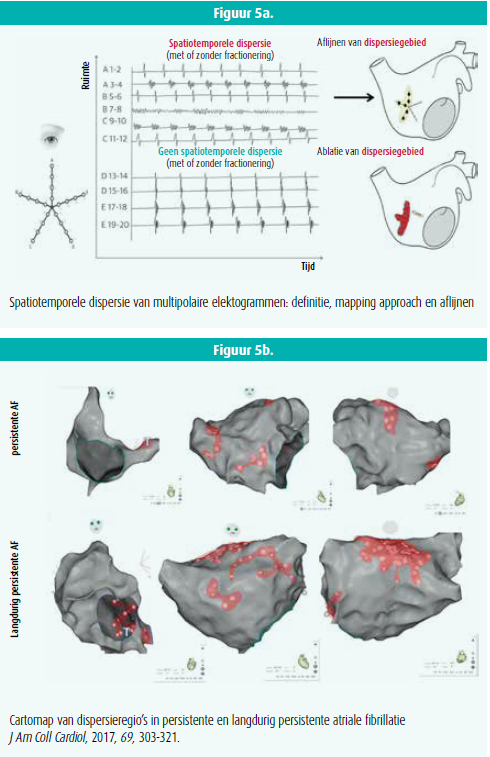
Ablatie van gefractioneerde elektrogrammen (CFAE) wordt meestal gestuurd door registratie aan de tip van een enkele intracardiale elektrode. Verschillende studies wijzen op de toegevoegde waarde van het mappen met multi-elektrodenkatheters, met onder andere de mogelijkheid om 'actieve' van 'passieve' CFAE 's te onderscheiden. Registratie van niet-simultane signalen op naburige elektroden (dispersie in tijd) en georganiseerd in duidelijke clusters (spatiale dispersie) kan immers wijzen op de aanwezigheid van een onderliggende AF-driver. Met dit idee verrichtten Seitz et al. mapping van intracardiale signalen met een multi- elektrodenkatheter bestaande uit 20 elektroden verdeeld over 5 benen, de Pentaray, bij 105 patiënten verwezen voor ablatie van AF (figuur 5a).14 Locaties met registratie van spatiotemporele dispersie werden aangeduid op de atriale map en nadien selectief geableerd (figuur 5b). Selectieve ablatie van deze spatiotemporele dispersieregio's (zonder longvenenisolatie) leidde tot AF-terminatie bij 95 % van de patiënten. Na 18 maanden follow-up bedroeg de aritmievrije overleving 85 % tegenover 59 % in een controlegroep die PVI/stapsgewijze ablatie onderging. Door meer selectieve ablatie was ook de radiofrequentietijd en de proceduretijd korter. Deze studie suggereert dat multipolaire endocardiale elektogramsignaturen als surrogaatmerker voor de lokalisatie van AF-drivers gebruikt kunnen worden en dit zonder phase transformation.
Besluit
De nieuwe technieken voor ablatie van persistente AF staan nog in de kinderschoenen en bijkomende multicentrische gerandomiseerde studies zullen noodzakelijk zijn om hun meerwaarde aan te tonen. Toch wijst alles erop dat de toekomst van de ablatie van persistente AF zal evolueren van een empirische ('one-fits-all') substraatablatie naar een op de individuele patiënt afgestemde, selectieve, op mechanisme gebaseerde ablatiestrategie.
Referenties
- Taghji, P., El Haddad, M., Phlips, T. et al. Evaluation of a Strategy Aiming to Enclose the Pulmonary Veins With Contiguous and Optimized Radiofrequency Lesions in Paroxysmal Atrial Fibrillation: A Pilot Study. JACC Clin Electrophysiol, 2018, 4, 99-108.
- Verma, A., Jiang, C.Y., Betts, T.R. et al. Approaches to catheter ablation for persistent atrial fibrillation. N Engl J Med, 2015, 372, 1812-1822
- Vogler, J., Willems, S., Sultan, A. et al. Pulmonary Vein Isolation Versus Defragmentation: The CHASE-AF Clinical Trial. J Am Coll Cardiol, 2015, 66, 2743-2752.
- Rolf, S., Kircher, S., Arya, A. et al. Tailored atrial substrate modification based on low-voltage areas in catheter ablation of atrial fibrillation. Circ Arrhythm Electrophysiol, 2014, 7, 825-833.
- Yamaguchi, T., Tsuchiya, T., Nakahara, S. et al. Efficacy of Left Atrial Voltage-Based Catheter Ablation of Persistent Atrial Fibrillation. J Cardiovasc Electrophysiol, 2016, 27, 1055-63.
- Jadidi, A.S., Lehrmann, H., Keyl, C. et al. Ablation of Persistent Atrial Fibrillation Targeting Low-Voltage Areas With Selective Activation Characteristics. Circ Arrhythm Electrophysiol, 2016, 9, pii: e002962.
- Vijayakumar, R., Vasireddi, S.K., Cuculich, P.S. et al. Methodology Considerations in Phase Mapping of Human Cardiac Arrhythmias. Circ Arrhythm Electrophysiol, 2016, 9, pii: e004409
- Haissaguerre, M., Hocini, M., Denis, A. et al. Driver domains in persistent atrial fibrillation, Circulation, 2014, 130, 530-538.
- Narayan, S.M., Krummen, D.E., Rappel, W.J. Clinical mapping approach to diagnose electrical rotors and focal impulse sources for human atrial fibrillation. J Cardiovasc Electrophysiol, 2012, 23, 447-454.
- Narayan, S.M., Baykaner, T., Clopton, P. et al. Ablation of rotor and focal sources reduces late recurrence of atrial fibrillation compared with trigger ablation alone: extended follow-up of the CONFIRM trial (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation). J Am Coll Cardiol, 2014, 63, 1761-1768.
- Benharash, P., Buch, E., Frank, P. et al. Quantitative analysis of localized sources identified by focal impulse and rotor modulation mapping in atrial fibrillation. Circ Arrhythm Electrophysiol, 2015, 8, 554-561.
- Schade, A., Nentwich, K., Costello-Boerrigter, L.C. et al. Spatial Relationship of Focal Impulses, Rotors and Low Voltage Zones in Patients With Persistent Atrial Fibrillation. J Cardiovasc Electrophysiol, 2016, 27, 507-514.
- Mohanty, S., Gianni, C., Mohanty, P. et al. Impact of Rotor Ablation in Nonparoxysmal Atrial Fibrillation Patients: Results From the Randomized OASIS Trial. J Am Coll Cardiol, 2016, 68, 274-282.
- Seitz, J., Bars, C., Théodore, G. et al. AF Ablation Guided by Spatiotemporal Electrogram Dispersion Without Pulmonary Vein Isolation: A Wholly Patient-Tailored Approach. J Am Coll Cardiol, 2017, 69, 303-321.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.