Les 23 et 24 février, le service d'électrophysiologie de l'AZ Sint-Jan de Bruges a organisé pour la troisième fois un atelier international au sujet des concepts fondamentaux les plus récents dans le cadre de l'interprétation des signaux intracardiaques et de leur utilisation pour l'optimisation de l'ablation des troubles du rythme. Cet article est consacré aux sessions portant sur l'interprétation des signaux et les stratégies d'ablation en cas de fibrillation auriculaire persistante.
Interprétation des signaux et ablation en cas de fibrillation auriculaire persistante
De manière générale, l'isolation des veines pulmonaires (IVP) est considérée comme la pierre angulaire pour l'ablation fructueuse de la fibrillation auriculaire (FA) paroxystique, étant donné que les veines pulmonaires sont habituellement la source de la FA (gâchettes électriques initiatrices). Au moyen d'une isolation optimale et durable des veines pulmonaires, on peut dès lors atteindre un taux d'absence de récidive de la fibrillation auriculaire de 90 % au bout d'un an, avec une seule procédure.1
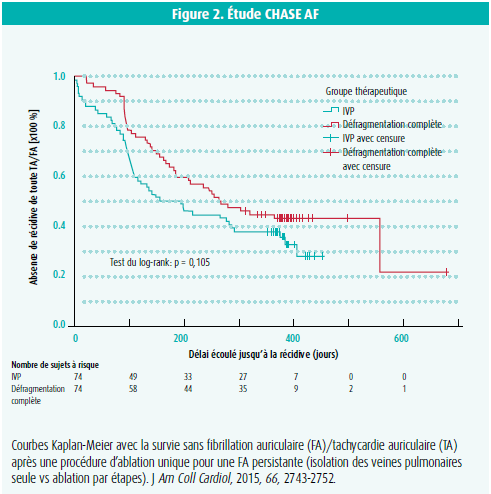
Les stratégies d'ablation pour une FA persistante sont toutefois moins bien définies mais, du fait de modifications structurelles au sein du myocarde auriculaire, on admet que l'ablation additionnelle du substrat auriculaire responsable de la perpétuation de la FA est nécessaire pour augmenter la probabilité de maintien fructueux du rythme sinusal. Les stratégies d'ablation du substrat additionnelles classiques sont entre autres 1) lignes additionnelles dans l'oreillette gauche, 2) ablation d'électrogrammes auriculaires complexes fractionnés (EACF) et 3) ablation par étapes d'électrogrammes fractionnés + lignes auriculaires dans les deux oreillettes, jusqu'à ce qu'on arrive à convertir la FA en tachycardie auriculaire ou à rétablir le rythme sinusal. Toutefois, l'utilité de ces stratégies d'ablation additionnelles lors d'une première procédure d'ablation a été mise en cause par les études STAR AF 2 et CHASE AF. Dans ces deux études multicentriques, randomisées, contrôlées, ni l'ajout d'ablation d'EACF ou de lignes auriculaires, ni l'ablation par étapes n'ont été associés à une meilleure survie sans arythmies après une procédure unique, comparativement à l'IVP seule (figures 1 et 2).2-3 Néanmoins, lors de ces études, l'ablation additionnelle du substrat était peut-être suboptimale, d'une part parce que les lignes auriculaires gauches n'étaient pas bloquées chez 26 % des patients (2), d'autre part parce que l'ablation additionnelle du substrat n'a pas été associée à la transformation escomptée d'une FA en tachycardie auriculaire régulière.

Par ailleurs, ces résultats d'études nécessitent quand même une évaluation critique de la véritable signification de la signification des EACF. Traditionnellement, on estimait que les EACF indiquaient des endroits critiques pour la perpétuation d'une FA. Cependant, plusieurs études ont entre-temps démontré que la plupart des EACF sont des phénomènes passifs, qui ne sont donc pas critiques pour la perpétuation d'une FA. De plus en plus de données reposant sur des études de mapping optique plaident en faveur du concept selon lequel l'activité non organisée durant la FA est entretenue par des mécanismes ordonnés dans l'espace, le plus souvent sous la forme de drivers de FA localisés. Dès lors, il est pratiquement certain que la stratégie de mapping et d'ablation de tous les EACF est obsolète, et seule une meilleure identification de ces drivers auriculaires responsables de la persistance de la FA peut potentiellement améliorer les résultats de l'ablation. De ce fait, plusieurs techniques ont été développées afin d'obtenir une ablation plus sélective des drivers de la FA: a) ablation ciblée sur le substrat, sur la base du voltage (fibrose), b) identification des drivers de FA/rotors au moyen de phase mapping, c) identification des drivers de FA au moyen de la dispersion spatiotemporelle des électrogrammes, démontrée au moyen du multi-electrode contact mapping.
Ablation sélective ciblée sur le substrat, basée sur la fibrose auriculaire
Les techniques de modification sélective du substrat auriculaire (individualisées pour chaque patient) sur la base d'une fibrose auriculaire ont été évaluées dans plusieurs études récentes: Rolf et al. ont rapporté un taux de succès moindre d'une IVP en cas de fibrose dans l'oreillette gauche, révélée par la présence de zones de bas voltage. Par ailleurs, ils ont démontré qu'une ablation sélective de ces zones de bas voltage, en plus d'une isolation des veines pulmonaires, améliorait la survie sans arythmies de ces patients (figure 3).4 Yamaguchi et al. ont également rapporté les mêmes observations, plus spécifiquement dans une population souffrant de FA persistante.5 Jadidi et al. ont été encore plus loin, et ont rapporté de meilleurs résultats par rapport à l'isolation des veines pulmonaires, en ajoutant une ablation sélective des seuls signaux d'EACF situés dans les zones de bas voltage (figure 4).6 Cette ablation sélective additionnelle après IVP mettait fin à la FA chez 73 % des patients, avec une survie sans arythmies de 69 % à 13 mois (vs 47 % dans un groupe contrôle avec IVP seule).6


Identification et ablation sélective de drivers de FA sur la base du phase mapping
Il est difficile de réaliser un mapping du type d'activation électrique durant la FA sur la base d'électrogrammes, étant donné la fragmentation complexe et l'amplitude faible des signaux et la sensibilité vis-à-vis des artefacts. La technique dite de phase transformation peut potentiellement offrir une solution. Ce phase mapping permet d'identifier des ondelettes (rotors) circulantes, qui sont considérées comme des drivers individuels qui perpétueraient mécanistiquement la FA.7 Une ablation sélective de ces drivers de FA pourrait dès lors améliorer le résultat de l'ablation d'une FA persistante.
Pour le moment, on dispose de deux techniques de mapping innovatrices pour l'identification de ces rotors: 1) une veste multi-électrodes qui intègre les potentiels de la surface du corps avec des données anatomiques obtenues via un CT scan (Ecvue, Medtronic) et 2) un cathéter multi- électrodes 'Basket' qui enregistre les électrogrammes endocardiques des deux oreillettes (RhythmView, Abbott). Avec ces deux systèmes, les signaux enregistrés sont ensuite traités au moyen d'un algorithme appelé phase transformation.
Toutefois, pour certains types d'activation, le phase transformation génère également de faux rotors, ce qui explique potentiellement les résultats fluctuants obtenus avec l'ablation des rotors, dans la littérature. Avec le système Ecvue, Haïssaguerre et al. ont rapporté la présence d'un nombre limité de rotors instables pendant les premiers mois d'une FA persistante. L'ablation de ces seuls drivers a mis fin à la FA chez 75 % des patients. Parmi les patients chez qui l'ablation a pu mettre fin à la FA, 85 % étaient toujours en rythme sinusal au bout d'un an. Sur l'ensemble de la population d'étude, le pourcentage de patients en rythme sinusal au bout d'un an atteignait 64 %.8 Avec le système RhythmView, Narayan et al. ont rapporté une prévalence élevée d'un petit nombre de rotors stables9 (qui avaient donc des propriétés électrophysiologiques différentes de celles des rotors transitoires décrits par Haïssaguerre). En cas d'ablation de ces drivers (Focal Impulse and Rotor Modulation, FIRM) en plus d'une ablation conventionnelle, Narayan et al. ont rapporté des résultats prometteurs dans l'étude CONFIRM: 56 % de cessation de la FA pendant l'ablation9 et maintien du rythme sinusal chez 77,8 % des patients du groupe FIRM, au bout d'un suivi de 29 mois, vs seulement 38,5 % des patients ayant subi une ablation conventionnelle.10 On a néanmoins critiqué le manque de transparence de l'algorithme de phase mapping avec lequel les électrogrammes auriculaires sont traités en cas de technique FIRM. Non seulement Benharash et al. ont rapporté de moins bons résultats procéduraux, avec une cessation de la FA chez 4 % des patients seulement (vs 56 % dans l'étude CONFIRM), mais l'analyse quantitative des électrogrammes auriculaires au niveau des sites des rotors, identifiés par le système RhythmView, ne différait pas des autres localisations auriculaires et, chez 23 patients sur 24, il n'y avait pas d'activité rotatoire.11 Par ailleurs, il existe une grande discordance entre les localisations des rotors identifiées par la technique FIRM et les régions de bas voltage.12 Les résultats cliniques d'une ablation guidée par la technique FIRM ont également été contredits par des études ultérieures,13 ce qui explique qu'il faut attendre d'autres études de confirmation avant de pouvoir se prononcer au sujet de la véritable valeur du mapping des rotors.
Identification et ablation des drivers de FA sur la base de la dispersion spatiotemporelle des électrogrammes
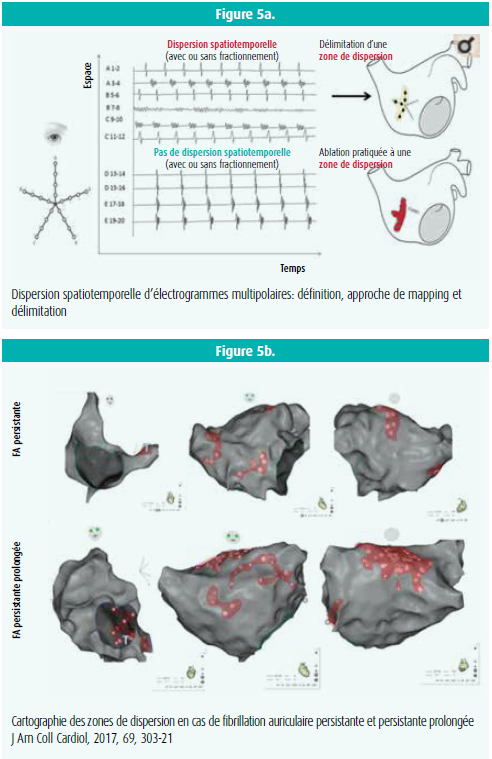
L'ablation d'électrogrammes fractionnés (EACF) est le plus souvent réalisée par un enregistrement à l'extrémité d'une électrode intracardiaque unique. Plusieurs études indiquent la plus-value du mapping au moyen de cathéters multi-électrodes, avec entre autres la possibilité de différencier des EACF 'actifs' et 'passifs'. L'enregistrement de signaux non simultanés sur des électrodes voisines (dispersion temporelle) et de signaux organisés en clusters nets (dispersion spatiale) peut en effet indiquer la présence d'un driver de FA sous-jacent. Exploitant cette idée, Seitz et al. ont pratiqué un mapping de signaux intracardiaques au moyen d'un cathéter multi-électrodes constitué de 20 électrodes réparties en étoile, le Pentaray, chez 105 patients adressés en vue d'une ablation de FA (figure 5a).14 Les endroits où on a enregistré une dispersion spatiotemporelle ont été indiqués sur la carte auriculaire et, par la suite, 'ablatés' sélectivement (figure 5b). L'ablation sélective de ces dispersions spatiotemporelles (sans isolation des veines pulmonaires) a mis fin à la FA chez 95 % des patients. Au bout de 18 mois de suivi, la survie sans arythmies atteignait 85 %, vs 59 % dans un groupe contrôle ayant subi une IVP/ablation par étapes. L'ablation plus sélective raccourcissait également la durée de la radiofréquence et de la procédure. Cette étude suggère que les signatures d'électrogrammes intracardiaques multipolaires peuvent être utilisées comme marqueur de substitution pour la localisation des drivers de FA.
Conclusion
Les nouvelles techniques pour l'ablation d'une FA persistante en sont encore à leurs balbutiements, et de plus amples études multicentriques randomisées seront nécessaires pour démontrer leur valeur ajoutée. Toutefois, tout indique que l'avenir de l'ablation d'une FA persistante va évoluer d'une ablation empirique du substrat ('onefits- all') à une stratégie d'ablation sélective individualisée en fonction des patients, basée sur les mécanismes.
Références
- Taghji, P., El Haddad, M., Phlips, T. et al. Evaluation of a Strategy Aiming to Enclose the Pulmonary Veins With Contiguous and Optimized Radiofrequency Lesions in Paroxysmal Atrial Fibrillation: A Pilot Study. JACC Clin Electrophysiol, 2018, 4, 99-108.
- Verma, A., Jiang, C.Y., Betts, T.R. et al. Approaches to catheter ablation for persistent atrial fibrillation. N Engl J Med, 2015, 372, 1812-1822
- Vogler, J., Willems, S., Sultan, A. et al. Pulmonary Vein Isolation Versus Defragmentation: The CHASE-AF Clinical Trial. J Am Coll Cardiol, 2015, 66, 2743-2752.
- Rolf, S., Kircher, S., Arya, A. et al. Tailored atrial substrate modification based on low-voltage areas in catheter ablation of atrial fibrillation. Circ Arrhythm Electrophysiol, 2014, 7, 825-833.
- Yamaguchi, T., Tsuchiya, T., Nakahara, S. et al. Efficacy of Left Atrial Voltage-Based Catheter Ablation of Persistent Atrial Fibrillation. J Cardiovasc Electrophysiol, 2016, 27, 1055-63.
- Jadidi, A.S., Lehrmann, H., Keyl, C. et al. Ablation of Persistent Atrial Fibrillation Targeting Low-Voltage Areas With Selective Activation Characteristics. Circ Arrhythm Electrophysiol, 2016, 9, pii: e002962.
- Vijayakumar, R., Vasireddi, S.K., Cuculich, P.S. et al. Methodology Considerations in Phase Mapping of Human Cardiac Arrhythmias. Circ Arrhythm Electrophysiol, 2016, 9, pii: e004409
- Haissaguerre, M., Hocini, M., Denis, A. et al. Driver domains in persistent atrial fibrillation, Circulation, 2014, 130, 530-538.
- Narayan, S.M., Krummen, D.E., Rappel, W.J. Clinical mapping approach to diagnose electrical rotors and focal impulse sources for human atrial fibrillation. J Cardiovasc Electrophysiol, 2012, 23, 447-454.
- Narayan, S.M., Baykaner, T., Clopton, P. et al. Ablation of rotor and focal sources reduces late recurrence of atrial fibrillation compared with trigger ablation alone: extended follow-up of the CONFIRM trial (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation). J Am Coll Cardiol, 2014, 63, 1761-1768.
- Benharash, P., Buch, E., Frank, P. et al. Quantitative analysis of localized sources identified by focal impulse and rotor modulation mapping in atrial fibrillation. Circ Arrhythm Electrophysiol, 2015, 8, 554-561.
- Schade, A., Nentwich, K., Costello-Boerrigter, L.C. et al. Spatial Relationship of Focal Impulses, Rotors and Low Voltage Zones in Patients With Persistent Atrial Fibrillation. J Cardiovasc Electrophysiol, 2016, 27, 507-514.
- Mohanty, S., Gianni, C., Mohanty, P. et al. Impact of Rotor Ablation in Nonparoxysmal Atrial Fibrillation Patients: Results From the Randomized OASIS Trial. J Am Coll Cardiol, 2016, 68, 274-282.
- Seitz, J., Bars, C., Théodore, G. et al. AF Ablation Guided by Spatiotemporal Electrogram Dispersion Without Pulmonary Vein Isolation: A Wholly Patient-Tailored Approach. J Am Coll Cardiol, 2017, 69, 303-321.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.