Inleiding
Niet-cardiale comorbiditeiten zijn frequent binnen het hartfalensyndroom en hebben een belangrijke impact op de prognose van de ziekte.1 Toch is het vaak minder duidelijk of de slechtere prognose, voorspeld door een comorbiditeit, gewoon een uiting is van een gevorderde ziekte of dat de comorbiditeit zelf een directe, negatieve impact heeft op het ziektetraject. In dat aspect worden anemie en ijzertekort als comorbiditeiten vaak samen besproken. Beide zijn frequent binnen het hartfalensyndroom en voorspellen een verminderde inspanningstolerantie en een hoger risico op hartfalenhospitalisatie en mortaliteit.2 Het ultieme bewijs echter of er ook een directe, negatieve bijdrage is van de comorbiditeit komt voort uit de gerandomiseerde studies. Hier wordt het effect van het opheffen van de comorbiditeit getest op het verbeteren van de prognose van de ziekte. Zo toont de RED-HF-studie dat erytropoëtine anemie kan doen afnemen, maar dat vertaalt zich niet in een verbeterde inspanningstolerantie of in een afname van hartfalenhospitalisaties en cardiale sterfte.3 Behandelen van ijzertekort daarentegen met intraveneuze ijzer(III)carboxymaltose (injectafer©) toont echter wel in de FAIR-HF-, CONFIRM-HF- en EFFECT-HF-studie een verbetering van functionaliteit.4-6 Verder suggereert een meta-analyse van deze laatste studies dat behandeling met ijzer(III)carboxymaltose ook hartfalenhospitalisaties kan reduceren.7 In deze sessie op de 38ste BSC-meeting werd de pathofysiologische impact van ijzertekort, de prevalentie van ijzertekort en de behandeling van ijzertekort bij hartfalen besproken.
Ontwikkeling en frequentie van ijzertekort bij hartfalen
IJzer is een essentiële cofactor in verschillende energetische en anti-oxidatieve pathways in het lichaam.8 Zowel ijzertekort als ijzerstapeling is nefast. Aangezien vrij ijzer in het lichaam fentonreacties kan veroorzaken (vorming van vrije radicalen), is evolutionair gezien het opnemen van ijzer uit de voeding en transport van ijzer in het lichaam sterk gereguleerd. Transport van ijzer in de bloedbaan gebeurt door transferrine dat twee ijzerionen kan dragen. Intracellulaire opslag (bv. in de cardiomyocyt of het reticulo-endotheliaal systeem) gebeurt door ferritine, dat tot 4 500 ijzerionen kan dragen. Ferritine wordt ook gedeeltelijk gesecreteerd in de bloedbaan. Hierdoor is het serumferritine een indicator van de totale hoeveelheid lichaamsijzer9. In geval van inflammatie zal de lever het hormoon hepcidine produceren. Dat hepcidine bindt met ferroportine zodat ijzer minder wordt afgegeven aan de bloedbaan door de enterocyten en tevens geclusterd blijft aan het ferritine in het reticulo-endotheliaal systeem (figuur 1). Het hartfalensyndroom grijpt sterk in op deze regulatie van ijzer in het lichaam. Zowel een verminderde cardiale output, als een stijging in vullingsdrukken zijn prototypische hemodynamische afwijkingen die het hartfalensyndroom kunnen kenmerken10, 11. Beide geven echter aanleiding tot productie van pro-inflammatoire cytokines met productie van hepcidine. Hoge concentraties van hepcidine bij hartfalen kan leiden tot clustering van ijzer in het reticulo-endotheliaal systeem zodat dit niet beschikbaar is voor de cardiomyocyten en skeletspieren (functioneel ijzertekort). Echter is hartfalen vaak ook gekenmerkt door intestinaal oedeem, verminderde eetlust of chronisch gebruik van bloedverdunners, wat aanleiding geeft tot intestinaal verlies van ijzer (absoluut ijzertekort)12.
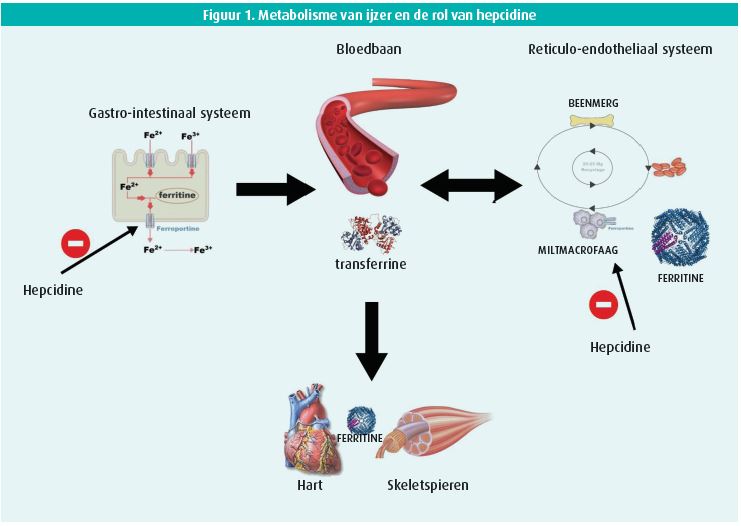
Gezien de verschillende mechanismen die aanleiding kunnen geven tot ijzertekort, wordt ijzertekort binnen hartfalen relatief breed gedefinieerd in vergelijking met andere medische disciplines. De gangbare definitie van ijzertekort bij hartfalen is een serumferritine < 100 μg/L ongeacht de transferrinesaturatie, of een serumferritine tussen de 100-300 μg/L als de transferrinesaturatie minder dan 20 % bedraagt. Hierbij kan een zeer laag serumferritine geïnterpreteerd worden als een vorm van absoluut ijzertekort, terwijl een hoger serumferritine (tussen 100-300 μg/l) met een lage transferrinesaturatie wijst op functioneel ijzertekort.1 Echter, officiële waardes van functioneel en absoluut ijzertekort zijn niet duidelijk beschreven.9 In de oppuntstelling van ijzertekort is het belangrijker om te beseffen dat een lagere ferritine kan wijzen op de aanwezigheid van onderliggende intestinale maligniteiten.12 Het gebruik van de bovenstaande definitie van ijzertekort laat echter toe in de klinische praktijk een patiëntenpopulatie te identificeren met een verhoogd risico op functionele limitatie en risico op hartfalenhospitalisatie. Een studie van 1 207 hartfalenpatiënten gevolgd op de hartfalendienst van het Ziekenhuis Oost Limburg (ZOL Genk) toont dat de algemene prevalentie van ijzertekort 53 % is.13 Vrouwelijke patiënten, patiënten die bloedverdunners nemen en in een hogere NYHA-klasse functioneren, hebben over het algemeen het vaakst ijzertekort. Tevens komt ijzertekort voor met een hoge prevalentie bij hartfalen met verminderde, 'mid-range' en bewaarde ejectiefractie.13
Nadelige gevolgen van ijzertekort op het hartfalensyndroom
IJzer is een essentiële cofactor van de eerste drie complexen van de elektronentransportketen, dat de ATP-productie uit de oxidatieve fosforylering reguleert.14 Het hart is bij uitstek een van de organen met de hoogste metabole behoefte en verbruikt dagelijks 6 kg ATP. Het is goed beschreven dat hartfalen wordt gekenmerkt door een afgenomen reserve van ATP (en fosfocreatinine).15 Cel- en dierstudies tonen aan dat ijzertekort een verminderde cardiale respiratie geeft met een daling van de ATP-reserve, zodat er onvoldoende ATP/fosfocreatinine aanwezig is om de metabole vereisten te ondersteunen tijdens systole (voornamelijk de actine-myosinekoppeling) en diastole (voornamelijk calciumbuffering).14, 16, 17 Deze afwijkingen worden vooral klinisch relevant tijdens inspanning wanneer de energetische vraag van de cardiale myocyten stijgt om de systole en diastole functie te ondersteunen.18 Een invasieve hemodynamicastudie van het ZOL Genk toont aan dat deze preklinische bevindingen ook klinisch relevant zijn. Namelijk hartfalenpatiënten met verminderde ejectiefractie en ijzertekort tonen een verminderde contractiele reserve tijdens inspanning in vergelijking met hartfalenpatiënten zonder ijzertekort.18 Verder toont een studie van Melenovsky aan dat de gevolgen van ijzertekort niet alleen zijn gelimiteerd tot de cardiomyocyten. Ook de skeletspieren van patiënten met hartfalen en ijzertekort vertonen een snellere afname van energiereserves en vroege acidificatie van de spieren tijdens inspanning. 19 Dat allemaal samen verklaart zeer goed de afgenomen inspanningstolerantie die gezien wordt in observationele studies (afnamen in 6 minutenwandeltest en VO2-max).13 Daarenboven is ijzer een belangrijke cofactor voor anti-oxidatieve enzymen. Een verminderde werking daarvan is geassocieerd met progressieve cardiale remodeling in dierstudies. Dat laatste is ook belangrijk in de klinische praktijk aangezien hartfalenpatiënten met ijzertekort een verminderde 'reverse remodeling response' hebben op gevestigde hartfalenbehandelingen.20
Behandeling van ijzertekort binnen hartfalen
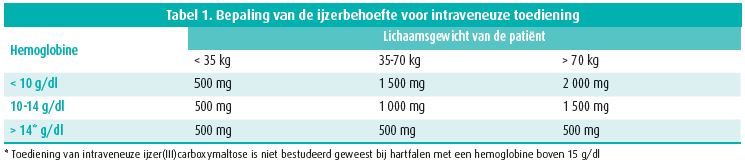
Wanneer we spreken over effectieve behandeling van ijzertekort binnen het hartfalensyndroom moeten we benadrukken dat therapie met intraveneus ijzer enkel werd getest bij hartfalenpatiënten met een verminderde ejectiefractie (LVEF < 45 %). De IRONOUT HF-studie heeft het effect van peroraal ijzer op maximale inspanningscapaciteit getest.21 Peroraal ijzer gaf geen verbetering van inspanningscapaciteit. De mechanistische substudie toonde aan dat peroraal ijzer geen stijging kan geven van het serumferritine of transferrinesaturatie (gezien hogere hepcidineconcentraties). Drie dubbelblind gerandomiseerde studies (FAIR-HF, CONFIRM-HF en EFFECT-HF) hebben in aggregaat aangetoond dat behandeling met intraveneus ijzer (ijzer(III)carboxymaltose) leidt tot een stijging van het serumferritine en transferrinesaturatie, wat zich vertaalt in een subjectieve verbetering van het dagelijks functioneren en een objectieve verbetering van de submaximale en maximale inspanningstolerantie.4-6 Dit ongeacht de aanwezigheid van anemie. Een meta-analyse van deze studies suggereert een bijkomende gunstig effect van reductie van het aantal hartfalenopnames.7 Momenteel zijn er vier internationale mortaliteits- en morbiditeitsstudies lopende met intraveneus ijzer die het effect in een degelijk gepowerde hartfalenpopulatie zal testen op het primaire eindpunt van hartfalenopname en cardiovasculaire dood. Tevens toont de meta-analyse dat toediening van ijzer(III)carboxymaltose perfect veilig is.7 Historisch gezien wordt toediening van intraveneus ijzer met een bepaalde voorzichtigheid benaderd in de meeste centra. Dat is gebaseerd op het voorkomen van anafylactische reacties met oudere preparaten van intraveneus ijzer. Het is echter belangrijk te benadrukken dat niet het ijzer zelf de anafylaxie kan veroorzaken, maar de zetmeelmantel die het ijzer omringt in het intraveneus preparaat. De nieuwe preparaten maken gebruik van een sucrose (Venofer©) of carboxymaltosemantel (injectafer©), die geen anafylaxie uitlokken. Praktisch gezien kan toediening van ijzer(III)carboxymaltose gebeuren via vlotte infusie (injectieduur < 15 min) en is slechts een beperkte hoeveelheid NaCl 0,9 % nodig om het ijzer op te lossen (bv. 1 000 mg in 250 cc NaCl 0,9 %, maximale verdunning mag niet de 2 mg/ml overschrijden). De dosis ijzer(III) carboxymaltose wordt berekend op basis van het gewicht en de hemoglobine (tabel 1). Een analyse van het ZOL Genk toont aan dat 62 % van de patiënten met hartfalen een dosis nodig heeft van meer dan 1 gram (gemiddeld 1,3 gram). Dat is belangrijk omdat de maximale toediening van intraveneuze ijzer(III)carboxymaltose voor één gift 1 gram per week is. Om het ijzertekort volledig aan te vullen zal een groot deel van de patiënten dus een vervolgvisite nodig hebben.
Referenties
- Ponikowski, P., Voors, A.A., Anker, S.D., Bueno, H., Cleland, J.G., Coats, A.J., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail, 2016, 18 (8), 891-975.
- Jankowska, E.A., von Haehling, S., Anker, S.D., Macdougall, I.C., Ponikowski, P. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J, 2013, 34 (11), 816-829.
- Swedberg, K., Young, J.B., Anand, I.S., Cheng, S., Desai, A.S., Diaz, R., et al. Treatment of anemia with darbepoetin alfa in systolic heart failure. N Engl J Med, 2013, 368 (13), 1210-1219.
- Anker, S.D., Comin, C.J., Filippatos, G., Willenheimer, R., Dickstein, K., Drexler, H., et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med, 2009, 361 (25), 2436-2448.
- Ponikowski, P., van Veldhuisen, D.J., Comin-Colet, J., Ertl, G., Komajda, M., Mareev, V., et al. Beneficial effects of longterm intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiencydagger. Eur Heart J, 2015, 36 (11), 657-668.
- van Veldhuisen, D.J., Ponikowski, P., van der Meer, P., Metra, M., Bohm, M., Doletsky, A., et al. Effect of Ferric Carboxymaltose on Exercise Capacity in Patients With Chronic Heart Failure and Iron Deficiency. Circulation, 2017, 136 (15), 1374-1383.
- Anker, S.D., Kirwan, B.A., van Veldhuisen, D.J., Filippatos, G., Comin-Colet, J., Ruschitzka, F., et al. Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data meta-analysis. Eur J Heart Fail, 2018, 20 (1), 125-133.
- Jankowska, E.A., Ponikowski, P. Molecular changes in myocardium in the course of anemia or iron deficiency. Heart Fail Clin, 2010, 6 (3), 295-304.
- Grote, B.N., Klip, I.T., Meijers, W.C., Voors, A.A., Vegter, E.L., van der Wal, H.H., et al. Definition of Iron Deficiency Based on the Gold Standard of Bone Marrow Iron Staining in Heart Failure Patients. Circ Heart Fail, 2018, 11 (2), e004519.
- Braunwald, E. Biomarkers in heart failure. N Engl J Med, 2008, 358 (20), 2148-2159.
- Sandek, A., Bauditz, J., Swidsinski, A., Buhner, S., Weber-Eibel, J., von Haehling, S., et al. Altered intestinal function in patients with chronic heart failure. J Am Coll Cardiol, 2007, 50 (16), 1561-1569.
- Martens, P., Minten, L., Dupont, M., Mullens, W. Prevalence of underlying gastrointestinal malignancies in iron-deficient heart failure. ESC Heart Fail, 2019, 6 (1), 37-44.
- Martens, P., Nijst, P., Verbrugge, F.H., Smeets, K., Dupont, M., Mullens, W. Impact of iron deficiency on exercise capacity and outcome in heart failure with reduced, mid-range and preserved ejection fraction. Acta Cardiol, 2017, 1-9.
- Hoes, M.F., Grote, B.N., Kijlstra, J.D., Kuipers, J., Swinkels, D.W., Giepmans, B.N.G., et al. Iron deficiency impairs contractility of human cardiomyocytes through decreased mitochondrial function. Eur J Heart Fail, 2018, 20 (5), 910-919.
- Neubauer, S. The failing heart--an engine out of fuel. N Engl J Med, 2007, 356 (11), 1140-1151.
- Haddad, S., Wang, Y., Galy, B., Korf-Klingebiel, M., Hirsch, V., Baru, A.M., et al. Iron-regulatory proteins secure iron availability in cardiomyocytes to prevent heart failure. Eur Heart J, 2017, 38 (5), 362-372.
- Martens, P., Dupont, M., Mullens, W. Cardiac iron deficiency-how to refuel the engine out of fuel. Eur J Heart Fail, 2018, 20 (5), 920-922.
- Martens, P., Verbrugge, F.H., Nijst, P., Dupont, M., Mullens, W. Limited contractile reserve contributes to poor peak exercise capacity in iron-deficient heart failure. Eur J Heart Fail, 2018, 20 (4), 806-808.
- Melenovsky, V., Hlavata, K., Sedivy, P., Dezortova, M., Borlaug, B.A., Petrak, J., et al. Skeletal Muscle Abnormalities and Iron Deficiency in Chronic Heart FailureAn Exercise (31)P Magnetic Resonance Spectroscopy Study of Calf Muscle. Circ Heart Fail, 2018, 11 (9), e004800.
- Martens, P., Verbrugge, F., Nijst, P., Dupont, M., Tang, W.H., Mullens W. Impact of Iron Deficiency on Response to and Remodeling After Cardiac Resynchronization Therapy. Am J Cardiol, 2017, 119 (1), 65-70.
- Lewis, G.D., Semigran, M.J., Givertz, M.M., Malhotra, R., Anstrom, K.J., Hernandez, A.F. et al. Oral Iron Therapy for Heart Failure With Reduced Ejection Fraction: Design and Rationale for Oral Iron Repletion Effects on Oxygen Uptake in Heart Failure. Circ Heart Fail, 2016, 9 (5), pii: e000345. doi: 10.1161/ CIRCHEARTFAILURE.115.000345.
Financiële ondersteuning: Pieter Martens en Wilfried Mullens zijn onderzoekers verbonden aan het Limburg Clinical Research Program (LCRP) UHasselt-ZOL-Jessa, met financiële steun van Limburg Sterk Merk (LSM), Universiteit Hasselt, Ziekenhuis Oost-Limburg en Jessa Ziekenhuis. Pieter Martens is consultant voor Vifor Pharma. Wilfried Mullens en Pieter Martens hebben een unrestricted research grant ontvangen van Vifor Pharma.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.