Introduction
Les comorbidités non cardiaques sont fréquentes dans le syndrome d'insuffisance cardiaque, et elles ont un impact important sur le pronostic de la maladie.1 Cependant, on ne sait pas si le moins bon pronostic prédit par une comorbidité est simplement l'expression d'une maladie avancée, ou si c'est la comorbidité elle-même qui a un impact négatif direct sur l'évolution de la maladie. à cet égard, l'anémie et la carence martiale sont souvent traitées conjointement en tant que comorbidités. Elles sont toutes deux fréquentes dans le syndrome d'insuffisance cardiaque et prédisent une diminution de la tolérance à l'effort et un risque accru d'hospitalisation pour insuffisance cardiaque et de mortalité.2 Toutefois, la preuve ultime de l'existence d'une contribution négative directe de la comorbidité provient des études randomisées. Ici, on teste l'effet de la suppression de la comorbidité sur l'amélioration du pronostic de la maladie. Ainsi, l'étude RED-HF montre que l'érythropoïétine peut réduire l'anémie, mais que cela ne se traduit pas par une meilleure tolérance à l'effort ni par une diminution des hospitalisations pour insuffisance cardiaque et de la mortalité cardiaque.3 Par contre, le traitement de la carence martiale au moyen de fer(III)carboxymaltose intraveineux (Injectafer©) montre bien une amélioration de la fonctionnalité dans les études FAIR-HF, CONFIRM-HF et EFFECT-HF.4-6 Par ailleurs, une méta-analyse de ces dernières études suggère que le traitement par fer(III)carboxymaltose peut également réduire les hospitalisations pour insuffisance cardiaque.7 Lors de cette session présentée durant la 38ème réunion de la BSC, on a traité de l'impact physiopathologique de la carence martiale, de sa prévalence et de son traitement en cas d'insuffisance cardiaque.
Développement et fréquence de la carence martiale en cas d'insuffisance cardiaque
Le fer est un cofacteur essentiel dans diverses voies énergétiques et antioxydantes de l'organisme.8 Tant la carence martiale qu'une surcharge en fer sont néfastes. étant donné que le fer libre dans l'organisme peut provoquer des réactions de Fenton (formation de radicaux libres), l'absorption du fer au départ de l'alimentation et son transport dans l'organisme sont fortement régulés au niveau évolutionnaire. Le transport du fer dans la circulation sanguine est assuré par la transferrine, capable de lier deux ions ferriques. Le stockage intracellulaire (par exemple dans les cardiomyocytes ou le système réticulo-endothélial) est assuré par la ferritine, qui peut lier jusqu'à 4 500 ions ferriques. La ferritine est également partiellement sécrétée dans la circulation sanguine. De ce fait, la ferritine sérique est un indicateur des réserves totales de fer dans l'organisme.9 En cas d'inflammation, le foie produit une hormone appelée hepcidine, qui se lie à la ferroportine, de sorte que la quantité de fer libérée dans la circulation sanguine par les entérocytes est moindre et que le fer demeure également couplé à la ferritine dans le système réticulo-endothélial (figure 1). Le syndrome d'insuffisance cardiaque perturbe fortement la régulation du fer dans l'organisme. Tant la réduction du débit cardiaque que l'augmentation des pressions de remplissage sont des anomalies hémodynamiques prototypiques qui peuvent caractériser le syndrome d'insuffisance cardiaque.10, 11 Cependant, toutes deux donnent lieu à la production de cytokines pro-inflammatoires et d'hepcidine. Des taux élevés d'hepcidine en cas d'insuffisance cardiaque peuvent entraîner une séquestration du fer dans le système réticulo-endothélial, le rendant indisponible pour les cardiomyocytes et les muscles squelettiques (carence martiale fonctionnelle). Toutefois, l'insuffisance cardiaque est également souvent caractérisée par un oedème intestinal, une diminution de l'appétit ou l'utilisation chronique d'anticoagulants, ce qui entraîne une perte intestinale de fer (carence martiale absolue).12
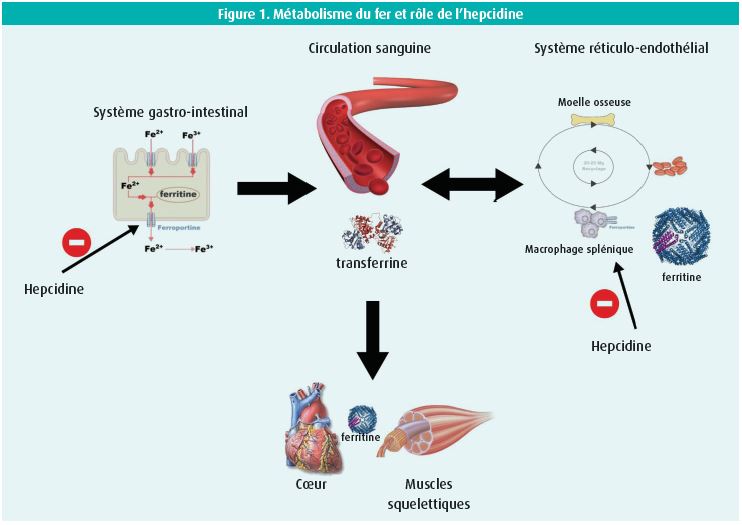
étant donné les différents mécanismes qui peuvent entraîner une carence en fer, la définition de la carence martiale dans l'insuffisance cardiaque est relativement large, comparativement aux autres disciplines médicales. La définition courante de la carence martiale dans l'insuffisance cardiaque est une ferritine sérique < 100 μg/l, quelle que soit la saturation de la transferrine, ou une ferritine sérique entre 100 et 300 μg/l si la saturation de la transferrine est inférieure à 20 %. à cet égard, une ferritine sérique très basse peut être interprétée comme une forme de carence martiale absolue, tandis qu'une ferritine sérique plus élevée (entre 100 et 300 μg/l) avec une saturation de la transferrine basse indique une carence martiale fonctionnelle.1 Cependant, on n'a pas décrit de valeurs officielles claires pour la carence martiale fonctionnelle et absolue.9 Dans la mise au point d'une carence martiale, il est plus important de réaliser qu'une ferritine basse peut traduire la présence d'affections intestinales malignes sous-jacentes.12 Cependant, en pratique clinique, l'utilisation de la définition susmentionnée de la carence martiale permet d'identifier une population de patients présentant un risque accru de limitations fonctionnelles et un risque d'hospitalisation pour insuffisance cardiaque. Une étude portant sur 1 207 patients souffrant d'insuffisance cardiaque, suivis dans l'unité d'insuffisance cardiaque du Ziekenhuis Oost Limburg (ZOL Genk) montre que la prévalence globale de la carence martiale atteint 53 %.13 De manière générale, les femmes, les patients prenant des anticoagulants et ceux qui se trouvent en classe NYHA supérieure souffrent le plus souvent d'une carence en fer. La carence martiale se rencontre également avec une prévalence élevée en cas d'insuffisance cardiaque à fraction d'éjection réduite, 'mid-range' et préservée.13
Conséquences néfastes de la carence martiale sur le syndrome d'insuffisance cardiaque
Le fer est un cofacteur essentiel des trois premiers complexes de la chaîne de transport d'électrons, qui régule la production d'ATP par phosphorylation oxydative.14 Le coeur est par excellence un des organes ayant les besoins métaboliques les plus élevés, et il consomme quotidiennement 6 kg d'ATP. Il est bien décrit que l'insuffisance cardiaque est caractérisée par une diminution de la réserve d'ATP (et de phosphocréatine).15 Les études cellulaires et animales montrent que la carence martiale induit une réduction de la respiration mitochondriale cardiaque avec une diminution de la réserve d'ATP, de sorte qu'il y a trop peu d'ATP/phosphocréatine pour répondre aux besoins métaboliques pendant la systole (principalement la liaison actine-myosine) et la diastole (principalement le tampon calcium).14, 16, 17 Ces anomalies deviennent surtout cliniquement significatives à l'effort, lorsque la demande énergétique des cardiomyocytes augmente pour soutenir la fonction systolique et diastolique.18 Une étude hémodynamique invasive conduite au ZOL Genk démontre que ces résultats précliniques sont également pertinents en clinique. Les patients souffrant d'insuffisance cardiaque avec une diminution de la fraction d'éjection et une carence martiale présentent en l'occurrence une réserve contractile réduite à l'effort, comparativement aux patients souffrant d'insuffisance cardiaque mais sans carence en fer.18 Par ailleurs, une étude de Melenovsky montre que les conséquences de la carence martiale ne se limitent pas aux cardiomyocytes. Les muscles squelettiques des patients souffrant d'insuffisance cardiaque et de carence martiale présentent également une diminution plus rapide des réserves énergétiques et une acidification précoce pendant l'effort.19 Tout ceci explique très bien la diminution de la tolérance à l'effort constatée dans les études observationnelles (diminution de la distance au test de marche de 6 minutes et de la VO2-max).13 En outre, le fer est un cofacteur important pour les enzymes antioxydantes. Une diminution de l'activité de ces enzymes est associée à un remodelage cardiaque progressif dans les études animales. Ce dernier aspect est également important en pratique clinique, étant donné que les patients souffrant d'insuffisance cardiaque et d'une carence martiale ont une 'réponse de remodelage inverse' réduite aux traitements établis de l'insuffisance cardiaque.20
Le traitement de la carence martiale en cas d'insuffisance cardiaque
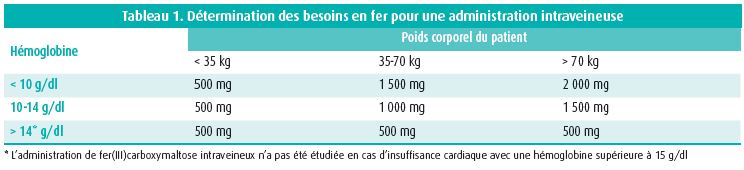
Lorsqu'on parle de traitement efficace de la carence martiale dans le cadre du syndrome d'insuffisance cardiaque, il convient de souligner que le traitement par fer intraveineux n'a été testé que chez des patients souffrant d'insuffisance cardiaque à fraction d'éjection réduite (FEVG < 45 %). L'étude IRONOUT-HF a testé l'effet du fer oral sur la capacité maximale à l'effort.21 Le fer oral n'a pas amélioré la capacité à l'effort. La sous-étude mécanistique a montré que le fer oral ne peut pas augmenter la ferritine sérique ni la saturation de la transferrine (étant donné les taux d'hepcidine plus élevés). Trois études randomisées en double aveugle (FAIR-HF, CONFIRM-HF et EFFECT-HF) ont montré ensemble que le traitement par fer intraveineux (fer(III)carboxymaltose) entraîne une augmentation de la ferritine sérique et de la saturation de la transferrine, ce qui se traduit par une amélioration subjective du fonctionnement quotidien et une amélioration objective de la tolérance à l'effort sous-maximal et maximal, et ceci indépendamment de la présence éventuelle d'une anémie.4-6 Une méta-analyse de ces études suggère un effet bénéfique supplémentaire de la réduction du nombre d'hospitalisations pour insuffisance cardiaque.7 Actuellement, quatre études internationales de morbi-mortalité ayant la puissance statistique nécessaire sont en cours avec du fer intraveineux. Elles testeront l'effet, dans une population adéquate souffrant d'insuffisance cardiaque, sur le critère d'évaluation primaire d'hospitalisation pour insuffisance cardiaque et de mortalité cardiovasculaire. La méta-analyse montre par ailleurs que l'administration de fer(III)carboxymaltose est parfaitement sûre.7 Historiquement, l'administration de fer intraveineux suscite des réticences dans la plupart des centres, en raison de réactions anaphylactiques avec les préparations de fer intraveineux plus anciennes. Cependant, il est important de souligner que ce n'est pas le fer luimême qui peut provoquer l'anaphylaxie, mais l'enveloppe d'amidon qui entoure le fer dans la préparation intraveineuse. Les nouvelles préparations utilisent du saccharose (Venofer©) ou une enveloppe de carboxymaltose (Injectafer©), qui ne provoquent pas d'anaphylaxie. Concrètement, le fer(III)carboxymaltose peut être administré par perfusion rapide (durée < 15 min) et il ne faut que très peu de NaCl 0,9 % pour dissoudre le fer (par exemple 1 000 mg dans 250 cc de NaCl 0,9 %, la dilution maximale ne pouvant pas dépasser 2 mg/ml). La dose de fer(III)carboxymaltose est calculée sur la base du poids et de l'hémoglobine (tableau 1). Une analyse du ZOL Genk démontre que 62 % des patients souffrant d'insuffisance cardiaque ont besoin d'une dose supérieure à 1 gramme (1,3 gramme en moyenne). Ceci est important, car l'administration maximale de fer(III)carboxymaltose par voie intraveineuse par séance est de 1 gramme par semaine. Une grande partie des patients auront donc besoin de plusieurs administrations pour compenser totalement leur carence en fer.
Références
- Ponikowski, P., Voors, A.A., Anker, S.D., Bueno, H., Cleland, J.G., Coats, A.J., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail, 2016, 18 (8), 891-975.
- Jankowska, E.A., von Haehling, S., Anker, S.D., Macdougall, I.C., Ponikowski, P. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J, 2013, 34 (11), 816-829.
- Swedberg, K., Young, J.B., Anand, I.S., Cheng, S., Desai, A.S., Diaz, R., et al. Treatment of anemia with darbepoetin alfa in systolic heart failure. N Engl J Med, 2013, 368 (13), 1210-1219.
- Anker, S.D., Comin, C.J., Filippatos, G., Willenheimer, R., Dickstein, K., Drexler, H., et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med, 2009, 361 (25), 2436-2448.
- Ponikowski, P., van Veldhuisen, D.J., Comin-Colet, J., Ertl, G., Komajda, M., Mareev, V., et al. Beneficial effects of longterm intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiencydagger. Eur Heart J, 2015, 36 (11), 657-668.
- van Veldhuisen, D.J., Ponikowski, P., van der Meer, P., Metra, M., Bohm, M., Doletsky, A., et al. Effect of Ferric Carboxymaltose on Exercise Capacity in Patients With Chronic Heart Failure and Iron Deficiency. Circulation, 2017, 136 (15), 1374-1383.
- Anker, S.D., Kirwan, B.A., van Veldhuisen, D.J., Filippatos, G., Comin-Colet, J., Ruschitzka, F., et al. Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data meta-analysis. Eur J Heart Fail, 2018, 20 (1), 125-133.
- Jankowska, E.A., Ponikowski, P. Molecular changes in myocardium in the course of anemia or iron deficiency. Heart Fail Clin, 2010, 6 (3), 295-304.
- Grote, B.N., Klip, I.T., Meijers, W.C., Voors, A.A., Vegter, E.L., van der Wal, H.H., et al. Definition of Iron Deficiency Based on the Gold Standard of Bone Marrow Iron Staining in Heart Failure Patients. Circ Heart Fail, 2018, 11 (2), e004519.
- Braunwald, E. Biomarkers in heart failure. N Engl J Med, 2008, 358 (20), 2148-2159.
- Sandek, A., Bauditz, J., Swidsinski, A., Buhner, S., Weber-Eibel, J., von Haehling, S., et al. Altered intestinal function in patients with chronic heart failure. J Am Coll Cardiol, 2007, 50 (16), 1561-1569.
- Martens, P., Minten, L., Dupont, M., Mullens, W. Prevalence of underlying gastrointestinal malignancies in iron-deficient heart failure. ESC Heart Fail, 2019, 6 (1), 37-44.
- Martens, P., Nijst, P., Verbrugge, F.H., Smeets, K., Dupont, M., Mullens, W. Impact of iron deficiency on exercise capacity and outcome in heart failure with reduced, mid-range and preserved ejection fraction. Acta Cardiol, 2017, 1-9.
- Hoes, M.F., Grote, B.N., Kijlstra, J.D., Kuipers, J., Swinkels, D.W., Giepmans, B.N.G., et al. Iron deficiency impairs contractility of human cardiomyocytes through decreased mitochondrial function. Eur J Heart Fail, 2018, 20 (5), 910-919.
- Neubauer, S. The failing heart--an engine out of fuel. N Engl J Med, 2007, 356 (11), 1140-1151.
- Haddad, S., Wang, Y., Galy, B., Korf-Klingebiel, M., Hirsch, V., Baru, A.M., et al. Iron-regulatory proteins secure iron availability in cardiomyocytes to prevent heart failure. Eur Heart J, 2017, 38 (5), 362-372.
- Martens, P., Dupont, M., Mullens, W. Cardiac iron deficiency-how to refuel the engine out of fuel. Eur J Heart Fail, 2018, 20 (5), 920-922.
- Martens, P., Verbrugge, F.H., Nijst, P., Dupont, M., Mullens, W. Limited contractile reserve contributes to poor peak exercise capacity in iron-deficient heart failure. Eur J Heart Fail, 2018, 20 (4), 806-808.
- Melenovsky, V., Hlavata, K., Sedivy, P., Dezortova, M., Borlaug, B.A., Petrak, J., et al. Skeletal Muscle Abnormalities and Iron Deficiency in Chronic Heart FailureAn Exercise (31)P Magnetic Resonance Spectroscopy Study of Calf Muscle. Circ Heart Fail, 2018, 11 (9), e004800.
- Martens, P., Verbrugge, F., Nijst, P., Dupont, M., Tang, W.H., Mullens W. Impact of Iron Deficiency on Response to and Remodeling After Cardiac Resynchronization Therapy. Am J Cardiol, 2017, 119 (1), 65-70.
- Lewis, G.D., Semigran, M.J., Givertz, M.M., Malhotra, R., Anstrom, K.J., Hernandez, A.F. et al. Oral Iron Therapy for Heart Failure With Reduced Ejection Fraction: Design and Rationale for Oral Iron Repletion Effects on Oxygen Uptake in Heart Failure. Circ Heart Fail, 2016, 9 (5), pii: e000345. doi: 10.1161/ CIRCHEARTFAILURE.115.000345.
Soutien financier : Pieter Martens et Wilfried Mullens sont des chercheurs attachés au Limburg Clinical Research Program (LCRP) UHasselt-ZOL-Jessa, avec un soutien financier de Limburg Sterk Merk (LSM), de l'Université d'Hasselt, du Ziekenhuis Oost-Limburg et du Jessa Ziekenhuis. Pieter Martens est consultant pour Vifor Pharma. Wilfried Mullens et Pieter Martens ont reçu une bourse de recherche sans restrictions de Vifor Pharma.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.