Inleiding
Hartfalen (HF) is een courante, ernstige en levensbedreigende ziekte die epidemische proporties heeft aangenomen de laatste decennia. Er wordt geschat dat ongeveer 6,5 miljoen volwassenen in de Verenigde Staten HF heeft, met een te verwachten aantal van 8,5 miljoen in 20301-5. Bij ongeveer 670 000 mensen wordt elk jaar HF gediagnosticeerd, en globaal heeft ongeveer 2 % van de populatie HF; 20 % van hen wordt jaarlijks gehospitaliseerd. Het is de voornaamste doodsoorzaak bij ouderen boven de 65 jaar. Het risico op HF gedurende het leven is ongeveer 1 op de 5, en dat is vooral te verklaren door een toegenomen prevalentie van de meest voorkomende risicofactoren (arteriële hypertensie, coronaire hartziekte en diabetes). Daarnaast blijven de overlevingscijfers van HF laag want de mortaliteit blijft schommelen rond de 50 % binnen de vijf jaar na de eerste hospitalisatie voor HF! Dit is dus een dure chronische ziekte. Het hoge aantal hospitalisaties leidt tot een massieve druk op de financiering van de gezondheidszorg6, in de VS geschat op jaarlijks ongeveer 31 miljard dollar (inclusief HF-zorg, medicatie en ziekteverzuim)7, 8. Ook al was er een merkbare verbetering in de behandeling van HF de laatste 20 jaar, met nieuwe medicatie, devices, interventies en duidelijke behandelingsrichtlijnen; toch is de HF-zorg nog steeds suboptimaal met onverantwoord hoge mortaliteitscijfers6.
Medicatie als hoeksteen van de behandeling van HF, maar te weinig voorgeschreven
HF-medicatie (bètablokkers, ACE-inhibitoren, sartanen, mineralocorticoïdantagonisten en vrij recent ook sacubitril valsartan) vormen dé hoeksteen van de behandeling van HF, althans HFrEF (hartfalen met gereduceerde ejectiefractie van het linkerventrikel, LVEF < 40 %). Een correct gebruik van de bestaande medicatie zou al bijdragen tot een verbetering van de prognose voor de patiënt, met minder adverse events en een lagere mortaliteit, alsook lagere kosten voor de gezondheidszorg9, 10. Toch worden niet aan alle HFrEF-patiënten de correcte medicatie in een adequate dosis voorgeschreven. Het blijkt uit verschillende databases dat vele HF-patiënten niet de - nochtans geïndiceerde - medicatie krijgen en al zeker niet in de aanbevolen 'targetdosis'. Zo blijkt bijvoorbeeld uit QUALIFY, een recente grote internationale prospectieve studie die de adherentie aan de ESC-richtlijnen bij artsen onderzocht, dat 87,2 %, 86,7 % en 69,3 % van de HFrEF-patiënten respectievelijk een ACEi/ARB, een bètablokker, en een MRA kregen voorgeschreven. Bij de voornaamste redenen waarom een ACEi/ARB en een MRA niet werden voorgeschreven, was nierinsufficiëntie en hyperkaliëmie vaak de gerapporteerde verklaring11. Gelijkaardige bevindingen werden genoteerd in de BIOSTAT-CHF-studie, die specifiek peilde naar de mogelijkheid tot het opdrijven van ACEi/ARB in 2 100 HFrEF-patiënten12. Wanneer we de data van het CHAMP-HF-register vergelijken met deze van de 10 jaar oudere IMPROVE-HF-database, dan stellen we vast dat MRA's in HF nog steeds in minder dan 40 % van de gevallen worden voorgeschreven en dat er zelfs een dalende trend is van het gebruik van ACEi/ARB en bètablokkers ten opzichte van een decade geleden13, 14! In het CHECK-HF-register (5 701 HFrEF-patiënten in Nederland) werd gezien dat 81 % diuretica kreeg, 84 % ACEi/ARB, 86 % bètablokkers en (slechts) 56 % MRA's; maar belangrijker: een meerderheid van deze patiënten kreeg niet de aanbevolen targetdosis van de voornoemde medicatie15. Een van de redenen daarvoor was, zoals eerder gezegd, nierinsufficiëntie en hyperkaliëmie.
Hyperkaliëmie: definitie en gevolgen
Hyperkaliëmie wordt doorgaans gedefinieerd als een serumkalium van meer dan 5,0 mEq/L of 5,0 mmol/L16, 17. Soms wordt een subclassificatie ingevoerd, met name milde (5,0-5,5 mEq/L), matige (5,5- 6,0 mEq/L) en ernstige (> 6,5 mEq/L) hyperkaliëmie. Het serumkalium kan vrij snel en onverwacht stijgen en dat specifieke fenomeen gebeurt meer in hoogrisicopopulaties zoals patiënten met een cardiorenaal dilemma18. De presentatie is vaak totaal asymptomatisch tot op het ogenblik dat er ernstige gevolgen zijn, met name levensbedreigende hartritmestoornissen. Er kunnen klassieke ecg-veranderingen optreden (bradycardie, repolarisatiestoornissen …) maar deze zijn niet steeds aanwezig. Soms hebben patiënten klachten van spierzwakte, 'twitching' (spiertrekkingen of fasciculaties), ernstige krampen, of paralyse. Mogelijk is er ook een verband tussen het ontstaan van hyperkaliëmie en neuropathie bij patiënten met chronisch nierlijden, maar dit wordt nog verder onderzocht.
Hyperkaliëmie als oorzaak van het niet opstarten, stoppen, of afbouwen van RAAS-inhibitie
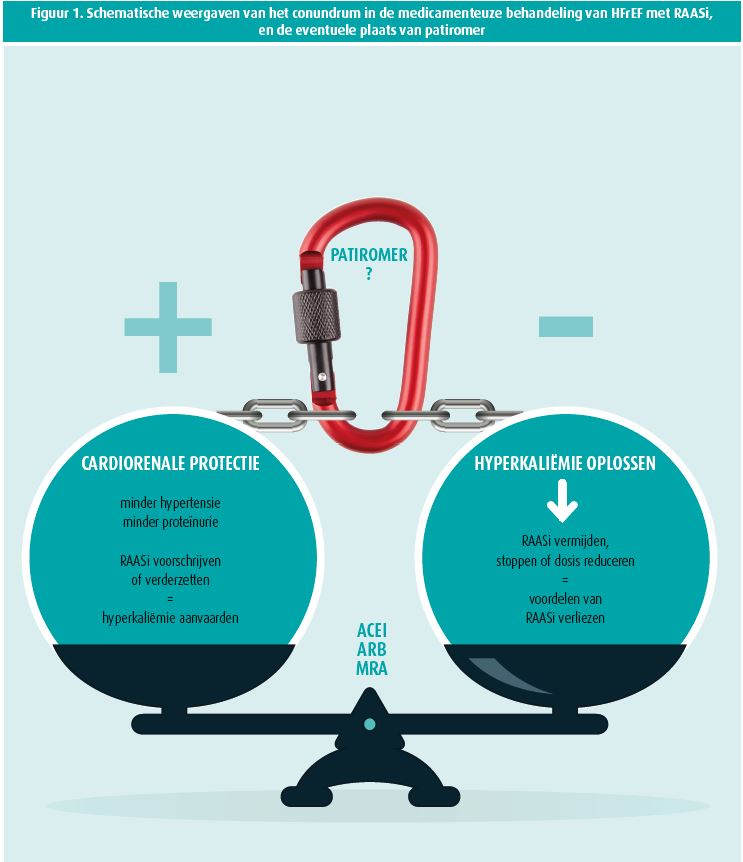
Grosso modo worden HF-specialisten vaak geconfronteerd met het volgende dilemma: het voorschrijven van RAASi is cardio- en nefroprotectief en verbetert de mortaliteit. Moeten we de aanwezigheid van hyperkaliëmie aanvaarden, of de oorzakelijke therapie afbouwen maar dan de voordelen van RAAS-inhibitie verliezen (figuur 1)? RAASi hebben aangetoond dat ze de mortaliteit in HF-patiënten verlagen, antihypertensief werken, de nieren beschermen en progressie naar eindstadium nierfalen verminderen, en ook proteïnurie verminderen. Daarnaast echter verhoogt wel degelijk het risico op hyperkaliëmie bij het gebruik van RAASi16, 17. In de cohortstudie van Chang en medewerkers werd aangetoond dat in 3 582 patiënten van de 155 695 een episode van hyperkaliëmie optrad (5,5 mEq/L of meer) en dat in 24,3 % van die gevallen de medicatie werd gestopt; slechts in 4,8 % van de gevallen werd een dosisreductie doorgevoerd. Overigens was het zo dat een dosisreductie of onderbreking meer voorkwam bij patiënten met een specifieke RAASi-indicatie, zoals de HF-patiënt19 en dus minder bij patiënten die de medicatie namen louter voor bloeddrukcontrole. Naast deze vaststellingen is het ook frappant dat hyperkaliëmie veel meer voorkomt in reallifedata dan in gerandomiseerde klinische studies. Zo werd in de RALES-20 en de EMPHASIS-studie21, 22 een hyperkaliëmie-incidentie van ongeveer 2 % genoteerd, terwijl reallifestudies een veel groter percentage van hyperkaliëmie tonen bij gebruik van spironolacton, nl. 6 % in de studie van Shah22 en 12 % in de studie van Bozkurt23. In het geval van ernstige hyperkaliëmie is er ook een duidelijke exponentiële toename van de mortaliteit bij patiënten met chronische nierinsufficiëntie16.
De medicamenteuze langetermijnsbehandeling van 'chronische' hyperkaliëmie'
De acute behandeling van een symptomatische hyperkaliëmie (bijvoorbeeld een patiënt met ritmestoornissen) wordt hier buiten beschouwing gelaten, een adequate beschrijving van de behandelingsopties is te vinden in de publicatie van Dunn24.
Voor wat betreft de chronische behandeling van hyperkaliëmie bestaat de mogelijkheid om RAASi te stoppen of een dosisreductie door te voeren. Als het serumkalium voorafgaand aan de vooropgestelde behandeling hoger is van 5,0 mmol/L, dan stellen de richtlijnen van de ACCF/AHA en NICE voor om geen behandeling op te starten in CKD- of HF-patiënten25. Als het kalium hoger is dan 6 mmol/L dan wordt geadviseerd om helemaal geen RAASi te starten bij eender wie, of desgevallend RAASi volledig te stoppen. De KDOQI-richtlijnen voor chronische nierinsufficiëntie adviseren om bij een kalium tussen 5,1 en 5,5 mmol/L simultaan een kaliumverlagende behandeling op te starten op het ogenblik dat er een strikte indicatie is voor RAASi26.
De geneesmiddelen voor de behandeling van hyperkaliëmie in België zijn de zogenaamde 'resines' of kaliumchelatoren. Het zijn polystyreensulfonaten (gesulfoneerd benzeen-diethenylpolymeren) die chemisch gelinkt zijn aan calcium of natrium. Deze kationuitwisselaars ruilen calcium- of natriumionen in voor de kaliumionen die zich in de maagdarmtractus bevinden (via vocht- en voedselinname) en verminderen aldus de transmucosale absorptie van kalium. Deze polystyreensulfaten worden het best bij elke maaltijd ingenomen, bijvoorbeeld 3 maal per dag. Een evidente maar niet onbelangrijke problematiek van deze producten is dat er een hypercalciëmie of hypernatriëmie kan ontstaan, iets wat absoluut te vermijden is, en zeker bij de HF-patiënt. Klassieke nevenwerkingen zijn gastro-intestinale last, nl. een opgeblazen gevoel al dan niet gepaard gaande met constipatie. De slechte smaak van deze producten leidt er vaak toe dat de therapietrouw bij de patiënt beperkt is.
The new kid on the block: patiromer
Patiromer is een nieuwe kaliumbinder die recent in België op de markt kwam en gevalideerd is in een ruim aantal klinische studies. Het product is sferisch van structuur en bevat sterk gecrosslinkte polymeren. Door de sferische structuur met een diameter van om en bij de 100 micron is er nooit systemische absorptie aangetoond in dierexperimenteel onderzoek27. Patiromer heeft een hoge bindingscapaciteit voor kalium, nl. 8,5 tot 8,8 mEq per gram polymeer, bij een fysiologische pH. Patiromer werkt vooral ter hoogte van het colon, de plaats in het lichaam waar er het meest kaliumabsorptie en -excretie is. Belangrijk te vermelden is ook dat patiromer enkel kaliumionen uitwisselt voor calciumionen, en niet voor natrium27, wat een klein voordeel is bij HF-patiënten. Patiromer beladen met kaliumionen wordt vlot in de stoelgang uitgescheiden. Momenteel is het geïndiceerd voor de behandeling van hyperkaliëmie bij volwassenen, zowel in de VS als in Europa.
De efficiëntie en veiligheid van patiromer werd aangetoond in een aantal klinische studies. De eerste studie, PEARL-HF, was een fase-II dubbelblinde studie om de efficiëntie van patiromer te onderzoeken bij patiënten met chronisch HF die reeds standaardtherapie kregen en bij wie spironolacton werd geïnitieerd28. In AMETHYST-DN, eveneens een fase-II-studie, werd de langetermijnsefficiëntie van patiromer bekeken bij patiënten met chronische nierinsufficiëntie en hyperkaliëmie29. Verder werd ook nog de OPAL-HK-studie uitgevoerd, een fase-III-studie die de activiteit van patiromer bestudeerde om normokaliëmie te bewerkstelligen bij CKD-patiënten30 31. Tot slot zijn er nog een aantal studies die de interactie van patiromer met voeding of met andere medicatie bestudeerd hebben32, 33.
De PEARL-HF-studie, een studie van Pitt en medewerkers, werd reeds gepubliceerd in 2011. In deze prospectieve gerandomiseerde dubbelblinde studie werden patiënten geïncludeerd met chronisch HF met een indicatie voor spironolacton maar ook met een kalium van 4,3-5,1 mEq/L en chronische nierinsufficiëntie met GFR < 60 mL/min of met hyperkaliëmie die in het verleden had geleid tot het onderbreken van een MRA of ACEi/ARB 6 maanden voor de baselinevisite. In deze studie, met een duurtijd van slechts 28 dagen, werd gezien dat spironolacton in 91 % van de patiromerpatiënten kon opgedreven worden, in vergelijking met slechts 74 % in de placebogroep. Overigens was er in de patiromergroep slechts in 7 % van de gevallen hyperkaliëmie, terwijl dit in de placebogroep 25 % was. Deze resultaten toonden dus aan dat patiromer hyperkaliëmie kan voorkomen in HF-patiënten, bij wie de dosis MRA dan ook beter opgedreven kan worden, wat vermoedelijk implicaties heeft op de overleving28.
In AMETHYST-DN werden patiënten een volledig jaar gevolgd. Het betrof patiënten met diabetes mellitus type II en CKD, al dan niet met hypertensie, die reeds RAASi kregen sinds minimaal 1 maand voor studiescreening. In de behandelingsfase werden de patiënten die hyperkaliëmie ontwikkelden op RAASi gerandomiseerd naar patiromer 4,2; 8,4; 12,6 of 16,8 g tweemaal daags versus placebo. De doelstelling was een kalium van < 5,0 mmol/L of minder bereiken en patiromer werd daarvoor desgevallend getitreerd. In de groep met milde hyperkaliëmie was het gemiddeld kalium 5,2 mEq/L, en in de groep met matige hyperkaliëmie 5,7 mEq/L. De resultaten van de studie toonden voor elke dosis patiromer een significante daling van het kalium al vanaf 48 u na de start van de behandeling (p < 0,001). De patiënten hadden ook een duurzame kaliumdaling gedurende de volledige studieduur (p < 0,001). Na het beëindigen van de studie, en bij het stoppen van de behandeling, steeg het kalium opnieuw ten laatste 72 u na het stoppen van de medicatie29. Er waren tijdens deze studie geen ernstige nevenwerkingen.
In OPAL-HK werden stadium 3-4 CKD-patiënten geïncludeerd met een kalium van > 5,1 - < 6,5 mmol/L die minimum 1 maand RAASi kregen. Er was een significante daling van het serumkalium in de patiromergroep van gemiddeld 1,01 mmol/L na week 4 (p < 0,001), en de medicatie werd goed verdragen. De meest significante nevenwerkingen waren constipatie (11 %), diarree (3 %), misselijkheid (3 %), en hypomagnesiëmie (3 %). Er waren geen ernstige bijwerkingen die konden gelinkt worden aan de behandeling. Daarenboven kon zeer duidelijk aangetoond worden dat bij veel minder patiënten met patiromer t.o.v. placebo een reductie in RAASi, of zelfs een complete onderbreking, noodzakelijk was. Het bleek dan ook op het einde van de studie dat aanzienlijk meer patiënten onder patiromer nog RAASi kregen dan in de placebogroep31.
Terugbetalingscriteria voor patiromer in België
Voor een eerste aanvraag tot - en een verlenging van - terugbetaling kan het attest enkel ingevuld worden door een internist met bijzondere bekwaming in de nefrologie. Cardiologen kunnen het product vooralsnog niet als 'initiatiefnemende arts' voorschrijven. Goede communicatie met de nefroloog is aldus essentieel. Overigens is de terugbetaling momenteel tijdelijk en gebeurt de komende jaren een herevaluatie.
De voorwaarden tot terugbetaling zijn:
- één of meerdere van de volgende: diabetes mellitus, congestief HF, proteïnurie;
- EN chronisch nierlijden stadium 3 of 4 met een eGFR tussen 15-60 mL/min;
- EN recidiverende hyperkaliëmie (> 5,1 mEq/L) sinds de behandeling met RAASi ondanks kaliumarm dieet en correctie van metabole acidose;
- EN onvoldoende effect van lisdiuretica indien klinisch geïndiceerd;
- EN de klinisch noodzakelijk posologie van RAASi kan niet gegeven worden vanwege recidiverende hyperkaliëmie.
Naast een nog aantal mineure voorwaarden vermeld in het formulier wordt, als aan alle criteria voldaan is, een terugbetaling voorzien voor 6 maanden waarna een verlenging aangevraagd kan worden. Het is niet uitgesloten dat er in de toekomst wijzigingen aangebracht worden in deze criteria, rekening houdend met een nieuwe studie die zal starten, met name de DIAMOND-HF-studie. Deze studie rekruteert patiënten met chronisch HF en hyperkaliëmie om na te gaan of de langetermijnsuitkomst verbetert in deze groep dankzij patiromer (omdat door de kaliumbinder de RAASi beter opgedreven kan worden). De resultaten worden verwacht in 2022 en een aantal Belgische centra zal patiënten in deze studie includeren.
Besluit en toekomstperspectief
HF is een ernstige chronische aandoening met hoge morbiditeit en mortaliteit, en hoge ziektekosten. De hoeksteen van de behandeling van HFrEF blijft medicatie, al wordt deze vaak onvoldoende opgedreven en gecombineerd. Hiervoor zijn meerdere verklaringen, maar een van de oorzaken is hyperkaliëmie. Patiromer is een effectief middel om hyperkaliëmie te behandelen en biedt perspectieven om de behandeling van HF-patiënten te verbeteren. Studies zullen moeten uitwijzen of een consciëntieuze aanpak op dit vlak ook een mortaliteitsvoordeel genereert.
Referenties
- Correction to: Heart Disease and Stroke Statistics- 2018 Update: A Report From the American Heart Association. Circulation, 2018, 137 (12), e493.
- Benjamin, E.J., Virani, S.S., Callaway, C.W., Chamberlain, A.M., Chang, A.R., Cheng, S., et al. Heart Disease and Stroke Statistics-2018 Update: A Report From the American Heart Association. Circulation, 2018, 137 (12), e67-e492.
- Cowie, M.R., Anker, S.D., Cleland, J.G.F., Felker, G.M., Filippatos, G., Jaarsma, T., et al. Improving care for patients with acute heart failure: before, during and after hospitalization. ESC Heart Fail, 2014, 1 (2), 110-145.
- Hall, M.J., Levant, S., DeFrances, C.J. Hospitalization for congestive heart failure: United States, 2000-2010. NCHS Data Brief, 2012, 108, 1-8.
- Ruppar, T.M., Cooper, P.S., Mehr, D.R., Delgado, J.M., Dunbar-Jacob, J.M. Medication Adherence Interventions Improve Heart Failure Mortality and Readmission Rates: Systematic Review and Meta-Analysis of Controlled Trials. J Am Heart Assoc, 2016, 5 (6), 5:e002606.
- Oktay, A.A., Rich, J.D., Shah, S.J. The emerging epidemic of heart failure with preserved ejection fraction. Curr Heart Fail Rep, 2013, 10 (4), 401-410.
- Improving care for patients with acute heart failure: before, during and after hospitalization 2014 [Available from: http://www. oxfordhealthpolicyforum.org/reports/acuteheart- failure/improving-care-for-patientswith- acute-heart-failure].
- Packer, M. How have millions of people with heart failure benefited from our research over the last 10-15 years? The sounds of dead silence. Eur J Heart Fail, 2017, 19 (11), 1353-1354.
- Erhardt, L., Komajda, M., Hobbs, F.D., Soler- Soler, J. Cardiologists' awareness and perceptions of guidelines for chronic heart failure. The ADDress your Heart survey. Eur J Heart Fail, 2008, 10 (10), 1020-1025.
- Calvin, J.E., Shanbhag, S., Avery, E., Kane, J., Richardson, D., Powell, L. Adherence to evidence-based guidelines for heart failure in physicians and their patients: lessons from the Heart Failure Adherence Retention Trial (HART). Congest Heart Fail, 2012, 18 (2), 73-78.
- Komajda, M., Anker, S.D., Cowie, M.R., Filippatos, G.S., Mengelle, B., Ponikowski, P., et al. Physicians' adherence to guideline-recommended medications in heart failure with reduced ejection fraction: data from the QUALIFY global survey. Eur J Heart Fail, 2016, 18 (5), 514-522.
- Ouwerkerk, W., Voors, A.A., Anker, S.D., Cleland, J.G., Dickstein, K., Filippatos, G., et al. Determinants and clinical outcome of uptitration of ACE-inhibitors and beta-blockers in patients with heart failure: a prospective European study. Eur Heart J, 2017, 38 (24), 1883-1890.
- Greene, S.J., Butler, J., Albert, N.M., DeVore, A.D., Sharma, P.P., Duffy, C.I., et al. Medical Therapy for Heart Failure With Reduced Ejection Fraction: The CHAMP-HF Registry. J Am Coll Cardiol, 2018, 72 (4), 351-366.
- Fonarow, G.C., Albert, N.M., Curtis, A.B., Stough, W.G., Gheorghiade, M., Heywood, J.T., et al. Improving evidence-based care for heart failure in outpatient cardiology practices: primary results of the Registry to Improve the Use of Evidence-Based Heart Failure Therapies in the Outpatient Setting (IMPROVE HF). Circulation, 2010, 122 (6), 585-596.
- Brunner-La Rocca, H.P., Linssen, G.C., Smeele, F.J., van Drimmelen, A.A., Schaafsma, H.J., Westendorp, P.H., et al. Contemporary Drug Treatment of Chronic Heart Failure With Reduced Ejection Fraction: The CHECK-HF Registry. JACC Heart Fail, 2019, 7 (1), 13-21.
- Einhorn, L.M., Zhan, M., Hsu, V.D., Walker, L.D., Moen, M.F., Seliger, S.L., et al. The frequency of hyperkalemia and its significance in chronic kidney disease. Arch Int Med, 2009, 169 (12), 1156-1162.
- Kovesdy, C.P. Blood pressure in chronic kidney disease: does the emperor have new clothes? Hypertension, 2015, 65 (1), 27-28.
- Epstein, M. Hyperkalemia constitutes a constraint for implementing renin-angiotensin- aldosterone inhibition: the widening gap between mandated treatment guidelines and the real-world clinical arena. Kidney Int Suppl (2011), 2016, 6 (1), 20-28.
- Chang, A.R., Sang, Y., Leddy, J., Yahya, T., Kirchner, H.L., Inker, L.A., et al. Antihypertensive Medications and the Prevalence of Hyperkalemia in a Large Health System. Hypertension, 2016, 67 (6), 1181-1188.
- Pitt, B., Zannad, F., Remme, W.J., Cody, R., Castaigne, A., Perez, A., et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med, 1999, 341 (10), 709-717.
- Zannad, F., McMurray, J.J., Krum, H., van Veldhuisen, D.J., Swedberg, K., Shi, H., et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med, 2011, 364 (1), 11-21.
- Shah, K.B., Rao, K., Sawyer, R., Gottlieb, S.S. The adequacy of laboratory monitoring in patients treated with spironolactone for congestive heart failure. J Am Coll Cardiol, 2005, 46 (5), 845-849.
- Bozkurt, B., Agoston, I., Knowlton, A.A. Complications of inappropriate use of spironolactone in heart failure: when an old medicine spirals out of new guidelines. J Am Coll Cardiol, 2003, 41 (2), 211-214.
- Dunn, J.D., Benton, W.W., Orozco-Torrentera, E., Adamson, R.T. The burden of hyperkalemia in patients with cardiovascular and renal disease. Am J Manag Care, 2015, 21 (15 Suppl), s307-315.
- Yancy, C.W., Jessup, M., Bozkurt, B., Butler, J., Casey, D.E., Jr., Drazner, M.H., et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol, 2013, 62 (16), e147-239.
- National Kidney F. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 Update. Am J Kidney Dis, 2012, 60 (5), 850-886.
- Li, L., Harrison, S.D., Cope, M.J., Park, C., Lee, L., Salaymeh, F., et al. Mechanism of Action and Pharmacology of Patiromer, a Nonabsorbed Cross-Linked Polymer That Lowers Serum Potassium Concentration in Patients With Hyperkalemia. J Cardiovasc Pharmacol Therapeut, 2016, 21 (5), 456-465.
- Pitt, B., Anker, S.D., Bushinsky, D.A., Kitzman, D.W., Zannad, F., Huang, I.Z., et al. Evaluation of the efficacy and safety of RLY5016, a polymeric potassium binder, in a double-blind, placebo-controlled study in patients with chronic heart failure (the PEARL-HF) trial. Eur Heart J, 2011, 32 (7), 820-828.
- Bakris, G.L., Pitt, B., Weir, M.R., Freeman, M.W., Mayo, M.R., Garza, D., et al. Effect of Patiromer on Serum Potassium Level in Patients With Hyperkalemia and Diabetic Kidney Disease: The AMETHYST-DN Randomized Clinical Trial. JAMA, 2015, 314 (2), 151-161.
- Pitt, B., Bakris, G.L., Bushinsky, D.A., Garza, D., Mayo, M.R., Stasiv, Y., et al. Effect of patiromer on reducing serum potassium and preventing recurrent hyperkalaemia in patients with heart failure and chronic kidney disease on RAAS inhibitors. Eur J Heart Fail, 2015, 17 (10), 1057-1065.
- Weir, M.R., Bakris, G.L., Bushinsky, D.A., Mayo, M.R., Garza, D., Stasiv, Y., et al. Patiromer in patients with kidney disease and hyperkalemia receiving RAAS inhibitors. N Engl J Med, 2015, 372 (3), 211-221.
- Pergola, P.E., Spiegel, D.M., Warren, S., Yuan, J., Weir, M.R. Patiromer Lowers Serum Potassium When Taken without Food: Comparison to Dosing with Food from an Open-Label, Randomized, Parallel Group Hyperkalemia Study. Am J Nephrol, 2017, 46 (4), 323-332.
- Lesko, L.J., Offman, E., Brew, C.T., Garza, D., Benton, W., Mayo, M.R., et al. Evaluation of the Potential for Drug Interactions With Patiromer in Healthy Volunteers. J Cardiovasc Pharmacol Therapeut, 2017, 22 (5), 434-446.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.