Introduction
L'insuffisance cardiaque (IC) est une affection courante, grave et potentiellement mortelle qui a pris des proportions épidémiques au cours des dernières décennies. Aux états-Unis, on estime qu'environ 6,5 millions d'adultes sont atteints d'IC, et on s'attend à ce que le chiffre atteigne 8,5 millions en 20301-5. Chaque année, on diagnostique une IC chez environ 670 000 personnes, et environ 2 % de la population souffre d'IC; 20 % de ces patients sont hospitalisés chaque année. C'est la principale cause de décès chez les sujets de plus de 65 ans. Le risque d'IC est d'environ 1 sur 5 à l'échelle d'une vie, ce qui s'explique principalement par une prévalence accrue des facteurs de risque les plus fréquents (hypertension artérielle, maladies coronariennes et diabète). De plus, les taux de survie de l'IC restent faibles, car la mortalité continue de fluctuer autour de 50 % dans les 5 ans qui suivent la première hospi talisation pour IC! C'est aussi une maladie chronique coûteuse. Le nombre élevé d'hospitalisations entraîne une pression massive sur le financement des soins de santé6, estimé à environ 31 milliards de dollars par an aux états- Unis (y compris la prise en charge de l'IC, les médicaments et l'absentéisme professionnel)7, 8. Bien qu'il y ait eu une amélioration notable dans le traitement de l'IC ces 20 dernières années, grâce à de nouveaux médicaments, des dispositifs médicaux, des interventions et des recommandations thérapeutiques claires, la prise en charge de l'IC est encore sous-optimale, avec des chiffres de mortalité élevés, indéfendables6.
Les médicaments sont la pierre angulaire du traitement de l'IC, mais ils sont trop peu prescrits
Les médicaments de l'IC (bêtabloquants, inhibiteurs de l'ECA, sartans, antagonistes des minéralocorticoïdes et tout récemment aussi le sacubitril + valsartan) sont la pierre angulaire du traitement de l'IC, du moins de l'HFrEF (insuffisance cardiaque à fraction d'éjection réduite, FEVG < 40 %). Une utilisation correcte des médicaments existants contribuerait déjà à améliorer le pronostic pour le patient, avec moins d'événements néfastes et une mortalité moindre, tout en réduisant les coûts des soins de santé9, 10. Pourtant, tous les patients souffrant d'HFrEF ne reçoivent pas les médicaments corrects à une dose adéquate. Il ressort de diverses bases de données que de nombreux patients atteints d'IC ne reçoivent pas le médicament - pourtant indiqué - et certainement pas à la 'dose cible' recommandée. Ainsi, l'étude QUALIFY, une vaste étude internationale prospective récente évaluant l'adhésion des médecins aux recommandations de l'ESC, montre que 87,2 %, 86,7 % et 69,3 % des patients atteints d'HFrEF ont respectivement reçu un IECA/ARB, un bêtabloquant et un ARM. Parmi les principales raisons pour lesquelles l'IECA/ARB et l'ARM n'ont pas été prescrits, les motifs invoqués étaient souvent l'insuffisance rénale et l'hyperkaliémie11. Des résultats similaires ont été notés dans l'étude BIOSTAT-CHF, qui a spécifiquement étudié la possibilité d'augmenter la dose d'IECA/ARB chez 2 100 patients souffrant d'HFrEF12. Si nous comparons les données du registre CHAMP-HF avec celles de la base de données IMPROVE-HF, datant déjà de 10 ans, nous constatons que les ARM en cas d'IC ne sont encore prescrits que dans moins de 40 % des cas, et qu'il y a même une tendance à la baisse au niveau de l'utilisation des IECA/ARB et des bêtabloquants par rapport à la dernière décennie13, 14! Le registre CHECK-HF (5 701 patients atteints d'HFrEF aux Pays-Bas) a révélé que 81 % d'entre eux recevaient des diurétiques, 84 % des IECA/ARB, 86 % des bêtabloquants et (seulement) 56 % des ARM. Pire encore, la majorité de ces patients ne recevaient pas la dose cible recommandée du médicament susmentionné15. Comme nous l'avons déjà cité, les raisons invoquées étaient l'insuffisance rénale et l'hyperkaliémie.
Hyperkaliémie: définition et conséquences
L'hyperkaliémie est habituellement définie comme un potassium sérique supérieur à 5,0 mEq/l ou 5,0 mmol/l16, 17. Parfois, une sous-classification est introduite, à savoir une hyperkaliémie légère (5,0-5,5 mEq/l), modérée (5,5-6,0 mEq/l) et sévère (> 6,5 mEq/l). Le potassium sérique peut augmenter relativement rapidement et de façon inattendue, et ce phénomène spécifique se produit plus fréquemment dans les populations à haut risque, comme les patients présentant un dilemme cardiorénal18. La présentation est souvent totalement asymptomatique, jusqu'à ce qu'il y ait des conséquences graves, notamment des troubles du rythme cardiaque mettant la vie en danger. On peut observer des modifications classiques à l'ecg (bradycardie, troubles de la repolarisation…), mais elles ne sont pas toujours présentes. Parfois, les patients se plaignent de faiblesse musculaire, de twitching (contractions musculaires ou fasciculations), de crampes sévères ou de paralysie. Il peut également exister un lien entre l'apparition de l'hyperkaliémie et la neuropathie chez les patients atteints d'une maladie rénale chronique, mais cette question doit encore être étudiée.
L'hyperkaliémie comme cause de non-instauration, d'arrêt ou de diminution des inhibiteurs du SRAA
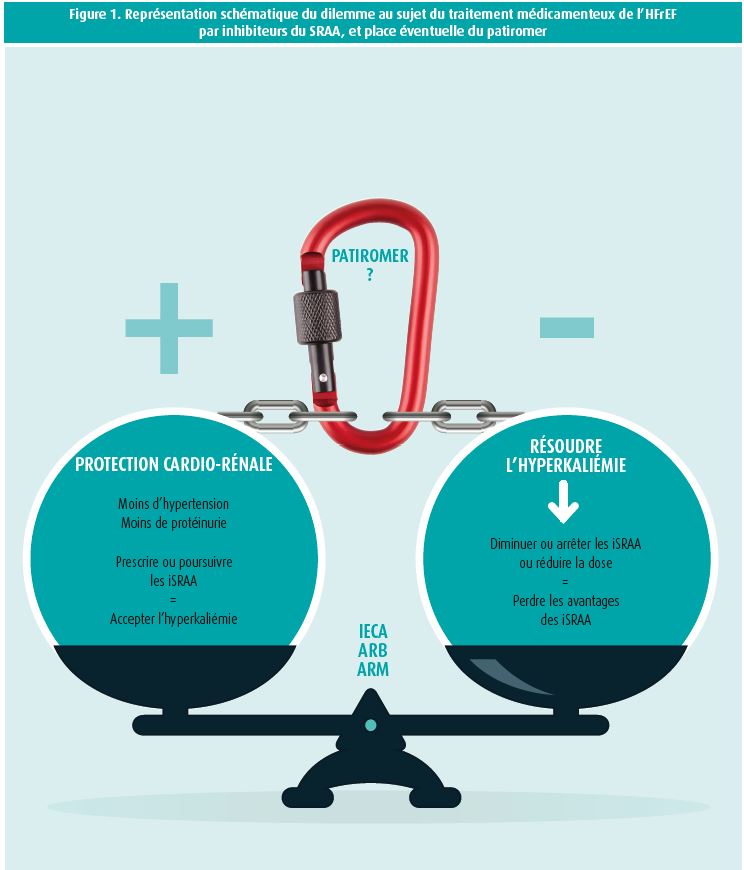
De manière générale, les spécialistes de l'IC sont souvent confrontés au dilemme suivant: la prescription d'inhibiteurs du SRAA a un effet cardio- et néphroprotecteur, et elle améliore la mortalité. Devons-nous accepter la présence d'hyperkaliémie ou diminuer la dose du traitement causal, au prix de la perte des avantages de l'inhibition du SRAA (figure 1)? Les inhibiteurs du SRAA ont montré qu'ils réduisent la mortalité chez les patients atteints d'IC, qu'ils ont une action antihypertensive, protègent les reins et réduisent la progression vers l'insuffisance rénale terminale, ainsi que la protéinurie. En revanche, le risque d'hyperkaliémie est effectivement accru en cas d'utilisation d'inhibiteurs du SRAA16, 17. L'étude de cohorte de Chang et al. a montré que 3 582 patients sur 155 695 avaient connu un épisode d'hyperkaliémie (5,5 mEq/l ou plus) et que, dans 24,3 % de ces cas, le médicament a été arrêté; une réduction de la dose n'a été appliquée que dans 4,8 % des cas. En outre, la réduction de la dose ou l'interruption du traitement était plus fréquente chez les patients présentant une indication spécifique d'inhibiteurs du SRAA, comme les patients souffrant d'IC19, et donc moins chez les patients qui prenaient le médicament uniquement pour contrôler leur tension artérielle. En plus de ces résultats, il est également frappant de constater que l'hyperkaliémie est beaucoup plus fréquente en pratique réelle que dans les études cliniques randomisées. Ainsi, dans les études RALES20 et EMPHASIS21, 22, on a noté une incidence d'hyperkaliémie d'environ 2 %, alors que les études en pratique réelle montrent un pourcentage beaucoup plus élevé d'hyperkaliémie en cas d'utilisation de spironolactone, soit 6 % dans l'étude de Shah22 et 12 % dans l'étude de Bozkurt23. En cas d'hyperkaliémie sévère, on observe également une augmentation exponentielle marquée de la mortalité chez les patients souffrant d'insuffisance rénale chronique16.
Le traitement médicamenteux à long terme de l'hyperkaliémie 'chronique'
Le traitement aigu d'une hyperkaliémie symptomatique (p. ex. un patient souffrant de troubles du rythme) sort du cadre de cet article. Une description adéquate des options thérapeutiques figure dans la publication de Dunn24.
En ce qui concerne le traitement chronique de l'hyperkaliémie, il est possible d'arrêter l'inhibiteur du SRAA ou de réduire la dose. Si le potassium sérique est supérieur à 5,0 mmol/l avant le traitement envisagé, les recommandations de l'ACCF/AHA et du NICE suggèrent de ne pas instaurer le traitement chez les patients atteints d'IRC ou d'IC25. Si le potassium est supérieur à 6 mmol/l, il est recommandé de ne jamais instaurer d'inhibiteur du SRAA, ou de l'arrêter complètement, le cas échéant. Les recommandations KDOQI pour l'insuffisance rénale chronique préconisent d'instaurer simultanément un traitement hypokaliémiant si le potassium est compris entre 5,1 et 5,5 mmol/l, s'il y a une indication stricte d'inhibiteur du SRAA26.
Les médicaments utilisés pour traiter l'hyperkaliémie en Belgique sont les 'résines' ou chélateurs du potassium. Il s'agit de polystyrène sulfonates (polymères sulfonés de diéthényl-benzène) chimiquement liés au calcium ou au sodium. Ces échangeurs de cations échangent des ions calcium ou sodium contre les ions potassium présents dans le tractus gastro- intestinal (via les apports hydriques et alimentaires) et réduisent ainsi l'absorption transmuqueuse du potassium. Ces polystyrène sulfonates doivent de préférence être pris à chaque repas, par exemple 3 fois par jour. Un problème évident, et non négligeable avec ces produits est qu'une hypercalcémie ou une hypernatrémie peut survenir, ce qui doit absolument être évité, surtout chez les patients atteints d'IC. Les effets indésirables classiques sont des gênes gastro- intestinales, en l'occurrence une sensation de ballonnement, accompagnée ou non de constipation. Le mauvais goût de ces produits explique souvent la piètre compliance thérapeutique des patients.
Un petit nouveau: le patiromer
Le patiromer est un nouveau chélateur potassique récemment introduit en Belgique et validé dans un grand nombre d'études cliniques. Le produit a une structure sphérique et contient des polymères fortement réticulés. En raison de sa structure sphérique avec un diamètre d'environ 100 microns, on n'a jamais démontré d'absorption systémique dans les études animales expérimentales27. Le patiromer a une capacité élevée de liaison au potassium, à savoir de 8,5 à 8,8 mEq par gramme de polymère, à un pH physiologique. Le patiromer agit principalement au niveau du côlon, l'endroit du corps où l'absorption et l'excrétion du potassium sont les plus importantes. Il convient également de noter que le patiromer n'échange les ions potassium que contre des ions calcium, et non contre des ions sodium27, ce qui constitue un petit avantage pour les patients souffrant d'IC. Le patiromer chargé d'ions potassium est facilement excrété dans les selles. Pour le moment, il est indiqué pour le traitement de l'hyperkaliémie chez l'adulte, tant aux états-Unis qu'en Europe.
L'efficacité et la sécurité du patiromer ont été démontrées dans un certain nombre d'études cliniques. La première étude, PEARL-HF, était une étude de phase II en double aveugle, visant à étudier l'efficacité du patiromer chez des patients souffrant d'IC chronique qui recevaient déjà un traitement standard et chez qui on avait initié de la spironolactone28. AMETHYST-DN, une autre étude de phase II, s'est penchée sur l'efficacité à long terme du patiromer chez des patients souffrant d'insuffisance rénale chronique et d'hyperkaliémie29. Par ailleurs, l'étude OPAL-HK, une étude de phase III, a été conduite pour étudier la capacité du patiromer à restaurer une normokaliémie chez les patients atteints d'IRC30, 31. Enfin, différentes études ont encore étudié l'interaction du patiromer avec des aliments ou d'autres médicaments32, 33.
L'étude PEARL-HF, une étude de Pitt et al., a déjà été publiée en 2011. Cette étude prospective randomisée en double aveugle avait inclus des patients souffrant d'IC chronique, ayant une indication de spironolactone, mais aussi un potassium de 4,3-5,1 mEq/l et une insuffisance rénale chronique avec un GRF < 60 ml/min ou une hyperkaliémie qui, par le passé, avait conduit à l'interruption du traitement par ARM ou IECA/ARB, 6 mois avant la visite initiale. Dans cette étude, qui n'a duré que 28 jours, on avait constaté que la spironolactone pouvait être augmentée chez 91 % des patients sous patiromer, contre seulement 74 % dans le groupe placebo. Par ailleurs, dans le groupe patiromer, l'hyperkaliémie n'était présente que dans 7 % des cas, contrairement à 25 % dans le groupe placebo. Ces résultats ont donc montré que le patiromer peut prévenir l'hyperkaliémie chez les patients souffrant d'IC, chez qui la dose d'ARM peut donc être mieux augmentée, ce qui est susceptible d'avoir des implications sur la survie28.
Dans AMETHYST-DN, les patients ont été suivis pendant une année complète. Il s'agissait de patients souffrant de diabète de type II et d'IRC, hypertendus ou non, qui avaient déjà reçu un inhibiteur du SRAA pendant au moins 1 mois avant la sélection pour l'étude. Au cours de la phase de traitement, les patients qui avaient développé une hyperkaliémie sous inhibiteurs du SRAA ont été randomisés vers du patiromer à la dose de 4,2, 8,4, 12,6 ou 16,8 g deux fois par jour ou un placebo. L'objectif était d'atteindre un potassium < 5,0 mmol/l ou moins, et le patiromer était titré en conséquence. Dans le groupe présentant une hyperkaliémie légère, le potassium moyen était de 5,2 mEq/l, contre 5,7 mEq/l dans le groupe présentant une hyperkaliémie modérée. Les résultats de l'étude ont montré une diminution significative du potassium pour chaque dose de patiromer, dès 48 heures après le début du traitement (p < 0,001). Les patients ont également présenté une diminution durable du potassium pendant toute la durée de l'étude (p < 0,001). Après la fin de l'étude et l'arrêt du traitement, le potassium a réaugmenté au plus tard 72 h après l'arrêt du médicament29. On n'a pas noté d'effets indésirables graves au cours de cette étude.
L'étude OPAL-HK a inclus des patients souffrant d'IRC de stade 3-4, ayant une kaliémie > 5,1 et < 6,5 mmol/l, ayant reçu un inhibiteur du SRAA pendant au moins 1 mois. On a observé une diminution significative du potassium sérique de 1,01 mmol/l en moyenne dans le groupe patiromer, après la semaine 4 (p < 0,001), et le médicament était bien toléré. Les effets indésirables les plus significatifs étaient une constipation (11 %), de la diarrhée (3 %), des nausées (3 %) et une hypomagnésémie (3 %). On n'a pas noté d'effets indésirables graves potentiellement associés au traitement. En outre, on a pu démontrer très clairement qu'il était beaucoup moins souvent nécessaire de réduire la dose de l'inhibiteur du SRAA - voire de l'interrompre complètement - chez les patients traités par patiromer, par rapport au placebo. à la fin de l'étude, il est dès lors apparu que le nombre de patients recevant encore l'inhibiteur du SRAA était beaucoup plus élevé sous patiromer que sous placebo31.
Critères de remboursement du patiromer en Belgique
Pour une première demande de remboursement - et une prolongation -, le formulaire ne peut être rempli que par un interniste porteur du titre professionnel en néphrologie. Pour l'instant, les cardiologues ne peuvent pas prescrire le produit en tant que 'médecin initiateur'. Une bonne communication avec le néphrologue est donc essentielle. Par ailleurs, le remboursement est actuellement temporaire et une réévaluation aura lieu dans les années à venir.
Les conditions de remboursement sont:
- Une ou plusieurs des situations suivantes: diabète, IC congestive, protéinurie;
- ET maladie rénale chronique stade 3 ou 4 avec un eGFR entre 15 et 60 ml/min;
- ET hyperkaliémie récidivante (> 5,1 mEq/l) depuis le traitement avec un inhibiteur du SRAA, malgré le régime à faible teneur en potassium et la correction d'une éventuelle acidose métabolique;
- ET un effet insuffisant lors de l'utilisation d'un diurétique de l'anse si cliniquement indiqué;
- ET la posologie d'inhibiteur du SRAA qui est cliniquement nécessaire chez le bénéficiaire ne peut pas être administrée suite à une hyperkaliémie récidivante.
En plus d'un certain nombre d'autres critères mineurs mentionnés dans le formulaire, si tous les critères sont remplis, le remboursement sera accordé pour une période de 6 mois, après quoi une prolongation pourra être demandée. Il n'est pas exclu que des modifications puissent être apportées à ces critères à l'avenir, compte tenu d'une nouvelle étude qui va débuter, en l'occurrence l'étude DIAMOND-HF. Cette étude recrute des patients souffrant d'IC chronique et d'hyperkaliémie, afin d'évaluer si le résultat à long terme s'améliore dans ce groupe grâce à l'utilisation de patiromer (parce que l'inhibiteur du SRAA peut être mieux titré, grâce au chélateur potassique). Les résultats sont attendus en 2022, et plusieurs centres belges incluront des patients dans cette étude.
Conclusion et perspective d'avenir
L'IC est une affection chronique grave associée à une morbi-mortalité et des coûts médicaux élevés. La pierre angulaire du traitement de l'HFrEF reste les médicaments, bien qu'ils soient souvent insuffisamment titrés et combinés. Il existe plusieurs explications à ceci, mais une des causes est l'hyperkaliémie. Le patiromer est un médicament efficace pour traiter l'hyperkaliémie, et il offre des perspectives pour améliorer le traitement des patients atteints d'IC. Les études devront montrer si une prise en charge consciencieuse dans ce domaine génère également un bénéfice sur le plan de la mortalité.
Références
- Correction to: Heart Disease and Stroke Statistics- 2018 Update: A Report From the American Heart Association. Circulation, 2018, 137 (12), e493.
- Benjamin, E.J., Virani, S.S., Callaway, C.W., Chamberlain, A.M., Chang, A.R., Cheng, S., et al. Heart Disease and Stroke Statistics-2018 Update: A Report From the American Heart Association. Circulation, 2018, 137 (12), e67-e492.
- Cowie, M.R., Anker, S.D., Cleland, J.G.F., Felker, G.M., Filippatos, G., Jaarsma, T., et al. Improving care for patients with acute heart failure: before, during and after hospitalization. ESC Heart Fail, 2014, 1 (2), 110-145.
- Hall, M.J., Levant, S., DeFrances, C.J. Hospitalization for congestive heart failure: United States, 2000-2010. NCHS Data Brief, 2012, 108, 1-8.
- Ruppar, T.M., Cooper, P.S., Mehr, D.R., Delgado, J.M., Dunbar-Jacob, J.M. Medication Adherence Interventions Improve Heart Failure Mortality and Readmission Rates: Systematic Review and Meta-Analysis of Controlled Trials. J Am Heart Assoc, 2016, 5 (6), 5:e002606.
- Oktay, A.A., Rich, J.D., Shah, S.J. The emerging epidemic of heart failure with preserved ejection fraction. Curr Heart Fail Rep, 2013, 10 (4), 401-410.
- Improving care for patients with acute heart failure: before, during and after hospitalization 2014 [Available from: http://www. oxfordhealthpolicyforum.org/reports/acuteheart- failure/improving-care-for-patientswith- acute-heart-failure].
- Packer, M. How have millions of people with heart failure benefited from our research over the last 10-15 years? The sounds of dead silence. Eur J Heart Fail, 2017, 19 (11), 1353-1354.
- Erhardt, L., Komajda, M., Hobbs, F.D., Soler- Soler, J. Cardiologists' awareness and perceptions of guidelines for chronic heart failure. The ADDress your Heart survey. Eur J Heart Fail, 2008, 10 (10), 1020-1025.
- Calvin, J.E., Shanbhag, S., Avery, E., Kane, J., Richardson, D., Powell, L. Adherence to evidence-based guidelines for heart failure in physicians and their patients: lessons from the Heart Failure Adherence Retention Trial (HART). Congest Heart Fail, 2012, 18 (2), 73-78.
- Komajda, M., Anker, S.D., Cowie, M.R., Filippatos, G.S., Mengelle, B., Ponikowski, P., et al. Physicians' adherence to guideline-recommended medications in heart failure with reduced ejection fraction: data from the QUALIFY global survey. Eur J Heart Fail, 2016, 18 (5), 514-522.
- Ouwerkerk, W., Voors, A.A., Anker, S.D., Cleland, J.G., Dickstein, K., Filippatos, G., et al. Determinants and clinical outcome of uptitration of ACE-inhibitors and beta-blockers in patients with heart failure: a prospective European study. Eur Heart J, 2017, 38 (24), 1883-1890.
- Greene, S.J., Butler, J., Albert, N.M., DeVore, A.D., Sharma, P.P., Duffy, C.I., et al. Medical Therapy for Heart Failure With Reduced Ejection Fraction: The CHAMP-HF Registry. J Am Coll Cardiol, 2018, 72 (4), 351-366.
- Fonarow, G.C., Albert, N.M., Curtis, A.B., Stough, W.G., Gheorghiade, M., Heywood, J.T., et al. Improving evidence-based care for heart failure in outpatient cardiology practices: primary results of the Registry to Improve the Use of Evidence-Based Heart Failure Therapies in the Outpatient Setting (IMPROVE HF). Circulation, 2010, 122 (6), 585-596.
- Brunner-La Rocca, H.P., Linssen, G.C., Smeele, F.J., van Drimmelen, A.A., Schaafsma, H.J., Westendorp, P.H., et al. Contemporary Drug Treatment of Chronic Heart Failure With Reduced Ejection Fraction: The CHECK-HF Registry. JACC Heart Fail, 2019, 7 (1), 13-21.
- Einhorn, L.M., Zhan, M., Hsu, V.D., Walker, L.D., Moen, M.F., Seliger, S.L., et al. The frequency of hyperkalemia and its significance in chronic kidney disease. Arch Int Med, 2009, 169 (12), 1156-1162.
- Kovesdy, C.P. Blood pressure in chronic kidney disease: does the emperor have new clothes? Hypertension, 2015, 65 (1), 27-28.
- Epstein, M. Hyperkalemia constitutes a constraint for implementing renin-angiotensin- aldosterone inhibition: the widening gap between mandated treatment guidelines and the real-world clinical arena. Kidney Int Suppl (2011), 2016, 6 (1), 20-28.
- Chang, A.R., Sang, Y., Leddy, J., Yahya, T., Kirchner, H.L., Inker, L.A., et al. Antihypertensive Medications and the Prevalence of Hyperkalemia in a Large Health System. Hypertension, 2016, 67 (6), 1181-1188.
- Pitt, B., Zannad, F., Remme, W.J., Cody, R., Castaigne, A., Perez, A., et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med, 1999, 341 (10), 709-717.
- Zannad, F., McMurray, J.J., Krum, H., van Veldhuisen, D.J., Swedberg, K., Shi, H., et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med, 2011, 364 (1), 11-21.
- Shah, K.B., Rao, K., Sawyer, R., Gottlieb, S.S. The adequacy of laboratory monitoring in patients treated with spironolactone for congestive heart failure. J Am Coll Cardiol, 2005, 46 (5), 845-849.
- Bozkurt, B., Agoston, I., Knowlton, A.A. Complications of inappropriate use of spironolactone in heart failure: when an old medicine spirals out of new guidelines. J Am Coll Cardiol, 2003, 41 (2), 211-214.
- Dunn, J.D., Benton, W.W., Orozco-Torrentera, E., Adamson, R.T. The burden of hyperkalemia in patients with cardiovascular and renal disease. Am J Manag Care, 2015, 21 (15 Suppl), s307-315.
- Yancy, C.W., Jessup, M., Bozkurt, B., Butler, J., Casey, D.E., Jr., Drazner, M.H., et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol, 2013, 62 (16), e147-239.
- National Kidney F. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 Update. Am J Kidney Dis, 2012, 60 (5), 850-886.
- Li, L., Harrison, S.D., Cope, M.J., Park, C., Lee, L., Salaymeh, F., et al. Mechanism of Action and Pharmacology of Patiromer, a Nonabsorbed Cross-Linked Polymer That Lowers Serum Potassium Concentration in Patients With Hyperkalemia. J Cardiovasc Pharmacol Therapeut, 2016, 21 (5), 456-465.
- Pitt, B., Anker, S.D., Bushinsky, D.A., Kitzman, D.W., Zannad, F., Huang, I.Z., et al. Evaluation of the efficacy and safety of RLY5016, a polymeric potassium binder, in a double-blind, placebo-controlled study in patients with chronic heart failure (the PEARL-HF) trial. Eur Heart J, 2011, 32 (7), 820-828.
- Bakris, G.L., Pitt, B., Weir, M.R., Freeman, M.W., Mayo, M.R., Garza, D., et al. Effect of Patiromer on Serum Potassium Level in Patients With Hyperkalemia and Diabetic Kidney Disease: The AMETHYST-DN Randomized Clinical Trial. JAMA, 2015, 314 (2), 151-161.
- Pitt, B., Bakris, G.L., Bushinsky, D.A., Garza, D., Mayo, M.R., Stasiv, Y., et al. Effect of patiromer on reducing serum potassium and preventing recurrent hyperkalaemia in patients with heart failure and chronic kidney disease on RAAS inhibitors. Eur J Heart Fail, 2015, 17 (10), 1057-1065.
- Weir, M.R., Bakris, G.L., Bushinsky, D.A., Mayo, M.R., Garza, D., Stasiv, Y., et al. Patiromer in patients with kidney disease and hyperkalemia receiving RAAS inhibitors. N Engl J Med, 2015, 372 (3), 211-221.
- Pergola, P.E., Spiegel, D.M., Warren, S., Yuan, J., Weir, M.R. Patiromer Lowers Serum Potassium When Taken without Food: Comparison to Dosing with Food from an Open-Label, Randomized, Parallel Group Hyperkalemia Study. Am J Nephrol, 2017, 46 (4), 323-332.
- Lesko, L.J., Offman, E., Brew, C.T., Garza, D., Benton, W., Mayo, M.R., et al. Evaluation of the Potential for Drug Interactions With Patiromer in Healthy Volunteers. J Cardiovasc Pharmacol Therapeut, 2017, 22 (5), 434-446.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.