Multivalvulair lijden (MVD) is de combinatie van een stenotisch of regurgiterend letsel, of beide, ter hoogte van twee of meer hartkleppen. De prevalentie van deze aandoening is hoog. Dit geldt ook voor 'mixed' valvulair lijden, wat de combinatie is van een stenotische en regurgiterende component van eenzelfde hartklep.
De Euro Heart Survey geeft cijfers voor de prevalentie van MVD van 24,9 % in patiënten met natief kleplijden.1 Hoewel reumatisch kleplijden als oorzaak van MVD progressief afneemt in de westerse wereld, neemt degeneratief kleplijden toe, wat de incidentie van MVD zeker niet doet afnemen, rekening houdende met een ouder wordende populatie. Meer zeldzame oorzaken van MVD zijn endocarditis, gevolgen van radiotherapie en sommige medicijnen, onderliggende genetische afwijkingen en bindweefselziekten. Bij secondaire mitralis- en tricuspidalisklepregurgitatie (MR en TR) is het probleem niet de klep zelf maar een gewijzigde geometrie van de linker- en respectievelijk rechterkamer (LV en RV). Coronaire aandoeningen en voorgeschiedenis van myocardinfarct zijn vaak aanwezig bij patiënten met MVD en vaak zien we bij deze patiënten 'ischemische' secondaire MR wat dus een frequente klepaantasting is bij de oudere populatie met MVD. We kunnen dus stellen dat MVD zeker geen zeldzame klinische entiteit is.
De pathofysiologische complexiteit van de combinatie van klepletsels maakt echter dat er weinig harde data bestaan om deze patiënten op een evidencebased wijze te benaderen, zowel vanuit diagnostisch als therapeutisch standpunt. Het is de verdienste van onder andere Philippe Unger, diensthoofd Cardiologie in het CHU St. Pieterziekenhuis in Brussel, om de laatste jaren toch wat meer duidelijkheid te scheppen omtrent deze moeilijke entiteit.
Het klinische gevolg van MVD is afhankelijk van een erg complexe wisselwerking van een aantal pathofysiologische factoren zoals de ernst van elk individueel klepdefect, welke kleppen zijn aangetast, of het gaat om primair of secondair kleplijden, de duur van de klepafwijkingen en de voor- en nabelasting van de ventriculaire status. Ingrijpen bij een klepdefect zal vaak een impact hebben op het andere klepdefect. Het is buiten de scoop van dit redactioneel om de verschillende combinaties van klepafwijkingen pathofysiologisch te overlopen, maar de combinatie van aortaklepstenose (AS) en MR is een typisch voorbeeld van een klinisch zeer relevante entiteit. Figuur 1 komt uit een uitstekend overzichtsartikel van MVD en illustreert voor deze combinatie de relatie en impact van één klepprobleem op het andere.2
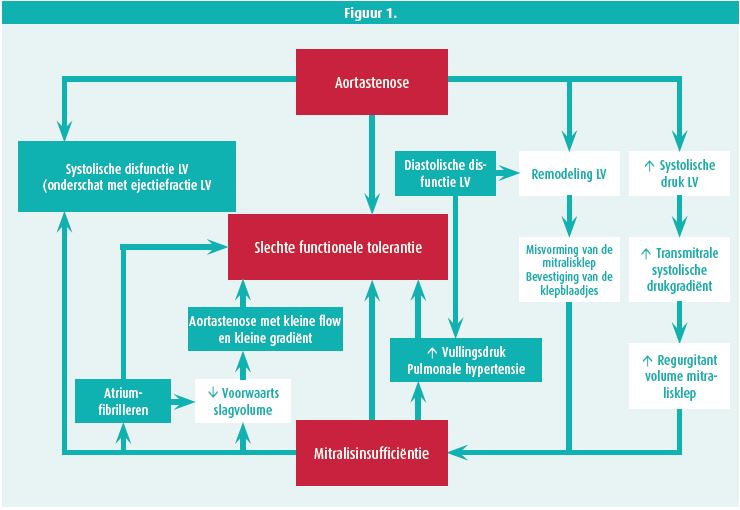
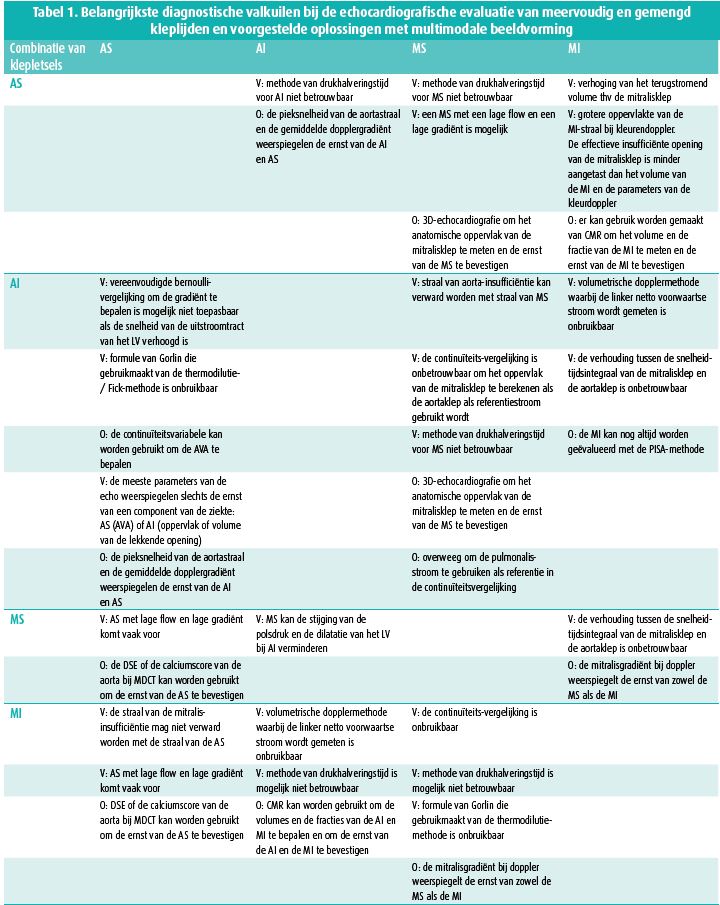
De diagnose van MVD wordt bemoeilijkt door dezelfde pathofysiologische factoren die eerder werden vermeld. De auscultatie laat zelden toe een juiste diagnose te stellen van het gemengde kleplijden, laat staan een correcte kwantificatie van de klepafwijkingen te geven. Maar ook echocardiografie met haar dopplermetingen heeft zijn beperkingen in deze klinische situatie. We kunnen algemeen stellen dat in MVD 'low-flow, low-gradient'-klepstenosen regelmatig aanwezig zijn, gemengd kleplijden vaak geassocieerd is aan een toegenomen anterograde flow en gradiënt, de continuïteitsvergelijking niet van toepassing is bij ongelijke transvalvulaire flows, elk ernstig kleplijden een toename kan veroorzaken van een stroomopwaartse secondaire MR of TR, en de pressure-halftime-methoden niet geldig zijn in de aanwezigheid van abnormale linkerkamercompliantie of -relaxatie of abnormale LV-vulling. Als algemene regel kunnen we stellen dat metingen die niet afhankelijk zijn van pre- en afterload de voorkeur genieten, zoals directe planimetrie van stenotische kleppen en het meten van een effectief regurgiterend oppervlakte of vena contracta bij insufficiënte kleppen. Een schematisch overzicht (tabel 1) van de valkuilen die echocardiografie kent bij patiënten met MVD en enkele oplossingen komt uit een tweede overzichtsartikel.3

De diagnostische moeilijkheden van echocardiografie maar ook van hartkatheterisatie bij deze groep patiënten heeft geleid tot 'de derde M van MVD': multimodality imaging. Zo zal bij patiënten met een low flow, low gradient aortaklepstenose met significant verlaagd aortaklepoppervlakte, lage dosis dobutamine stressechocardiografie en bij twijfelgevallen de calciumscore van de aortaklep met MDCT gebruikt worden om een juiste kwantificatie van de ernst van de aortaklepstenose te bepalen. Zo zal ook de hulp van MRI ingeroepen worden voor een correcte kwantificatie van aortaen mitralisklepinsufficiëntie bij sommige patiënten met gecombineerd aorta- en mitraliskleplijden. Inspanningsechocardiografie is dan weer interessant wanneer er een discrepantie bestaat tussen de klinische symptomen en de klepparameters in rust.3
De behandeling van deze groep patiënten is zo mogelijk nog moeilijker dan de diagnose en kwantificatie van het kleplijden: er bestaat erg weinig evidentie voor MVD wat zich reflecteert in aanbevelingen met een 'level of evidence C'.4, 5
De basiselementen die men bij elke patiënt moet overwegen zijn: verhoogd operatoir risico bij gecombineerde procedures en verhoogde morbiditeit geassocieerd aan meerdere kunstkleppen, het risico voor een eventuele re-operatie, alsook het prognostisch effect van een geassocieerd nog niet ernstig letsel dat niet wordt gecorrigeerd, de kans op spontane vermindering van MR of TR bij chirurgie van respectievelijk aorta- of pulmonalisklep, de keuze van de chirurgische techniek, de toenemende rol van percutane behandelingen en de rol van het hartteam.2
Als algemene richtlijn voor de behandeling van patiënten met MVD geven zowel Europese als Amerikaanse richtlijnen de volgende raad: a) Als 2 of meer klepafwijkingen ernstig zijn, zal een belangrijke functionele intolerantie blijven bestaan indien een van de letsels niet wordt behandeld. Daarom is de aanbeveling de behandeling van beide (of meer dan 2) klepafwijkingen (klasse I-aanbeveling) b) indien een ernstig klepletsel gepaard gaat met ≥ 1 niet-ernstig letsel wordt de indicatie bepaald in de richtlijnen voor de ernstige klepafwijking. Wat er moet gebeuren voor het geassocieerde nieternstige kleplijden is minder duidelijk (klasse II-aanbeveling) c) in de aanwezigheid van ≥ 2 matige klepletsels, en indien de gezamelijk hemodynamische impact van deze klepletsels de hoofdoorzaak is van de symptomen van de patiënt of van de linkerkamerdisfunctie, kan een chirurgische behandeling of transkatheterbehandeling overwogen worden, maar dit klinisch scenario staat niet uitgewerkt in de richtlijnen. Gezien de complexiteit van de behandelingsstrategie van patiënten met MVD is de bespreking in een Heart Valve Center van primordiaal belang.
Dit voorbeeld van 'mixed' of gemengd kleplijden illustreert de complexiteit van MVD en gemengd kleplijden. Nieuw, liefst gerandomiseerd onderzoek, zal meer klaarheid moeten brengen in de optimale diagnostische en therapeutische aanpak van deze aandoeningen.
De explosie van de percutane behandelingstechnieken voor kleplijden zal een belangrijke impact hebben in de toekomst op de behandeling van patiënten met MVD maar tot op heden is de plaats ervan in MVD nog niet bewezen. Onze toekomstige minister van Gezondheidszorg kan dus nog heel even opgelucht ademen maar lang zal dat niet duren. Laten we nu maar eerst ijveren voor een correcte terugbetaling van de TAVI en MitraClip zodat we in België tenminste al patiënten met monovalvulair kleplijden volgens de richtlijnen kunnen behandelen. Iets wat nu helaas niet het geval is.
Referenties
- Iung, B. et al. Contemporary presentation and management of valvular heart disease. The EURObservationale research programme valvular heart disease II survey. Circulation, 2019, 140, 1156-1169.
- Unger, P.,Clavel, M.A., Lindma, B.R., Mathieu, P., Pibarot, P. Pathophysiology and management of multivalvular disease. Nat Rev Cardiol, 2016, 13, 429-440.
- Unger, P., Pibarot, P. , Tribouilloy, C., Lancellotti, P., Maisano, F., Iung, B. et al. Multiple and Mixed Valvular Heart Diseases Pathophysiology, Imaging, and Management. Circulation: Cardiovascular Imaging, 2018, 11, 1-13.
- Baumgartner, H. et al. 2017 ESC/EACTS guidelines for the management of valvular heart disease: the task force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J, 2017, 38, 2739-2791.
- Nishimura, R.A., Otto, C.M., Bonow, R.O., Carabello, B.A., Erwin, J.P. III, Fleisher, L.A. et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines. Circulation, 2017, 135: e1159-e1195. DOI: 10.1161/ CIR.0000000000000503.
- Egbe, A.C., Poterucha, J.T., Warnes, C.A. Mixed aortic valve disease: midterm outcome and predictors of adverse events. Eur Heart J, 2016, 37, 2671-2678.
- Zilberszac, R., Gabriel, H., Schemper, M., Zahler, D., Czemy, M., Maurer, G. et al. Outcome of combined stenotic and regurgitant aortic valve disease. J Am Coll Cardiol, 2013, 61, 1489-1495.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.