Une maladie multivalvulaire (MVD, multivalvular disease) signifie la présence d'une lésion sténotique et/ou régurgitante au niveau de 2 valves cardiaques ou plus. La prévalence de cette affection est élevée. Ceci s'applique également à une maladie valvulaire mixte, qui combine une composante sténotique et régurgitante au sein d'une même valve cardiaque.
D'après l'Euro Heart Survey, la prévalence de la MVD atteint 24,9 % chez les patients souffrant de valvulopathies natives.1 Bien que les valvulopathies rhumatismales soient de moins en moins à l'origine d'une MVD dans le monde occidental, les maladies valvulaires dégénératives augmentent, ce qui ne diminue certainement pas l'incidence des MVD, compte tenu du vieillissement de la population. Parmi les causes plus rares de MVD, citons l'endocardite, les conséquences de la radiothérapie et de certains médicaments, les anomalies génétiques sous-jacentes et les maladies du tissu conjonctif. Dans la régurgitation valvulaire mitrale et tricuspide (RM et RT) secondaire, le problème n'est pas la valve elle-même, mais une géométrie modifiée des ventricules gauche et droit (VG et VD), respectivement. On observe souvent une maladie coronarienne et un antécédent d'infarctus myocardique chez les patients atteints de MVD, et on voit souvent une RM secondaire « ischémique » chez ces patients, ce qui constitue donc une affection valvulaire fréquente dans la population âgée souffrant de MVD. Nous pouvons donc affirmer que la MVD n'est assurément pas une entité clinique rare.
Cependant, en raison de la complexité physiopathologique de la combinaison de lésions valvulaires, il existe peu de données concrètes permettant une prise en charge evidence-based de ces patients, tant d'un point de vue diagnostique que thérapeutique. Ces dernières années, quelques collègues, dont Philippe Unger, chef du service de Cardiologie au CHU Saint-Pierre de Bruxelles, ont eu le mérite de tenter de clarifier quelque peu cette entité complexe.
La conséquence clinique d'une MVD dépend d'une interaction très complexe entre plusieurs facteurs physiopathologiques, tels que la sévérité de chaque anomalie valvulaire individuelle, les valves atteintes, la nature primaire ou secondaire de la valvulopathie, la durée des anomalies valvulaires et la pré- et postcharge ventriculaire. Une intervention sur une anomalie valvulaire aura souvent un impact sur l'autre. Il n'entre pas dans le cadre de cet éditorial d'analyser la physiopathologie des différentes combinaisons d'anomalies valvulaires possibles, mais la combinaison d'une sténose valvulaire aortique (SA) et d'une RM est un exemple typique d'entité clinique très pertinente. La Figure 1, tirée d'un excellent article de synthèse sur la MVD, illustre - pour cette combinaison - la relation et l'impact d'un problème valvulaire sur l'autre.2
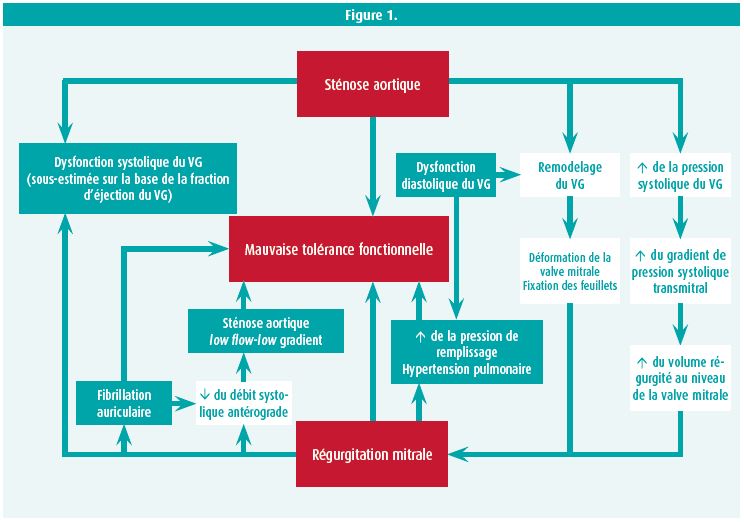
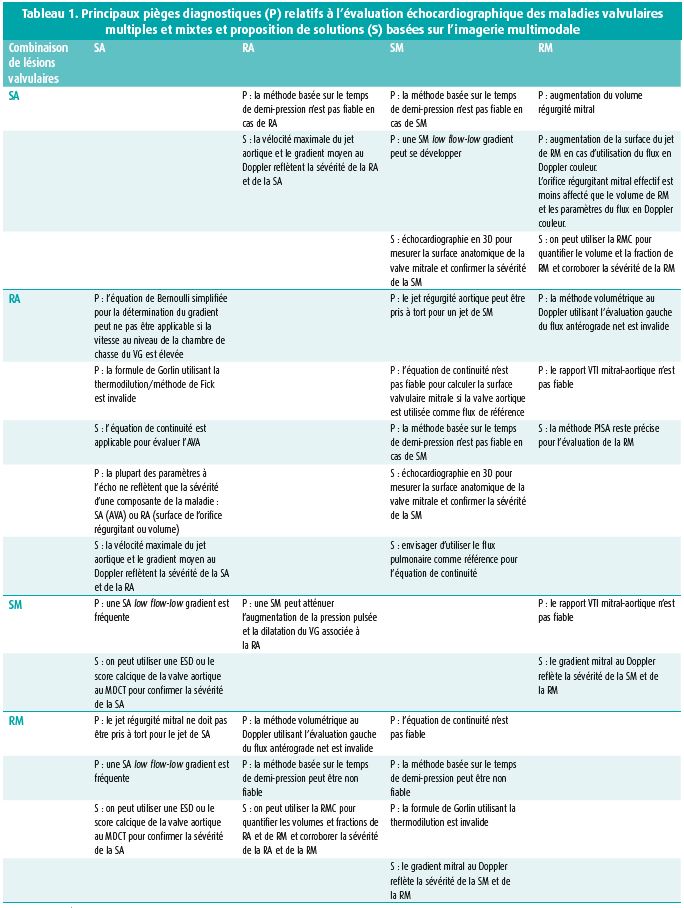
Le diagnostic de MVD est compliqué par les mêmes facteurs physiopathologiques que ceux mentionnés précédemment. L'auscultation permet rarement de poser un diagnostic correct de la valvulopathie mixte, et encore moins de quantifier correctement les anomalies valvulaires. Toutefois, l'échocardiographie avec ses mesures Doppler a aussi ses limites dans cette situation clinique. De manière générale, nous pouvons dire qu'en cas de MVD, il y a souvent des sténoses valvulaires low flow-low gradient, que les valvulopathies mixtes sont souvent associées à une augmentation du flux antérograde et du gradient, que l'équation de continuité ne s'applique pas en cas de flux transvalvulaires inégaux, que toute valvulopathie sévère peut entraîner une augmentation d'une RM ou d'une RT secondaire vers l'amont et que les méthodes basées sur le temps de demi-pression ne sont pas valables en cas de compliance ou de relaxation anormale du ventricule gauche ou en cas d'anomalies de remplissage du VG. De manière générale, nous pouvons dire que les mesures qui ne dépendent pas de la précharge et de la postcharge remportent la préférence, comme la planimétrie directe des valves sténotiques et la mesure d'une surface de régurgitation effective ou de la largeur de la vena contracta en cas d'insuffisance valvulaire. Un aperçu schématique des pièges de l'échocardiographie chez les patients atteints de MVD avec quelques solutions est issu d'un deuxième article de synthèse (tableau 1).3
Les difficultés diagnostiques de l'échocardiographie mais aussi du cathétérisme cardiaque dans ce groupe de patients ont donné lieu au « troisième M » de la MVD : l'imagerie multimodale. Ainsi, chez les patients présentant une sténose valvulaire aortique low flow-low gradient avec une surface valvulaire aortique significativement réduite, on utilisera une échocardiographie de stress avec une faible dose de dobutamine et, en cas de doute, le score calcique de la valve aortique à la tomographie computérisée multi-barrettes (MDCT) pour quantifier correctement la sévérité de la sténose valvulaire aortique. L'IRM sera également utilisée pour quantifier correctement une insuffisance valvulaire aortique et mitrale chez certains patients souffrant de valvulopathies aortique et mitrale combinées. L'échocardiographie d'effort est intéressante lorsqu'il existe une discordance entre les symptômes du patient et les paramètres valvulaires au repos.3
Le traitement de ce groupe de patients est, pour autant que ce soit possible, encore plus difficile que le diagnostic et la quantification de la valvulopathie : il existe très peu de données probantes au sujet des MVD, ce qui se reflète dans les recommandations avec un « niveau de preuve C ».4, 5
Les éléments de base à considérer chez chaque patient sont : l'augmentation du risque opératoire en cas de procédures combinées et la morbidité plus élevée qu'impliquent plusieurs valves artificielles, le risque de devoir potentiellement ré-intervenir, ainsi que l'effet pronostique de la non-correction d'une lésion associée, non encore sévère, les chances de régression spontanée d'une RM ou d'une RT lors d'une chirurgie valvulaire aortique ou pulmonaire, respectivement, le choix de la technique chirurgicale, le rôle croissant des traitements percutanés et le rôle de l'équipe cardiaque.2
De manière générale, pour le traitement des patients atteints de MVD, les recommandations européennes et américaines préconisent toutes deux ce qui suit : a) S'il y a ≥ 2 anomalies valvulaires sévères, il persistera une intolérance fonctionnelle importante si une des lésions n'est pas traitée. Dès lors, il est recommandé de traiter les deux (ou plus de 2) anomalies valvulaires (recommandation de classe I). b) Si une lésion valvulaire sévère est associée à ≥ 1 lésion non sévère, l'indication est déterminée dans les recommandations pour l'anomalie valvulaire sévère. On sait moins clairement ce qu'il faut faire pour l'anomalie valvulaire non sévère associée (recommandation de classe II). (c) En présence de ≥ 2 lésions valvulaires modérées, et si l'impact hémodynamique conjoint de ces lésions valvulaires est la cause principale des symptômes du patient ou de la dysfonction ventriculaire gauche, on peut envisager un traitement chirurgical ou transcathéter, mais ce scénario clinique n'est pas développé dans les recommandations. étant donné la complexité de la stratégie de traitement des patients souffrant de MVD, la discussion dans un Heart Valve Center est capitale.
à titre d'exemple pour illustrer la complexité des valvulopathies mixtes, j'aimerais revenir brièvement sur l'excellent exposé de P. Unger au sujet de la SA et de l'insuffisance valvulaire aortique (RA) lors du récent congrès EuroEcho. Les patients présentant une SA modérée, sévère asymptomatique et une RA modérément sévère asymptomatique ont une survie sans événement comparable à celle des patients souffrant de SA sévère isolée, asymptomatique, et une survie cumulative comparable à celle des patients présentant une RA asymptomatique initialement isolée, qui ne subissent pas de remplacement valvulaire aortique lors de l'évolution de leur maladie. Leur suivi mérite donc toute notre attention.
D'un point de vue physiopathologique, les 2 lésions provoquent ensemble une augmentation du gradient transvalvulaire et de la postcharge, une hypertrophie ventriculaire gauche sévère couplée à une dilatation seulement modérée du VG, ce qui débouche sur une diminution de la compliance du VG et une surcharge volumique du VG, due à la RA. Ceci induit des pressions diastoliques plus élevées dans le VG, une augmentation de la tension pariétale et une diminution des performances cliniques. La courbe pression/volume du VG est déplacée vers des volumes télédiastoliques légèrement plus élevés (à droite), et des pressions télésystoliques clairement augmentées (vers le haut).
Pour la détermination de la sévérité des lésions valvulaires individuelles, la SA et la RA, et de leur combinaison, nous devrons tenir compte des facteurs suivants :
- Le pic et le gradient moyen à travers la valve sténotique surestimeront la sévérité de la lésion sténotique, car ces valeurs dépendent du flux.
- « L'équation de Bernoulli simplifiée » surestimera le gradient, car les vitesses au niveau de la chambre de chasse du VG ne sont pas négligeables, et il faudra utiliser « l'équation de Bernoulli modifiée » pour déterminer le gradient de pression : Δp= 4 x (v22 - v12).
- L'équation de continuité est par contre d'application pour la détermination de la surface valvulaire aortique.
- La formule de Gorlin ne s'applique pas à cette valvulopathie combinée, étant donné que le débit systolique est déterminé par le côté droit.
- En cas d'insuffisance, une surface modérément grande de l'orifice régurgitant, couplée à une dilatation seulement minime du ventricule gauche peut néanmoins entraîner une importante fraction régurgitée.
- Le temps de demi-pression (pressure half time) n'est pas précis.
- Le volume régurgité déterminé à l'aide de l'IRM en contraste de phase peut être utilisé pour déterminer la sévérité de la composante de RA, dans les cas difficiles où l'écho-Doppler donne des résultats douteux. Si nous combinons ces deux évaluations pour déterminer la stratégie, les recommandations disent que, si les deux composantes sont légères, aucune intervention n'est nécessaire.
Si l'une des deux est sévère, une intervention est indiquée. Si les deux sont modérées, les recommandations ne donnent pas de réponse claire. Des publications récentes indiquent toutefois que cette combinaison n'est pas négligeable, avec une piètre survie à court terme sans événements ou sans symptômes.6, 7 En outre, ce sont surtout les patients ayant une vitesse à la sortie de l'orifice aortique > 4 m/s et un gradient moyen > 40 mmHg, ainsi que ceux ayant un remodelage concentrique (RWT > 0,42) qui ont un moins bon pronostic.7 Par conséquent, la recommandation pour ce groupe de valvulopathies aortiques modérées mixtes devrait probablement être d'intervenir en cas de symptômes (rôle du NTproBNP), de dysfonction ventriculaire gauche et de vitesse à la sortie de l'orifice aortique > 4 m/s et de gradient moyen > 40 mmHg, ainsi que de remodelage concentrique.
Cet exemple des valvulopathies mixtes illustre la complexité des MVD et des valvulopathies mixtes. De nouvelles études, de préférence randomisées, devront permettre de mieux comprendre l'approche diagnostique et thérapeutique optimale de ces affections.
à l'avenir, l'explosion des techniques thérapeutiques percutanées des valvulopathies aura un impact majeur sur le traitement des patients atteints de MVD, mais leur place dans la MVD n'a pas encore été prouvée. Notre futur ministre de la Santé pourra donc pousser un soupir de soulagement pendant un certain temps, mais ça ne va pas durer. Il serait préférable de s'atteler à un remboursement correct du TAVI et du MitraClip en Belgique, afin que nous puissions au moins traiter les patients souffrant de maladies monovalvulaires conformément aux recommandations. Malheureusement, c'est encore loin d'être le cas.
Références
- Iung, B. et al. Contemporary presentation and management of valvular heart disease. The EURObservationale research programme valvular heart disease II survey. Circulation, 2019, 140, 1156-1169.
- Unger, P.,Clavel, M.A., Lindma, B.R., Mathieu, P., Pibarot, P. Pathophysiology and management of multivalvular disease. Nat Rev Cardiol, 2016, 13, 429-440.
- Unger, P., Pibarot, P. , Tribouilloy, C., Lancellotti, P., Maisano, F., Iung, B. et al. Multiple and Mixed Valvular Heart Diseases Pathophysiology, Imaging, and Management. Circulation: Cardiovascular Imaging, 2018, 11, 1-13.
- Baumgartner, H. et al. 2017 ESC/EACTS guidelines for the management of valvular heart disease: the task force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J, 2017, 38, 2739-2791.
- Nishimura, R.A., Otto, C.M., Bonow, R.O., Carabello, B.A., Erwin, J.P. III, Fleisher, L.A. et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines. Circulation, 2017, 135: e1159-e1195. DOI: 10.1161/ CIR.0000000000000503.
- Egbe, A.C., Poterucha, J.T., Warnes, C.A. Mixed aortic valve disease: midterm outcome and predictors of adverse events. Eur Heart J, 2016, 37, 2671-2678.
- Zilberszac, R., Gabriel, H., Schemper, M., Zahler, D., Czemy, M., Maurer, G. et al. Outcome of combined stenotic and regurgitant aortic valve disease. J Am Coll Cardiol, 2013, 61, 1489-1495.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.