Op het 39ste BSC-congres stond cardio-oncologie centraal. De Belgische interdisciplinaire werkgroep van acute cardiologie (BIWAC) organiseerde een sessie over acute cardiale pathologie bij de kankerpatiënt aan de hand van casuïstiek. Ook ethische aspecten rond het levenseinde kwamen aan bod. Dr. Constantijn Franssen (UZ Antwerpen) leidde de sessie in met een illustratieve casus van een 43-jarige dame met borstkanker (T3N1M0) met onderliggend een BRCA1-mutatie. Ze onderging initieel neo-adjuvante chemotherapie en een bilaterale mammectomie en klieruitruiming links. Wegens positieve klieren werd ze verder behandeld met radiotherapie en chemotherapie (capecitabine, prodrug 5-fluorouracil [5-FU], en carboplatine). Door deze behandeling ontwikkelde ze coronaire spasmen met een daling van de linkerventrikelfunctie die recupereerde na een vroegtijdige stopzetting van capecitabine. Ze herviel 2 jaar na de initiële diagnose met een levergemetastaseerde ziekte waarvoor immunotherapie werd opgestart in studieverband. De patiënte kreeg avelumab (humaan PD-1L monoklonaal antilichaam) en talazoparib (poly-ADP-ribose-polymerase- inhibitor). Na 2 maanden was er op de PET-CT-scan een goede oncologische respons te zien (figuur 1). Er was echter toenemend pericardvocht met ontstaan van een tamponnade. Die werd succesvol percutaan gedraineerd. De immunotherapie kon worden verdergezet met tot op heden geen recidief van pericardvochtuitstorting en een goede oncologische evolutie.

De ontwikkeling van immuuncheckpointinhibitoren (ICI's) heeft een doorbraak veroorzaakt in antikankertherapie. ICI's helpen T-cellen om kankercellen te herkennen en aan te vallen.
Er zijn verschillende ICI's voorhanden, die verschillende immuuncheckpoints inhiberen (cytotoxic T lymphocyteassociated antigen-4 'CTLA-4', programmed cell death protein 1 'PD- 1', programmed cell death protein 1 ligand 1 'PD-1 ligand 1'). Naast het soms spectaculaire therapeutisch effect op verschillende types tumoren zoals melanoom, niet-kleincellig longcarcinoom en urotheelcelkanker veroorzaken deze geneesmiddelen verschillende vormen van immuungerelateerde toxiciteit in andere organen, waaronder het hart (figuur 2). Aangezien het over relatief nieuwe geneesmiddelen gaat, kan de incidentie, het management en de uitlokkende factoren van deze nevenwerkingen nog niet volledig worden ingeschat.
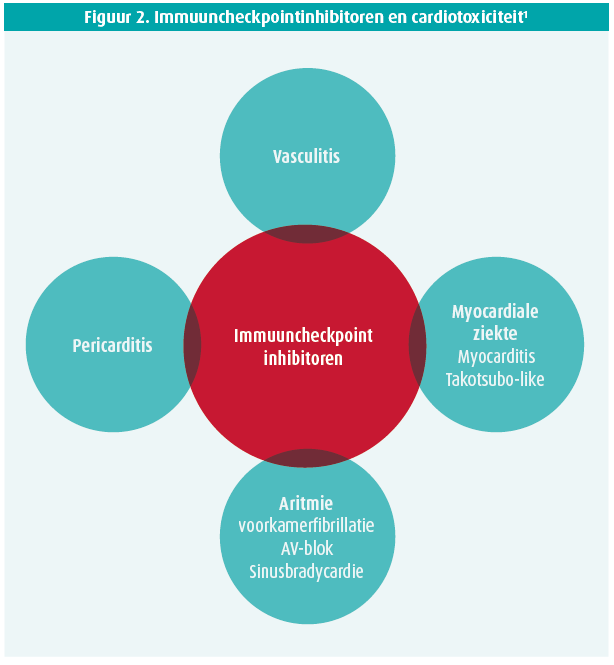
Verwacht wordt dat het aantal patiënten met immuungerelateerde cardiotoxiciteit zal toenemen door het toenemende gebruik van immunotherapie, zodat een uitbouw van een cardio-oncologisch team, ook in acute setting, noodzakelijk is.1
Professor Sofie Gevaert (UZ Gent) gaf een mooi overzicht van de meest frequente acute cardiale pathologie bij kankerpatiënten.
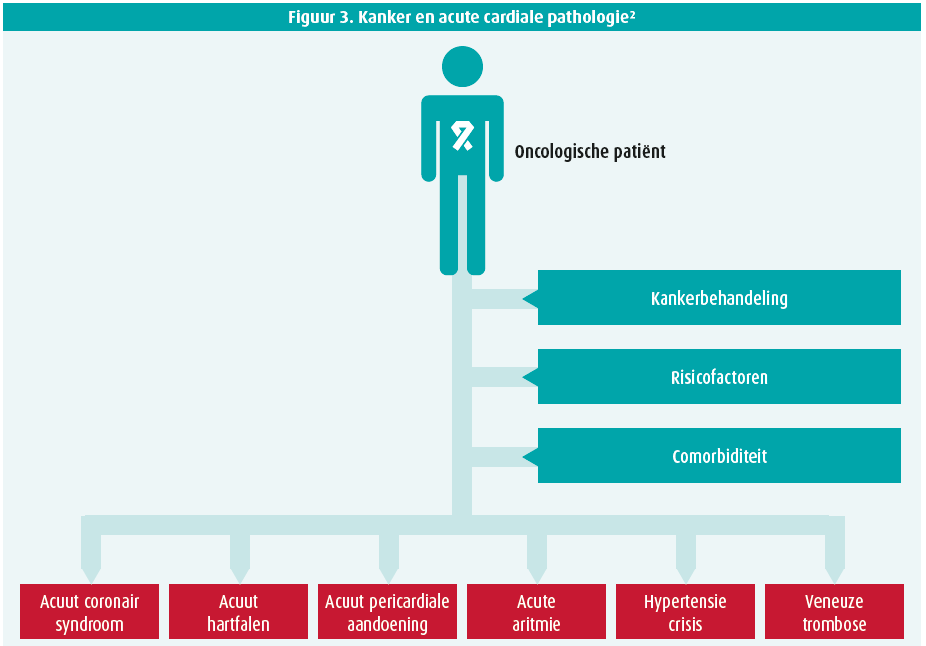
Het risico op het ontwikkelen van een acuut cardiaal event hangt af van de onderliggende oncologische aandoening, de specifieke en potentieel cardiotoxische behandeling voor deze aandoening, naast bijkomende risicofactoren en comorbiditeiten (figuur 3).2
Acuut coronair syndroom (ACS) (figuur 4)
De aanpak van ACS bij de oncologische patiënt gaat gepaard met een aantal uitdagingen.3 De presentatie is vaak atypisch met minder thoracale pijn. Er zijn vaak onzekerheden rond de oncologische prognose van de patiënt die door cardiologen en oncologen niet steeds op dezelfde manier wordt ingeschat. Als de patiënt in de nabije toekomst nog chirurgie nodig heeft in het kader van een tumoraal proces, kan dat de ACS-behandeling beïnvloeden. Het type onderliggende maligniteit bepaalt mee het risico op een ACS. Vooral patiënten met longkanker lopen een hoger risico dan bijvoorbeeld patiënten met een borstcarcinoom, terwijl patiënten met een coloncarcinoom en prostaatcarcinoom een verhoogd bloedingsrisico hebben. De behandeling en/of de tumor kunnen anemie en trombopenie in de hand werken in 10 % van de gevallen. Daarnaast gaat een maligniteit vaak gepaard met een protrombogene toestand met een hogere kans op in-stenttrombose. Ook bepaalde antitumorale middelen zoals cisplatine, thalidomide en anti-VEGF monoklonale antilichamen zijn protrombogeen. Chemotherapie kan bovendien een vertraagde re-endothelialisatie van de stent teweegbrengen. Helaas zijn er tot op heden nog geen specifieke richtlijnen voor het management van ACS in deze groeiende patiëntengroep. Daarnaast worden de algemene ACS-guidelines te weinig toegepast op deze patiënten.
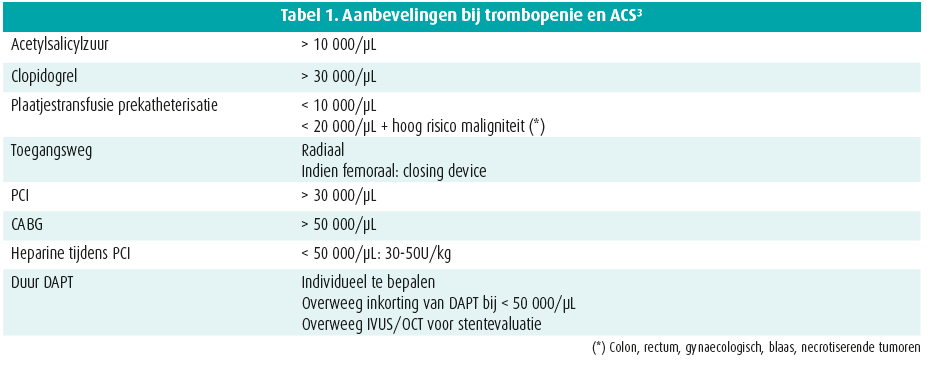
Vasospasmen zijn een mogelijke oorzaak voor ACS onder chemotherapie, voornamelijk met 5-FU en de prodrug capecitabine, maar ook met andere producten zoals paclitaxel, cyclophosphamide, rituximab, sorafenib alsook met ICI's zoals atezolizumab. Het onderliggende mechanisme is onduidelijk. Meestal worden vasospasmen in de hand gewerkt door voorafbestaand coronairlijden. In geval van 5-FU is het risico groter bij hogere doses van chemotherapie en bij een continue toediening, alsook bij combinatie met radiotherapie. Vasospasmen zijn in principe reversibel, maar herstarten van 5-FU is controversieel. Dat moet preferentieel gebeuren in bolustoediening onder strikte monitoring met 72 u op voorhand opstarten van anti-angineuze therapie onder de vorm van nitraten, acetylsalicylzuur en bradycardiserende calciumantagonisten. Vooraf moet coronairlijden worden uitgesloten of gerevasculariseerd. Bij vermoeden van ACS is eenzelfde initiële uitwerking aangewezen als bij niet-oncologische patiënten door middel van elektrocardiogram en labo met hartenzymes. Vroege echocardiografie wordt aangeraden om kinetiekstoornissen op te sporen en vroegtijdig andere kankergerelateerde cardiale complicaties uit te sluiten. Het gaat vaker om NSTEMI dan om STEMI. De oncologische behandeling wordt het best tijdelijk onderbroken. Vasodilatatoren zijn primordiaal, zeker bij vasospasmen. Acetylsalicylzuur wordt bij voorkeur gestart als de bloedplaatjes boven de 10 000/μL zijn, alsook dubbele antiplaatjesbehandeling (clopidogrel) wanneer de bloedplaatjes > 30 000/μL bedragen (tabel 1). Een klassieke optimale medische behandeling post-infarct verbetert cardiovasculaire eindpunten, ook bij kankerpatiënten. Het is van belang dat er minstens een kort overleg plaatsvindt tussen cardioloog en oncoloog voor een optimale gecoördineerde zorg op korte en langere termijn.3
Patiënten met kanker en STEMI hebben een hogere cardiovasculaire mortaliteit op korte termijn en op 1 jaar dan niet-oncologische patiënten met STEMI. PCI verbetert de outcome van deze patiënten.4, 5 Bij patiënten met vergevorderde kanker en NSTEMI zag men in een recente reeks geen verschil in kortetermijnprognose met of zonder PCI.6 Het uitvoeren van een ballonangioplastie alleen lijkt niet zinvol (er is zelfs een trend naar een slechtere outcome); sinds de nieuwe generatie drug-eluting stents, is er een kortere periode mogelijk van dubbele antiplaatjestherapie zodat het best voor dit type stent wordt geopteerd. Onnodige stenting moet vermeden worden door routinegebruik van fractional flow reserve (FFR)-meting om de ernst van coronaire letsels in te schatten.3
Acuut hartfalen (AHF)
Acuut hartfalen kan verschillende etiologieën hebben (figuur 5) en moet volgens de klassieke hartfalenrichtlijnen worden behandeld.7
De aandacht werd gevestigd op takotsubocardiomyopathie en myocarditis.
Takotsubocardiomyopathie wordt gediagnosticeerd bij 10 tot 20 % van de kankerpatiënten die zich met het klinisch beeld van een ACS presenteren, vooral bij postmenopauzale vrouwen. De ziekte kan uitgelokt worden door emotionele en fysieke stress, als gevolg van de maligniteit maar ook door bepaalde antikankerbehandelingen zoals 5-FU, cyclofosfamide, tyrosinekinase-inhibitoren, ICI's, enz. Behandeling is supportief (bètablokkade). De aandoening veroorzaakt toename van mortaliteit maar is reversibel zodat de kankerbehandeling doorgaans na 2 tot 4 weken hervat kan worden.8
Myocarditis is een gevreesde complicatie van behandeling met ICI's en gaat gepaard met een hoge mortaliteit (tot 50 %). Het treedt vaak vroeg (binnen de maand) in de behandeling op. In een patiëntenreeks van 35 gevallen rapporteerde men een incidentie van 1,14 %.9 Slechts in de helft van de gevallen ging de myocarditis gepaard met een significante daling van de linkerventrikelfunctie op initiële echocardiografie en in meer dan een kwart van de gevallen was NT-proBNP nog normaal bij opname. Seriële ecg's en troponines waren afwijkend bij > 95 % van de patiënten onder ICI's en lijken dus beter aangewezen voor de initiële diagnostiek. Bij een klinisch vermoeden van myocarditis wordt het best een echocardiografie verricht. Afhankelijk van de kliniek, moet coronairlijden worden uitgesloten d.m.v. coronarografie. MRI is sterk aanbevolen ter bevestiging van de diagnose, terwijl bioptname gereserveerd is voor ernstige gevallen met gebrek aan respons op de ingestelde behandeling. Naast klassieke hartfalentherapie kan bij matige myocarditis oraal prednisolone 1-2 mg/kg/d worden gestart. Bij ernstige gevallen is 1 g methylprednisolone per dag aangewezen gedurende 3 tot 5 dagen met afbouw over 4-6 weken nadat biomerkers en linkerventrikelfunctie genormaliseerd zijn. Als er geen steroïdrespons is na 24 uur, is een trial met andere immunosuppressiva gewettigd, zoals infliximab, antithymocytenglobuline, mycophenolate mofetil, abatacept en eventueel plasmaferese.1, 7, 9
Acute pericardiale aandoeningen
Pericarditis is een frequente complicatie in oncologische setting en kan het gevolg zijn van radiotherapie, chemotherapie, immunotherapie, de maligniteit zelf of een combinatie van factoren. De behandeling bestaat uit anti-inflammatoire middelen alsook colchicine en het beperken van fysieke activiteit. Steroïden worden bij voorkeur vermeden, tenzij bij recidieven. Bij vermoeden van ICI-gerelateerde pericarditis zijn steroïden wel aangewezen.1, 7, 10
Bij een stabiele effusie kan een conservatieve houding worden aangenomen met opvolging om de 4 tot 6 weken en vroeger indien symptomen. Een punctie in deze situatie kan aangewezen zijn om tot een diagnose te komen. Bij beginnende tekenen van een tamponnade kan verdere beeldvorming voor een diagnostische uitwerking nuttig zijn, alsook een etiologische behandeling. Bij een tamponnade is snelle drainage essentieel, naast volumeresuscitatie en het vermijden van inotropie en intubatie, zo mogelijk.
Percutane drainage is meestal mogelijk, via subxyphoïdale, parasternale of apicale benadering, waarbij men bij het aanprikken aandacht moet hebben voor de ligging van de linker arteria mammaria interna (op 1 cm van het sternum) en de intercostale arteriën die aan de onderzijde van de ribben liggen. Onderzoek van het pericardvocht (cytologie, biologie, bacteriologie) kan in de meerderheid van de gevallen helpen om het onderscheid te maken tussen maligne pericarditis dan wel een complicatie van een behandeling (pseudoprogressie). Bij een vermoeden van maligne pericarditis kan intrapericardiaal een scleroserend agens worden toegediend ter preventie van recidief (bv. bleomycine) maar dit is niet curatief en het kan pijnlijk zijn door de sterk inflammatoire reactie (voornamelijk bij tetracyclines). De prognose van de oncologische patiënt met pericardiale vochtuitstorting is gereserveerd, zeker in geval van een longcarcinoom.10
Acute aritmie
Verschillende cytostatica en adjuvantia kunnen aanleiding geven tot QT-verlenging (arseencomponenten, bepaalde tyrosinekinase-inhibitoren, platinumgebaseerde chemotherapie ten gevolge van magnesiumverlies, anti-emetica). Daarnaast kunnen myocarditis, takotsubo en ACS aanleiding geven tot ventriculaire aritmie. Bradycardie en atrioventriculaire geleidingsstoornissen zijn een nevenwerking van de ICI's en cyclofosfamide. Voorkamerfibrillatie komt typisch voor bij patiënten onder bepaalde tyrosinekinase- inhibitoren, voornamelijk ibrutinib. De kankerpatiënt heeft ook een hoger bloedingsrisico in geval van therapeutische anticoagulatie.1, 7
Acute cardiale pathologie als eerste presentatie van kanker
Diepe veneuze trombose en/of longembolie kan het eerste teken van maligniteit zijn, net zoals een pericardiale effusie. 20 % van de belangrijke pericardiale effusies en 30 % van de tamponnades in de westerse wereld zijn maligne zodat een verdere uitwerking naar maligniteit noodzakelijk is. Primaire cardiale tumoren zijn zeldzaam en in 90 % van de gevallen goedaardig. Metastasen van long, borst, lymfoom en melanoom, gastro-intestinale tractus kunnen voorkomen. Renaalcelcarcinoom kan een invasie veroorzaken van de vena cava inferior met embolisatie naar het rechteratrium. Bij ernstig hartfalen zonder duidelijke oorzaak in een jonge, voorheen gezonde persoon moet een feochromocytoom worden uitgesloten.
Als besluit stelde professor Gevaert dat we bedacht moeten zijn op cardiale complicaties in de oncologische patiëntengroep, zeker in geval van bijkomende risicofactoren. De behandeling van deze patiënt vergt een teamaanpak waarbij de algemene cardiologische richtlijnen het best zoveel mogelijk worden toegepast, mits dialoog tussen de cardioloog en oncoloog.
Eindelevenbeslissingen op de cardiale intensieve zorgen
Dr. Marc Nauwynck, intensivist in AZ Sint-Jan Brugge, stelde een casus voor van een 70-jarige dame met een nieuwe diagnose van acute myeloïde leukemie die tijdens de eerste dagen van de eerste inductiechemokuur een hartstilstand deed op basis van refractaire ventrikelfibrillatie bij onderliggend STEMI inferior. Er werd overgegaan tot extracorporele circulatoire ondersteuning tijdens de reanimatie (VA-ECMO via perifere canulatie). Het inferiorinfarct werd gerevasculariseerd met een drug-eluting stent in de rechtercoronair met nadien opstarten van duale antiplaatjestherapie. De ECMO kon na 2 dagen succesvol verwijderd worden. De patiënte kreeg echter verschillende infectieuze complicaties, beenmergaplasie en multipel orgaanfalen. Uiteindelijk werd overgegaan op comfortzorg na uitgebreid overleg met de hematoloog en de familie met het overlijden van de patiënte tot gevolg.
Dr. Xavier Wittebole (Intensieve zorgen, UCL, Brussel) besprak de verschillende ethische belangen die een arts indachtig moet zijn bij eindelevenbeslissingen en het al dan niet verderzetten van therapie. 11 Het doel van een verblijf op intensieve zorgen is niet alleen overleving, maar vooral een betekenisvolle overleving met een acceptabele kwaliteit van leven. Goed doen, niet schaden, respect voor de autonomie van de patiënt en rechtvaardigheid zijn de 4 basisprincipes in de medische ethiek die afgetoetst moeten worden bij het nemen van beslissingen rond eindeleven. Daarbij is een goede communicatie essentieel waarbij de behandelende artsen, verpleegkundigen en zeker de familie tijdig betrokken wordt. Wanneer geoordeeld wordt dat de behandeling futiel is, is het ethisch verantwoord om therapie niet te geven ('therapy withholding') of te onttrekken ('therapy withdrawal'). Dat gebeurt het best volgens een gestandaardiseerd protocol om een onnodige verlenging van lijden te vermijden. De afwegingen moeten goed gedocumenteerd worden in het medisch dossier.
De moeilijkheid aan de inschatting van de prognose van de patiënt en de zin van een bepaalde therapie is de combinatie van ziektebeelden, bv. een oncoloog heeft wel zicht op de oncologische prognose van de patiënt, maar vaak minder op de prognose van een cardiogene shock met multipel orgaanfalen en vice versa, waardoor prognose vaak door een van de partijen wordt overschat.12 Voorafbestaande zorgplanning ('advanced care planning') ziekenhuisbreed invoeren zou veel discussies tussen artsen en onnodige opnames op intensieve zorgen kunnen voorkomen. In dat kader kan een palliatief zorgteam vroegtijdig worden ingeschakeld, ook al is er nog geen sprake van een louter palliatief beleid. Daarbij is een gesprek over wat de patient zelf wel en niet wenst als zijn of haar toestand deterioreert wenselijk vooraleer een opname op intensieve zorgen zich aandringt.
Referenties
- Hu, J., Florido, R., Lipson, E., Naidoo, J., Ardehali, R., Tocchetti, C. et al. Cardiovascular toxicities associated with immune checkpoint inhibitors. Cardiovasc Res, 2019, 115 (5), 854-868.
- Lenneman, C., Sawyer, D. Cardio-Oncology: An Update on Cardiotoxicity of Cancer-Related Treatment. Circ Res, 2016, 118 (6), 1008-1020.
- Iliescu, C., Grines, C., Herrmann, J., Yang, E., Cilingiroglu, M., Charitakis, K. et al. SCAI Expert consensus statement: Evaluation, management, and special considerations of cardio-oncology patients in the cardiac catheterization laboratory. Catheter Cardiovasc Interv, 2016, 87 (5), E202-23.
- Rohrmann, S., Witassek, F., Erne, P., Rickli, H., Radovanovic, D. Treatment of patients with myocardial infarction depends on history of cancer. Eur Heart J Acute Cardiovasc Care, 2018, 7 (7), 639-645.
- Potts, J., Iliescu, C., Lopez Mattei, J., Martinez, S., Holmvang, L., Ludman, P. et al. Percutaneous coronary intervention in cancer patients: a report of the prevalence and outcomes in the United States. Eur Heart J, 2019, 40, 1790-1800.
- Guddati, A., Joy, P., Kumar, G. Analysis of outcomes of percutaneous coronary intervention in metastatic cancer patients with acute coronary syndrome over a 10-year period. J Cancer Res Clin Oncol, 2016, 142 (2), 471-479.
- Ball, S., Ghosh, R., Wongsaengsak, S., Bandyopadhyay, D., Ghosh, G., Aronow, W.S. et al. 2019 Cardiovascular Toxicities of Immune Checkpoint Inhibitors: JACC Review Topic of the Week. JACC, 2019, 74 (13), 1714-1727.
- Guo, S., Xie, B., Tse, G., Roever, L., Li, G., Wang, Y. et al. Malignancy predicts outcome of Takotsubo syndrome: a systematic review and meta-analysis. Heart Fail Rev, 2020, 20 [Epub ahead of print].
- Mahmood, S., Fradley, M., Cohen, J.V., Nohria, A., Reynolds, K., Heinzerling, L. et al. Myocarditis in Patients Treated With Immune Checkpoint Inhibitors. JACC, 2018, 71 (16), 1755-1764.
- El haddad, D., Iliescu, C., Yusuf, S., William, W., Khair, T., Song, J. et al. Outcomes of Cancer Patients Undergoing Percutaneous Pericardiocentesis for Pericardial Effusion. JACC, 2015, 66 (10), 1119-1128.
- Vincent, J., Schetz, M., De Waele, J., de Cléty, S., Michaux, I., Sottiaux, T. et al. 'Piece' of mind: end of life in the intensive care unit statement of the Belgian Society of Intensive Care Medicine. J Crit Care, 2014, 29 (1), 174-175.
- Benoit, D., Jensen, H., Malmgren, J., Metaxa, V., Reyners, A., Darmon, M., et al. Outcome in patients perceived as receiving excessive care across different ethical climates: a prospective study in 68 intensive care units in Europe and the USA. Intens Care Med, 2018, 44 (7), 1039-1049.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.