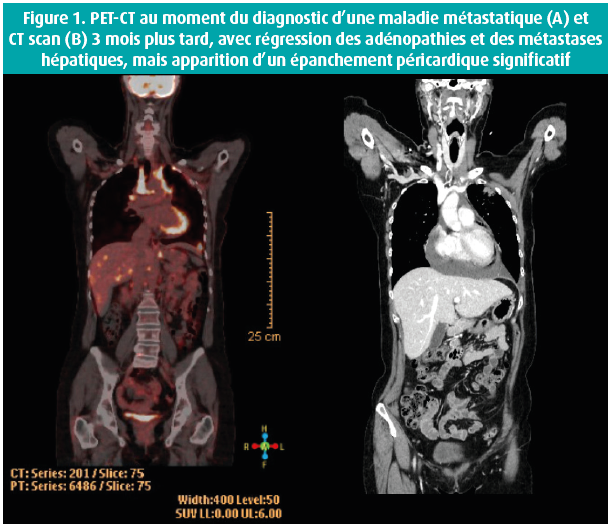
La cardio-oncologie était au centre du 39e congrès de la BSC. Le Groupe interdisciplinaire belge de Cardiologie aiguë (BIWAC) a organisé une session consacrée aux pathologies cardiaques aiguës chez les patients cancéreux, et ce, à l'aide de cas cliniques. Les aspects éthiques relatifs à la fin de vie ont également été abordés. Le Dr Constantijn Franssen (UZ Antwerpen) a introduit la session en illustrant le cas d'une patiente de 43 ans, souffrant d'un cancer du sein (T3N1M0) avec mutation BRCA1 sous-jacente. Initialement, elle avait été traitée par chimiothérapie néoadjuvante et mammectomie bilatérale avec curage axillaire gauche. Par la suite, en raison de ganglions positifs, elle a été traitée par radiothérapie et chimiothérapie (capécitabine, prodrogue du 5-fluorouracil [5-FU], et carboplatine). Suite à ce traitement, elle a développé des spasmes coronariens avec une diminution de la fonction ventriculaire gauche, qui s'est rétablie après l'arrêt précoce de la capécitabine. Elle a rechuté 2 ans après le diagnostic initial, avec des métastases hépatiques suite auxquelles on a instauré une immunothérapie dans le cadre d'une étude clinique. La patiente a reçu de l'avélumab (anticorps monoclonal humain anti-PD-L1) et du talazoparib (inhibiteur de la poly-ADP-ribose-polymérase). Au bout de 2 mois, le PET-CT scan montrait une bonne réponse oncologique (figure 1). Toutefois, elle a développé un épanchement péricardique croissant, avec survenue d'une tamponnade, laquelle a pu être traitée avec succès par drainage percutané. L'immunothérapie a pu être poursuivie. Jusqu'à présent, il n'y a pas eu de récidive de l'épanchement péricardique, et son évolution oncologique est favorable.
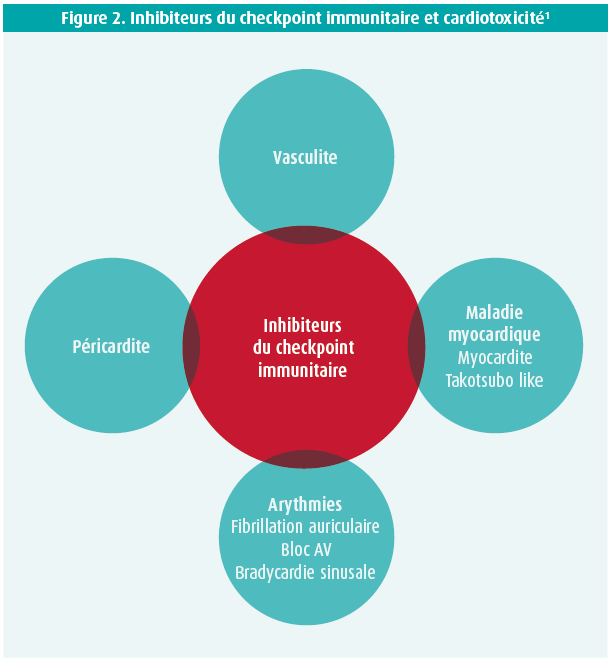
Le développement des inhibiteurs du checkpoint immunitaire (ICI) a été à l'origine d'une percée dans le traitement du cancer. Les ICI aident les cellules T à reconnaître les cellules cancéreuses et à les attaquer. Il existe plusieurs ICI, qui inhibent différents checkpoints immunitaires (cytotoxic T lymphocyte-associated antigen- 4 ou CTLA-4, programmed cell death protein 1 ou PD-1, programmed cell death protein 1 ligand 1 ou PD-1 ligand 1). Outre l'effet thérapeutique parfois spectaculaire sur plusieurs types de tumeurs comme le mélanome, le carcinome pulmonaire non à petites cellules et le carcinome urothélial, ces médicaments provoquent différentes formes de toxicité immuno- médiée dans d'autres organes, notamment le coeur (figure 2). étant donné qu'il s'agit de médicaments relativement récents, on ne peut pas encore évaluer complètement l'incidence, la prise en charge et les facteurs déclenchants de ces effets indésirables. On s'attend à ce que le nombre de patients présentant une cardiotoxicité immuno-médiée augmente suite à l'utilisation croissante de l'immunothérapie, de sorte qu'il est nécessaire de constituer une équipe cardio-oncologique, y compris dans un contexte aigu.1
Le Pr Sofie Gevaert (UZ Gent) a donné un bel aperçu des affections cardiaques aiguës les plus fréquentes chez les patients cancéreux.
Le risque de développer un événement cardiaque aigu dépend de l'affection oncologique sous-jacente, du traitement spécifique et potentiellement cardiotoxique de cette affection, ainsi que des autres facteurs de risque et des comorbidités (figure 3).2
Le syndrome coronarien aigu (SCA) (figure 4)
La prise en charge du SCA chez un patient oncologique pose certains défis.3 La présentation est souvent atypique, avec moins de douleurs thoraciques. Il y a souvent des incertitudes quant au pronostic oncologique du patient, qui n'est pas toujours évalué de la même manière par les cardiologues et les oncologues. Si le patient doit encore être opéré prochainement, dans le cadre d'un processus tumoral, cela peut influencer le traitement du SCA. Le type de malignité sous-jacente détermine également le risque d'un SCA. Les patients atteints d'un cancer du poumon, en particulier, courent un risque plus élevé que les patientes souffrant d'un carcinome mammaire, p. ex., tandis que les patients souffrant d'un carcinome colique ou prostatique courent un risque hémorragique accru. Le traitement et/ou la tumeur peuvent provoquer une anémie et une thrombopénie dans 10 % des cas. En outre, un néoplasme est souvent associé à un état prothrombogène, avec un risque accru de thrombose du stent. Certains agents antitumoraux tels que le cisplatine, la thalidomide et les anticorps monoclonaux anti-VEGF sont également prothrombogènes. La chimiothérapie peut en outre retarder la ré-endothélialisation du stent. Malheureusement, on ne dispose toujours pas de recommandations spécifiques pour la prise en charge d'un SCA dans ce groupe croissant de patients. Par ailleurs, les recommandations générales relatives aux SCA sont trop peu appliquées à ces patients.
Les vasospasmes sont une cause possible de SCA sous chimiothérapie, principalement avec le 5-FU et sa prodrogue, la capécitabine, mais aussi avec d'autres produits tels que le paclitaxel, le cyclophosphamide, le rituximab, le sorafénib ainsi qu'avec des ICI comme l'atézolizumab. Le mécanisme sous-jacent n'est pas clair. La plupart du temps, les vasospasmes sont dus à une maladie coronarienne préexistante. Dans le cas du 5-FU, le risque est plus grand avec des doses plus élevées de chimiothérapie et en cas d'administration continue, ainsi qu'en combinaison avec la radiothérapie. Les vasospasmes sont en principe réversibles, mais la réinstauration du 5-FU est controversée. Il doit de préférence être administré en bolus sous monitoring strict, avec instauration, 72 heures à l'avance, d'un traitement antiangoreux sous forme de dérivés nitrés, d'acide acétylsalicylique et d'antagonistes calciques bradycardisants. Une maladie coronarienne doit être exclue ou revascularisée au préalable.
En cas de suspicion de SCA, on recommande le même bilan initial que chez les patients non oncologiques, avec un électrocardiogramme et une biologie avec les enzymes cardiaques. Une échocardiographie précoce est recommandée pour détecter des troubles cinétiques et exclure précocement d'autres complications cardiaques liées au cancer. Il s'agit plus souvent d'un NSTEMI que d'un STEMI. Il est préférable d'interrompre temporairement le traitement oncologique. Les vasodilatateurs sont primordiaux, surtout en cas de vasospasmes. L'acide acétylsalicylique est de préférence instauré lorsque les plaquettes sont supérieures à 10 000/μl, ainsi qu'une double thérapie antiplaquettaire (clopidogrel) lorsque les plaquettes sont > 30 000/μl (tableau 1). Un traitement médical optimal classique après l'infarctus améliore les critères d'évaluation cardiovasculaire, notamment chez les patients cancéreux. Il est important que le cardiologue et l'oncologue se concertent, au moins brièvement, afin de coordonner au mieux la prise en charge à court et plus long terme.3
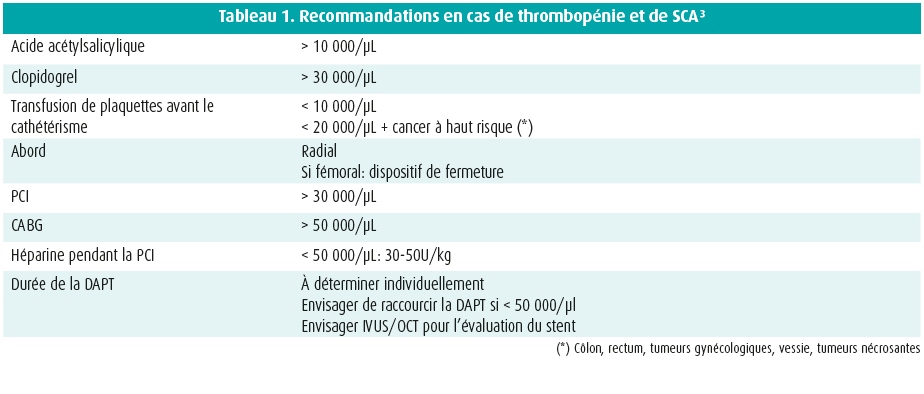
Les patients cancéreux atteints d'un STEMI ont une mortalité cardiovasculaire plus élevée à court terme et à 1 an, comparativement aux patients non oncologiques atteints d'un STEMI. La PCI améliore le pronostic de ces patients.4, 5 Chez les patients atteints d'un cancer avancé et d'un NSTEMI, on n'a pas constaté de différences, dans une série récente, sur le plan du pronostic à court terme avec ou sans PCI.6 La réalisation d'une angioplastie au ballonnet seule ne semble pas judicieuse (on note même une tendance à un plus mauvais résultat); depuis la nouvelle génération de stents médicamenteux, il est possible de raccourcir la durée de la double thérapie antiplaquettaire, de sorte qu'il est préférable d'opter pour ce type de stent. Il faut éviter un stenting inutile via l'utilisation systématique de la mesure de la réserve coronaire (FFR), afin d'évaluer la sévérité des lésions coronaires.3
Insuffisance cardiaque aiguë
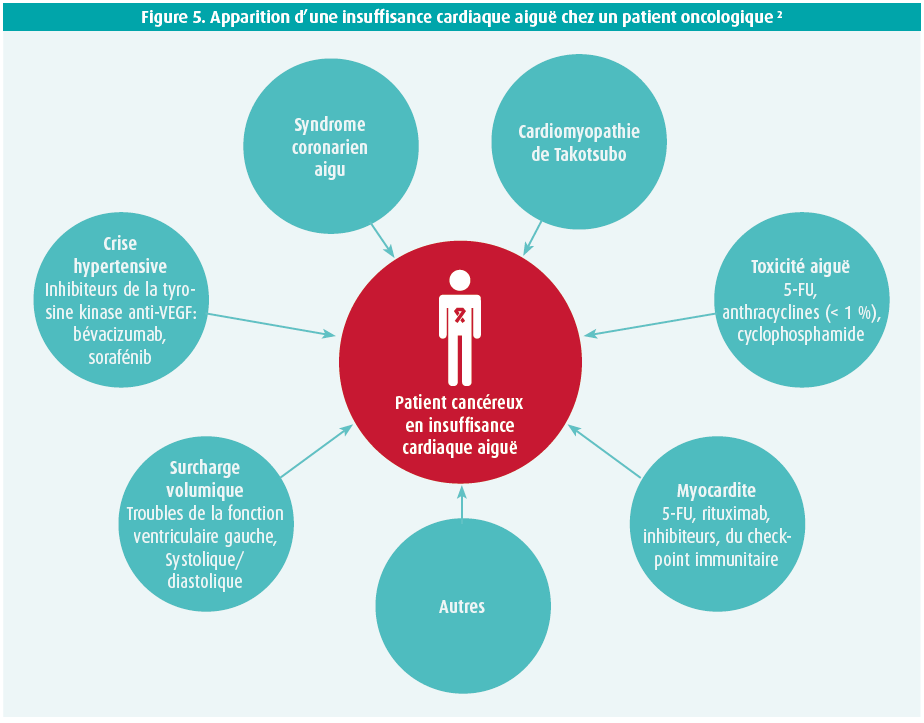
L'insuffisance cardiaque aiguë (AHF) peut avoir plusieurs étiologies (figure 5), et elle doit être traitée conformément aux recommandations classiques au sujet de l'insuffisance cardiaque.7
L'attention a été fixée sur la cardiomyopathie de Takotsubo et la myocardite.
On diagnostique une cardiomyopathie de Takotsubo chez 10 à 20 % des patients cancéreux qui se présentent avec un tableau clinique de SCA, surtout chez les femmes postménopausées. La maladie peut être déclenchée par un stress émotionnel et physique, à cause de l'affection maligne, mais aussi par certains traitements anticancéreux tels que le 5-FU, le cyclophosphamide, les inhibiteurs de la tyrosine kinase, les ICI, etc. On instaurera un traitement de soutien (bêtabloquants). L'affection provoque une augmentation de la mortalité, mais elle est réversible, de sorte que le traitement anticancéreux peut habituellement être repris 2 à 4 semaines plus tard.8
La myocardite constitue une complication redoutée d'un traitement par ICI, et elle est grevée d'une mortalité élevée (jusqu'à 50 %). Elle survient souvent tôt durant le traitement (dans un délai d'un mois). Dans une série de 35 patients, on a rapporté une incidence de 1,14 %.9 Ce n'est que dans la moitié des cas que la myocardite allait de pair avec une diminution significative de la fonction ventriculaire gauche à l'échocardiographie initiale et, dans plus d'un quart des cas, le NT-proBNP était encore normal à l'admission. Les ecg et les dosages de troponine pratiqués en série étaient anormaux chez > 95 % des patients sous ICI, et ils semblent donc mieux indiqués pour le diagnostic initial. En cas de suspicion clinique de myocardite, il est préférable de pratiquer une échocardiographie. En fonction de la clinique, il faut exclure une maladie coronarienne via une coronarographie. L'IRM est fortement recommandée pour confirmer le diagnostic, tandis que la biopsie est réservée aux cas graves avec absence de réponse au traitement instauré. En plus du traitement classique de l'insuffisance cardiaque, on peut administrer de la prednisolone par voie orale à raison de 1-2 mg/kg/j, en cas de myocardite modérée. Dans les cas graves, l'administration de 1 g de méthylprednisolone par jour est indiquée pendant 3 à 5 jours, avec diminution progressive de la dose sur 4-6 semaines, après la normalisation des biomarqueurs et de la fonction ventriculaire gauche. En l'absence de réponse aux stéroïdes au bout de 24 heures, on peut tenter d'autres immunosuppresseurs tels que l'infliximab, les globulines antithymocytes, le mycophénolate mofétil, l'abatacept et éventuellement une plasmaphérèse.1, 7, 9
Affections péricardiques aiguës
La péricardite est une complication fréquente dans un contexte oncologique, et elle peut être la conséquence de la radiothérapie, de la chimiothérapie, de l'immunothérapie, du néoplasme lui-même, ou encore d'une combinaison de facteurs. Le traitement consiste en anti-inflammatoires ainsi qu'en colchicine et en une limitation de l'activité physique. Il est préférable d'éviter les stéroïdes, sauf en cas de récidives. En revanche, en cas de suspicion de péricardite liée aux ICI, les stéroïdes sont indiqués.1, 7, 10
Si l'épanchement est stable, on peut adopter une attitude conservatrice avec un suivi toutes les 4 à 6 semaines, ou plus tôt en cas de symptômes. Dans cette situation, une ponction peut être indiquée pour poser le diagnostic. En cas de signes de tamponnade débutante, il peut être utile de recourir à une imagerie plus poussée pour le bilan diagnostique et un traitement étiologique. En cas de tamponnade, un drainage rapide se révèle essentiel, en plus de la ressuscitation volumique, si possible. On évitera également les agents inotropes et l'intubation.
Le drainage percutané est le plus souvent possible par voie sous-xyphoïdienne, parasternale ou apicale, en faisant attention à ne pas perforer l'artère mammaire interne gauche (à 1 cm du sternum) ni les artères intercostales situées à la face inférieure des côtes lors de la ponction. L'examen du liquide péricardique (cytologie, biologie, bactériologie) peut, dans la majorité des cas, aider à faire la distinction entre une péricardite maligne ou une complication d'un traitement (pseudoprogression). En cas de suspicion de péricardite maligne, un agent sclérosant peut être administré par voie intrapéricardique pour prévenir une récidive (p. ex., la bléomycine), mais cela n'est pas curatif et peut s'avérer douloureux, en raison de la forte réaction inflammatoire (en particulier avec les tétracyclines). Le pronostic du patient oncologique présentant un épanchement péricardique est réservé, surtout en cas de carcinome pulmonaire.10
Arythmie aiguë
Plusieurs cytostatiques et adjuvants peuvent entraîner un allongement de l'intervalle QT (composés de l'arsenic, certains inhibiteurs de la tyrosine kinase, chimiothérapie à base de platine en raison de la perte de magnésium, antiémétiques). En outre, une myocardite, un Takotsubo et un SCA peuvent provoquer des arythmies ventriculaires. La bradycardie et les troubles de la conduction auriculo-ventriculaire sont un effet indésirable des ICI et du cyclophosphamide. La fibrillation auriculaire se produit typiquement chez les patients traités par certains inhibiteurs de la tyrosine kinase, principalement l'ibrutinib. Le patient cancéreux court également un risque hémorragique accru en cas d'anticoagulation thérapeutique.1, 7
Une pathologie cardiaque aiguë comme première manifestation d'un cancer
Une thrombose veineuse profonde et/ou une embolie pulmonaire peuvent être le premier signe d'une affection maligne, tout comme un épanchement péricardique. Dans le monde occidental, 20 % des épanchements péricardiques importants et 30 % des tamponnades sont malins, il est donc nécessaire de pratiquer une mise au point complémentaire à la recherche d'une affection maligne. Les tumeurs cardiaques primaires sont rares et bénignes dans 90 % des cas. On peut observer des métastases provenant du poumon, du sein, du tractus gastro-intestinal, de lymphomes et de mélanomes. Le carcinome à cellules rénales peut provoquer un envahissement de la veine cave inférieure avec embolisation vers l'oreillette droite. En cas d'insuffisance cardiaque sévère sans cause évidente chez une personne jeune, auparavant en bonne santé, il faut exclure un phéochromocytome.
Pour conclure, le Pr Gevaert a souligné que nous devons être attentifs aux complications cardiaques dans le groupe des patients oncologiques, surtout en cas de facteurs de risque additionnels. Le traitement de ces patients nécessite un travail en équipe lors duquel les recommandations cardiologiques générales doivent être appliquées au mieux, moyennant un dialogue entre le cardiologue et l'oncologue.
Les décisions de fin de vie aux soins intensifs cardiaques
Le Dr Marc Nauwynck, intensiviste à l'AZ Sint-Jan de Bruges, a présenté le cas d'une patiente de 70 ans chez qui on avait posé un nouveau diagnostic de leucémie myéloïde aiguë, et qui avait fait un arrêt cardiaque au cours des premiers jours de sa première cure de chimiothérapie d'induction, suite à une fibrillation ventriculaire réfractaire due à un STEMI inférieur sous-jacent. Durant la réanimation, on a mis en place une assistance circulatoire extracorporelle (ECMO VA par canulation périphérique). L'infarctus inférieur a été revascularisé à l'aide d'un stent médicamenteux placé dans la coronaire droite, après quoi on a instauré une double thérapie antiplaquettaire. L'ECMO a pu être enlevé avec succès au bout de 2 jours. Cependant, la patiente a souffert de plusieurs complications infectieuses, d'une aplasie médullaire et d'une défaillance multiviscérale. Finalement, après une consultation élaborée avec l'hématologue et la famille, on a décidé de passer à des soins de confort, qui ont été suivis du décès de la patiente.
Le Dr Xavier Wittebole (Soins intensifs, UCL, Bruxelles) a évoqué les différents intérêts éthiques dont un médecin doit tenir compte lors de la prise de décisions de fin de vie et de la poursuite - ou non - d'un traitement.11 Le but d'un séjour aux soins intensifs n'est pas uniquement la survie, mais surtout la signification de celle-ci, avec une qualité de vie acceptable. Faire du bien, ne pas nuire, respecter l'autonomie du patient et la justice sont les 4 principes de base de l'éthique médicale, qui doivent être analysés lors de la prise de décisions de fin de vie. à cet égard, une bonne communication est essentielle, et elle implique les médecins traitants, les praticiens de l'art infirmier et certainement la famille. Lorsqu'on estime que le traitement est futile, il est éthiquement raisonnable de ne pas donner de traitement ('therapy withholding') ou de l'arrêter ('therapy withdrawal'). Il est préférable de le faire selon un protocole standardisé, afin d'éviter de prolonger inutilement les souffrances. Les considérations doivent être bien documentées dans le dossier médical.
La difficulté d'estimer le pronostic du patient et le sens d'un traitement particulier réside dans la combinaison des tableaux cliniques. Ainsi, un oncologue a une idée du pronostic oncologique du patient, mais il a souvent une idée moins précise que le cardiologue du pronostic d'un choc cardiogénique avec défaillance multiviscérale et vice versa, de sorte que le pronostic est souvent surestimé par l'un des intervenants.12 L'introduction préalable d'une planification avancée des soins (advanced care planning) à l'échelle de l'hôpital pourrait éviter bien des discussions entre médecins et des admissions inutiles aux soins intensifs. Dans ce contexte, une équipe de soins palliatifs peut être appelée à un stade précoce, même s'il n'est pas encore question d'une approche purement palliative. Sur ce plan, il est souhaitable de demander au patient ce qu'il souhaite et ce qu'il refuse si son état devait se détériorer, et ce, avant qu'une admission aux soins intensifs ne s'impose.
Références
- Hu, J., Florido, R., Lipson, E., Naidoo, J., Ardehali, R., Tocchetti, C. et al. Cardiovascular toxicities associated with immune checkpoint inhibitors. Cardiovasc Res, 2019, 115 (5), 854-868.
- Lenneman, C., Sawyer, D. Cardio-Oncology: An Update on Cardiotoxicity of Cancer-Related Treatment. Circ Res, 2016, 118 (6), 1008-1020.
- Iliescu, C., Grines, C., Herrmann, J., Yang, E., Cilingiroglu, M., Charitakis, K. et al. SCAI Expert consensus statement: Evaluation, management, and special considerations of cardio-oncology patients in the cardiac catheterization laboratory. Catheter Cardiovasc Interv, 2016, 87 (5), E202-23.
- Rohrmann, S., Witassek, F., Erne, P., Rickli, H., Radovanovic, D. Treatment of patients with myocardial infarction depends on history of cancer. Eur Heart J Acute Cardiovasc Care, 2018, 7 (7), 639-645.
- Potts, J., Iliescu, C., Lopez Mattei, J., Martinez, S., Holmvang, L., Ludman, P. et al. Percutaneous coronary intervention in cancer patients: a report of the prevalence and outcomes in the United States. Eur Heart J, 2019, 40, 1790-1800.
- Guddati, A., Joy, P., Kumar, G. Analysis of outcomes of percutaneous coronary intervention in metastatic cancer patients with acute coronary syndrome over a 10-year period. J Cancer Res Clin Oncol, 2016, 142 (2), 471-479.
- Ball, S., Ghosh, R., Wongsaengsak, S., Bandyopadhyay, D., Ghosh, G., Aronow, W.S. et al. 2019 Cardiovascular Toxicities of Immune Checkpoint Inhibitors: JACC Review Topic of the Week. JACC, 2019, 74 (13), 1714-1727.
- Guo, S., Xie, B., Tse, G., Roever, L., Li, G., Wang, Y. et al. Malignancy predicts outcome of Takotsubo syndrome: a systematic review and meta-analysis. Heart Fail Rev, 2020, 20 [Epub ahead of print].
- Mahmood, S., Fradley, M., Cohen, J.V., Nohria, A., Reynolds, K., Heinzerling, L. et al. Myocarditis in Patients Treated With Immune Checkpoint Inhibitors. JACC, 2018, 71 (16), 1755-1764.
- El haddad, D., Iliescu, C., Yusuf, S., William, W., Khair, T., Song, J. et al. Outcomes of Cancer Patients Undergoing Percutaneous Pericardiocentesis for Pericardial Effusion. JACC, 2015, 66 (10), 1119-1128.
- Vincent, J., Schetz, M., De Waele, J., de Cléty, S., Michaux, I., Sottiaux, T. et al. 'Piece' of mind: end of life in the intensive care unit statement of the Belgian Society of Intensive Care Medicine. J Crit Care, 2014, 29 (1), 174-175.
- Benoit, D., Jensen, H., Malmgren, J., Metaxa, V., Reyners, A., Darmon, M., et al. Outcome in patients perceived as receiving excessive care across different ethical climates: a prospective study in 68 intensive care units in Europe and the USA. Intens Care Med, 2018, 44 (7), 1039-1049.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.