Inleiding
Atherosclerotisch coronairlijden blijft tot op vandaag een van de belangrijkste oorzaken van mortaliteit, morbiditeit en gezondheidskosten wereldwijd1. Met de identificatie en agressieve controle van de traditionele risicofactoren voor atherosclerose zoals hypertensie, diabetes, roken en cholesterol is een sterke daling van het aantal majeure cardiovasculaire events (MACE) bereikt2. Ondanks de huidige behandeling van deze risicofactoren in patiënten met aangetoonde coronaire ziekte blijft hun cardiovasculaire risico hoog, met een MACE-incidentie tot 20 % in de drie jaar na het doormaken van een myocardinfarct3. Dat kan verklaard worden door het feit dat atherosclerose een pathofysiologie heeft die complexer is dan louter een intimale infiltratie van cholesterol. Dankzij experimentele en klinische studies is duidelijk geworden dat inflammatie een belangrijke rol speelt in de start en progressie van atherosclerose, evenals in het ontstaan van trombotische complicaties4. In dit artikel zal de rol van inflammatie in de pathofysiologie van atherosclerose worden toegelicht en de recente data van klinische studies met anti-inflammatoire behandelingen, in het bijzonder colchicine, in secundaire cardiovasculaire preventie.
Inflammatie in de pathofysiologie van atherosclerose
In de vroegste fases van atherosclerose zorgt blootstelling aan schadelijke externe factoren zoals hypercholesterolemie, hypertensie en pro-inflammatoire cytokines ervoor dat de intimale barrière wordt doorbroken en dat LDL-cholesterol subintimaal wordt vastgehouden door interacties met proteoglycanen die zich in de extracellulaire matrix bevinden5, 6 (figuur 1).
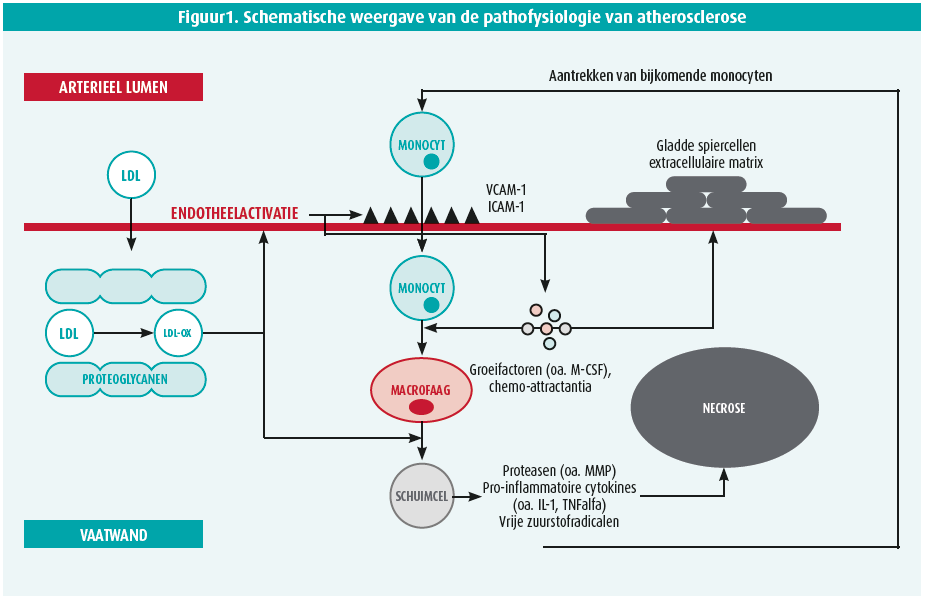
Door deze interactie worden de cholesterolpartikels geoxideerd en worden de endotheelcellen eveneens geactiveerd, waarbij diverse adhesiemolecules (o.a. VCAM-1 en ICAM-1) worden vrijgesteld die de binding en subendotheliale opname van immuuncellen (neutrofielen, monocyten en T-lymfocyten) faciliteren5-7. Daarnaast zetten geactiveerde endotheelcellen grote hoeveelheden groeifactoren vrij die de groei van gladde spiercellen en extracellulaire matrix stimuleren, alsook monocyten aantrekken en deze stimuleren tot omvorming naar macrofagen en uiteindelijk schuimcellen na opname van geoxideerd LDL-cholesterol6, 7. De accumulerende schuimcellen zetten op hun beurt pro-inflammatoire cytokines, proteasen en vrije zuurstofradicalen vrij en trekken zo bijkomende monocyten aan en veroorzaken apoptose van cellen in de diepere lagen7, 8. Deze cascade versterkt zich steeds weer waardoor een accumulerend atheroom ontstaat met daarrond een bindweefselkapsel, een fibro-atheroom, en een necrotisch centrum binnenin7, 8. T-cellen infiltreren in dit necrotische centrum en zetten samen met de schuimcellen een reeks van pro-inflammatoire cytokines vrij, met onder andere de activatie van het NLRP-3-inflammasoom tot gevolg (figuur 2). Vanuit dit geactiveerd inflammasoom worden voornamelijk de pro-inflammatoire interleukines IL-1β en IL-18 vrijgesteld, die later in de cascade zorgen voor de aanmaak van IL-6 en uiteindelijk ook voor de vorming van C-reactief proteïne (CRP) in de lever7, 9. Het tot dan toe lokaal inflammatoire proces verspreidt zich op die manier meer en meer naar de systemische circulatie. De NLRP-3-signaalcascade blijkt dan ook een van de belangrijkste cascades te zijn in het proces van atherogenese en blijkt van belang bij recidief cardiovasculaire events in patiënten met atherosclerose10-12.
Anti-inflammatoire therapie in de behandeling van atherosclerose
Vanwege de toenemende experimentele en epidemiologische data over de rol van inflammatie in de pathofysiologie van atherosclerose is er de laatste jaren toenemend onderzoek gevoerd naar anti-inflammatoire behandelingen in de cardiovasculaire preventie. Zowel nieuwe, specifieke anti-inflammatoire behandelingen als het hergebruik van oudere anti-inflammatoire middelen zijn in deze context onderzocht.
Canakinumab en de CANTOS-studie: proof-of-concept
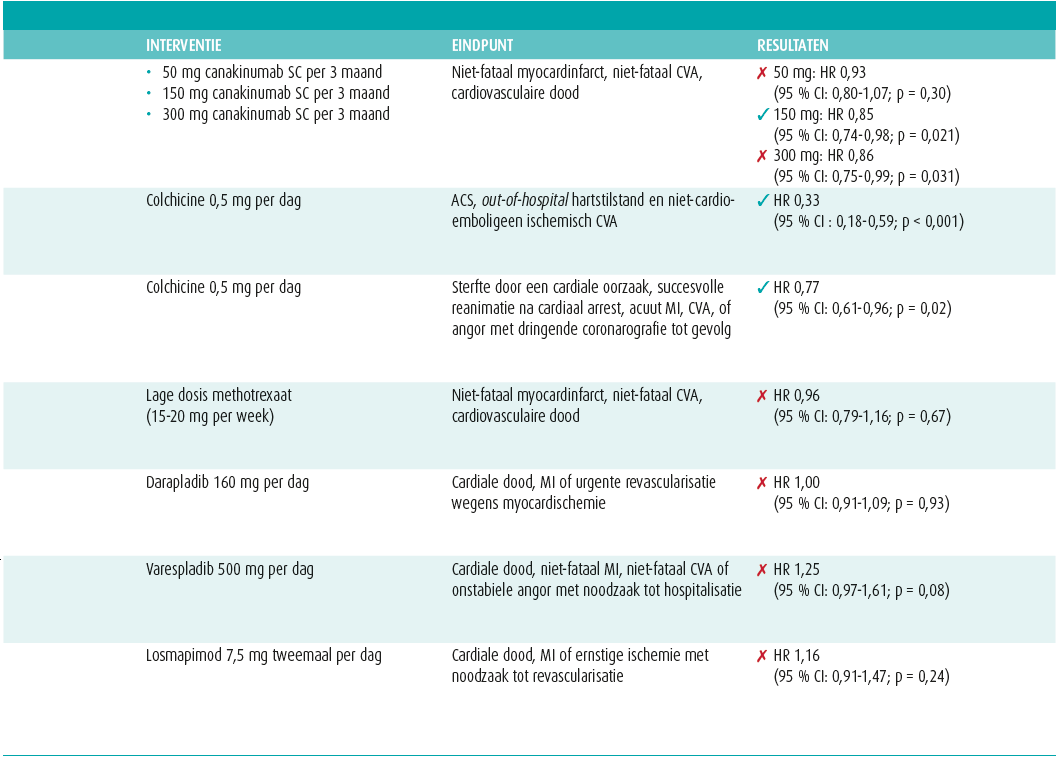
Canakinumab is een humaan monoklonaal antilichaam dat de werking van IL-1β blokkeert en daarbij ook downstream de plasmaspiegels van IL-6 en hs-CRP verlaagt13. Zoals eerder aangehaald staan deze pro-inflammatoire cytokines centraal in het proces van atherogenese (samen met de andere cytokines uit de NLRP-3-signaalcascade) (figuur 1 en 2)14. In 2017 werd in de 'Canakinumab Anti-Inflammatory Thrombosis Outcomes Study (CANTOS)'-studie geëxploreerd of canakinumab hierdoor aanleiding kon geven tot een reductie in cardiovasculair lijden14. In deze studie werden 10 061 patiënten met een doorgemaakt myocardinfarct en een hoogsensitief-CRP (hsCRP) ≥ 2 mg/L gerandomiseerd in vier armen volgens een 1,5:1:1:1-distributie, waarbij de eerste groep placebo ontving en de andere drie groepen diverse dosissen canakinumab (respectievelijk 50 mg, 150 mg en 300 mg driemaandelijks subcutaan). Het primaire eindpunt werd samengesteld uit niet-fataal myocardinfarct (MI), cerebrovasculair event (CVA) en cardiovasculaire dood. Na een gemiddelde opvolgtermijn van 3,7 jaar, bleken de hogere doseringen (150 mg en 300 mg) aanleiding te geven tot een 15%-risicoreductie op het primair eindpunt, maar alleen de dosering van 150 mg voldeed aan het vooropgestelde significantieniveau (HR 0,85; 95 % CI: 0,74-0,98; p = 0,021)14. De lagere dosering gaf een niet-significante reductie van 7 %14, 15. De risicoreductie bleek bovendien het grootst bij de patiënten met de grootste reductie in IL-6- en hsCRP-spiegels16. Dit draagt bij aan de hypothese dat residuele inflammatie het cardiovasculair risico verhoogt16. Bovendien moet worden opgemerkt dat er een goed gecontroleerde lipidenstatus aanwezig was bij alle patiënten in elke onderzoeksgroep (statinetherapie bij ± 91 % van de patiënten met een mediane LDL-spiegel van 82 mg/dL). Dit suggereert dat het geobserveerde effect zich onafhankelijk van de lipidenstatus afspeelt14. Het gunstige cardiovasculaire effect ging echter deels verloren door een incidentiestijging van fatale infecties14. Daarenboven is canakinumab een duur preparaat (één injectie van 150 mg kost 10 828 EUR)17. Deze elementen hebben ertoe geleid dat de zoektocht werd voortgezet naar goedkopere preparaten met een gunstiger bijwerkingsprofiel, maar de CANTOS-trial werd wel gezien als een proof-of-concept voor het belang van een gerichte anti-inflammatoire behandeling in secundaire cardiovasculaire risicopreventie.
Methotrexaat en de CIRT-studie
Methotrexaat (MTX) is een goedkoop en toegankelijk preparaat waarmee diverse inflammatoire pathologieën behandeld worden18. Het is werkzaam als een foliumzuurantagonist door inhibitie van het enzym difolaatreductase19. De exacte manier waarop het zijn anti-inflammatoire werking uitoefent blijft tot op heden echter onduidelijk, maar inhibitie van T-celproliferatie en opstapeling van adenosine (wat anti-inflammatoire eigenschappen heeft) zouden hiertoe bijdragen19. Daarenboven zou MTX het transport van cholesterol naar de lever bevorderen, en aldus leiden tot een reductie in schuimcelvorming ter hoogte van de atherosclerotische plaques20. Enkele retrospectieve studies toonden in het verleden reeds aan dat patiënten met reumatologische aandoeningen, behandeld met een lage dosis MTX, minder cardiovasculaire events kenden dan patienten die placebo of andere therapieën ontvingen21-23. Deze hypothese werd dan ook verder geëxploreerd in 2018 met de publicatie van de 'Cardiovascular Inflammation Reduction Trial (CIRT)'-studie18.
Hierin werden 4 786 patiënten met een voorgaand myocardinfarct en/of gekend meertakslijden en daarenboven de aanwezigheid van diabetes mellitus type 2 of metaboolsyndroom gerandomiseerd in twee armen. Enerzijds tot een behandeling met placebo, anderzijds tot een behandeling met lage dosis MTX (15-20 mg per week). Het primaire eindpunt was identiek aan dat van de CANTOS-studie. Na een mediane opvolging van 2,3 jaar werd echter geen significant verschil gevonden op dit primaire eindpunt (HR 0,96; 95 % CI: 0,79-1,16; p = 0,67)18.
Het is hierbij van belang te noteren dat MTX, in tegenstelling tot canakinumab, de serumspiegels van IL1-β, IL-6 of hsCRP niet bleek te reduceren18. Het potentiële gunstige cardiovasculaire effect van de anti-inflammatoire behandeling leek aldus af te hangen van de cascade die geblokkeerd werd18. Dat bleek ook uit enkele andere omvangrijke gerandomiseerde studies met anti-inflammatoire preparaten (tabel 1). Zo toonde de SOLID-TIMI 52-studie in 2014 geen verschil in cardiovasculaire uitkomst tussen patiënten die na het doormaken van een acuut coronair syndroom gerandomiseerd werden tussen een behandeling met darapladib (een fosfolipase-inhibitor), dan wel placebo24. Gelijkaardige resultaten werden gezien in de VISTA-16-trial met een andere fosfolipase-inhibtor, namelijk varespladib25. Ook de behandeling met losmapimod (een p38 MAP-kinase-inhibitor) bleek in 2016 geen significante cardiovasculaire risicoreductie teweeg te brengen26. Ook andere anti-inflammatoire molecules konden tot op heden geen significant effect bewijzen (o.a. 5-LO-inhibitoren, activine A)27. Al deze preparaten hadden bovendien gemeen dat zij niet resulteerden in een reductie van de serumspiegels van IL-1β, IL-6 of hsCRP18. Daardoor rees de hypothese dat de inhibitie van de NLRP-3-signaalcascade nagestreefd moest worden om een cardiovasculaire risicoreductie te verkrijgen18.
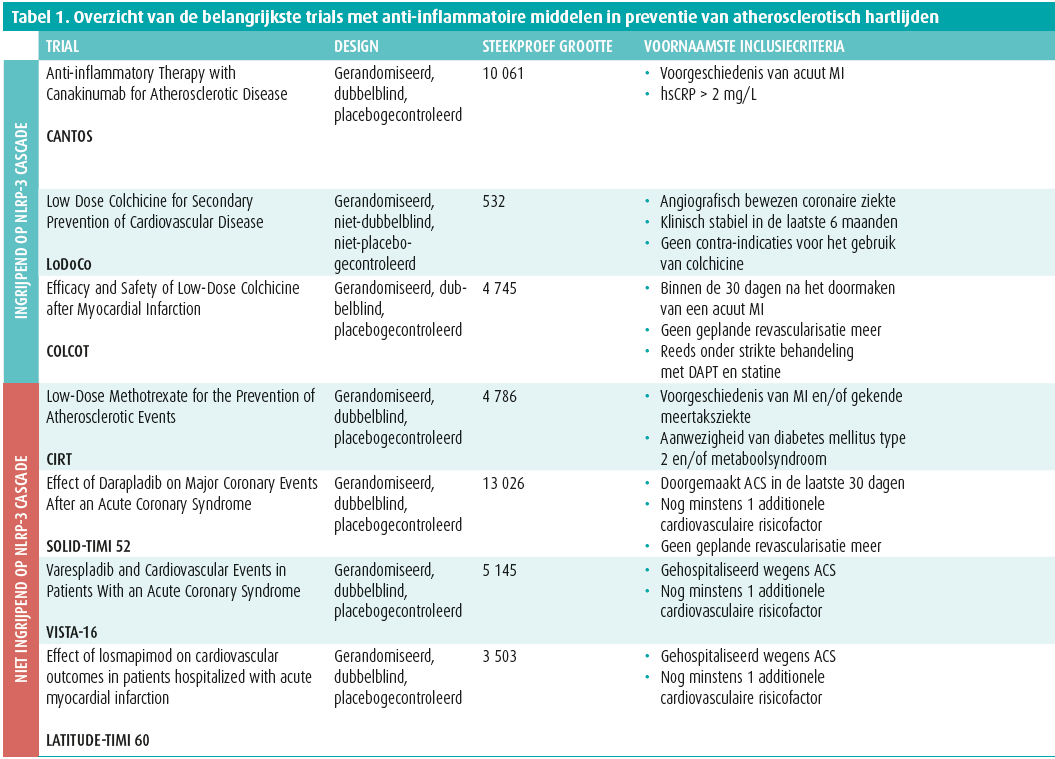
Colchicine: de LoDoCo- en COLCOT-studie
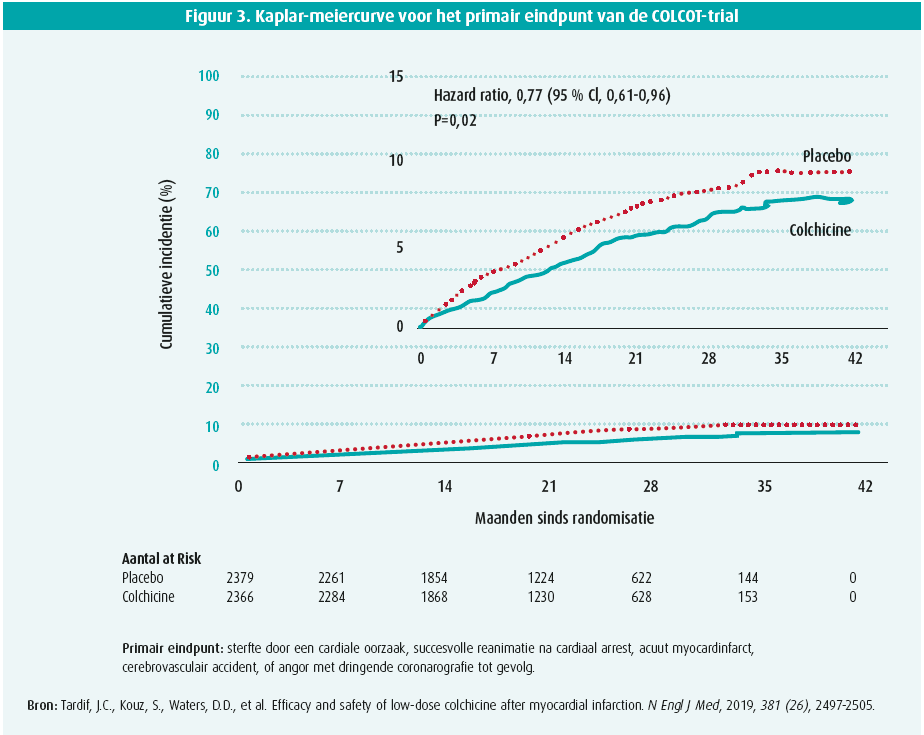
De zoektocht richt zich dus naar een toegankelijke anti-inflammatoire behandeling met primair de NLRP-3 signaalcascade als doelwit en een aanvaardbaar bijwerkingsprofiel. Colchicine is een goedkoop anti-inflammatoir preparaat en kan bovendien peroraal worden ingenomen28. Zijn anti-inflammatoire werking heeft het te danken aan o.a. de inhibitie van het NLRP-3-inflammasoom waarbij er een bewezen daling is van de serumspiegels van IL-1β en IL-18, IL-6 en hsCRP29. In de 'Low-Dose Colchicine for secondary prevention of cardiovascular disease trial' (LoDoCo-studie) uit 2013 werden 532 patiënten met stabiel coronairlijden gerandomiseerd tot al dan niet een bijkomende behandeling met een lage dosis colchicine (0,5 mg/dag) boven op de gewoonlijke medicamenteuze therapie30. De patiënten onder colchicine toonden daarbij een significante reductie op het primaire eindpunt (bestaande uit acuut coronair syndroom, cerebrovasculair accident en out-of-hospital arrest) (HR 0,33; 95% CI: 0,18-0,59; p < 0,001)30. Ondanks de spectaculaire resultaten moest worden opgemerkt dat deze studie niet placebogecontroleerd en van een relatief beperkte omvang was. Om de resultaten te valideren werd dan ook de 'Colchicine Cardiovascular Outcomes Trial' (COLCOT) opgezet, waarvan de resultaten in 2019 werden gepubliceerd in de New England Journal of Medicine28. In deze studie werden 4 745 patiënten geïncludeerd binnen de eerste 30 dagen na het doormaken van een myocardinfarct, en gerandomiseerd tot een behandeling met een lage dosis colchicine (0,5 mg per dag), dan wel placebo28. Het primaire eindpunt was samengesteld uit sterfte door een cardiale oorzaak, succesvolle reanimatie na cardiaal arrest, acuut myocard infarct, cerebrovasculair accident, of angorklachten met dringende katheterisatie tot gevolg28. Na een mediane opvolging van iets minder dan 2 jaar zag men een significante risicoreductie op het primaire eindpunt van 23 % (HR 0,77; 95 % CI: 0,61-0,96; P = 0,02)28. Belangrijk is te vermelden dat quasi alle patiënten adequate standaardtherapie met duale antiplaatjes en een statine ontvingen, en dit dus niet bijdraagt tot de positieve resultaten28. De meest gerapporteerde bijwerkingen waren van gastro-intestinale origine met als voornaamste klacht diarree (bij 9,7 % van de mensen onder colchicine). Daarnaast werden ook iets meer infecties gerapporteerd (2,2 % t.o.v. 1,6 %), maar in tegenstelling tot canakinumab werd bij colchicine geen verhoogde incidentie van sepsis en septische shock gerapporteerd28.
Met colchicine lijkt aldus een goedkoop, veilig en eenvoudig beschikbaar preparaat te zijn (her)ontdekt met bewezen cardiovasculaire risicoreductie. Meerdere trials zijn lopende om deze resultaten te valideren, waaronder de LoDoCo2-trial (https://www.clinicaltrialsregister.eu/ ctr-search/trial/2015-005568-40/NL) en de CLEAR-SYNERGY-trial (https://clinicaltrials. gov/ct2/show/NCT03048825). Als ook hier de resultaten concordant zijn, zal colchicine zich meer en meer kunnen opwerpen als een bijkomende strategie om het cardiovasculaire risico te reduceren na doormaken van een acuut coronair syndroom9.
Conclusie
Recente experimentele en epidemiologische studies hebben aangetoond dat de inflammatoire cascade een belangrijke rol speelt in de progressie en complicaties van atherosclerose. Daarbij is gebleken dat gerichte anti-inflammatoire therapie, meer bepaald de inhibitie van de NLRP-3-signaalcascade, leidt tot een effectieve cardiovasculaire risicoreductie. Het oude product colchicine kan daarbij een goedkope en veilige optie zijn.
Referenties
- Benjamin, E.J., Muntner, P., Alonso, A., et al. Heart Disease and Stroke Statistics-2019 Update: A Report From the American Heart Association. Circulation, 2019, 139 (10), e56-528.
- Libby, P., Ridker, P.M., Hansson, G.K. Progress and challenges in translating the biology of atherosclerosis. Nature, 2011, 473, 317-325.
- Jernberg, T., Hasvold, P., Henriksson, M., et al. Cardiovascular risk in post-myocardial infarction patients: Nationwide real world data demonstrate the importance of a longterm perspective. Eur Heart J, 2015, 36 (19), 1163-1170a.
- Libby, P., Loscalzo, J., Ridker, P.M., Farkouh, M.E., Hsue, P.Y., Fuster, V., et al. Inflammation, Immunity, and Infection in Atherothrombosis: JACC Review Topic of the Week. J Am Coll Cardiol, 2018, 72 (17), 2071-2081.
- Seidman, M.A., Mitchell, R.N., Stone, J.R. Pathophysiology of Atherosclerosis. Cellular and Molecular Pathobiology of Cardiovascular Disease. Elsevier Inc., 2014, 221-237.
- Nguyen, M.T., Fernando, S., Schwarz, N., Tan, J.T., Bursill, C.A., Psaltis, P.J. Inflammation as a Therapeutic Target in Atherosclerosis. J Clin Med, 2019, 8 (8), 1109.
- Hansson, G.K. Mechanisms of disease: Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med, 2005, 352, 1685-1695.
- Lusis, A.J. Atherosclerosis. Nature, 2000, 407, 233-241.
- Ridker, P.M. From CANTOS to CIRT to COLCOT to Clinic: Will All Atherosclerosis Patients Soon Be Treated With Combination Lipid-Lowering and Inflammation-Inhibiting Agents? Circulation, 2020, 141 (10), 787-789.
- Luc, G., Bard, J.M., Juhan-Vague, I., et al. C-reactive protein, interleukin-6, and fibrinogen as predictors of coronary heart disease: The PRIME study. Arterioscler Thromb Vasc Biol, 2003, 23 (7), 1255-1261.
- Liuzzo, G., Biasucci, L.M., Gallimore, J.R., et al. The prognostic value of C-reactive protein and serum amyloid A protein in severe unstable angina. N Engl J Med, 1994, 331 (7), 417-424.
- Liu, D., Zeng, X., Li, X., Mehta, J.L., Wang, X. Role of NLRP3 inflammasome in the pathogenesis of cardiovascular diseases. Basic Res Cardiol, 2018, 113 (1), 1-14.
- Ridker, P.M., Howard, C.P., Walter, V., et al. Effects of interleukin-1β inhibition with canakinumab on hemoglobin A1c, lipids, C-reactive protein, interleukin-6, and fibrinogen a phase IIb randomized, placebocontrolled trial. Circulation, 2012, 126 (23), 2739-2748.
- Ridker, P.M., Everett, B.M., Thuren, T., et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med, 2017, 377 (12), 1119-1131.
- Aday, A.W., Ridker, P.M. Antiinflammatory Therapy in Clinical Care: The CANTOS Trial and Beyond. Front Cardiovasc Med, 2018, 5, 62.
- Ridker, P.M., MacFadyen, J.G., Everett, B.M., et al. Relationship of C-reactive protein reduction to cardiovascular event reduction following treatment with canakinumab: a secondary analysis from the CANTOS randomised controlled trial. Lancet, 2018, 391 (10118), 319-328.
- BCFI-CBIP. Canakinumab - BCFI. Geraadpleegd op 9 april 2020. Beschikbaar op: https://www.bcfi.be/nl/ chapters/13?frag=18804<view=pvt<vmp_ group=40071.
- Ridker, P.M., Everett, B.M., Pradhan, A., et al. Low-dose methotrexate for the prevention of atherosclerotic events. N Engl J Med, 2019, 380 (8), 752-762.
- Cutolo, M., Sulli, A., Pizzorni, C., Seriolo, B., Straub, R.H. Anti-inflammatory mechanisms of methotrexate in rheumatoid arthritis. Ann Rheum Dis, 2001, 60 (8), 729-735.
- Reiss, A.B., Carsons, S.E., Anwar, K., et al. Atheroprotective effects of methotrexate on reverse cholesterol transport proteins and foam cell transformation in human THP-1 monocyte/macrophages. Arthritis Rheum, 2008, 58 (12), 3675-3683.
- Choi, H.K., Hernán, M.A., Seeger, J.D., et al. Methotrexate and mortality in patients with rheumatoid arthritis: A prospective study. Lancet, 2002, 1173-1177.
- Westlake, S.L., Colebatch, A.N., Baird, J., et al. The effect of methotrexate on cardiovascular disease in patients with rheumatoid arthritis: a systematic literature review. Rheumatology, 2010, 49 (2), 295-307.
- Micha, R., Imamura, F., Wyler Von Ballmoos, M., et al. Systematic review and metaanalysis of methotrexate use and risk of cardiovascular disease. Am J Cardiol, 2011, 108 (9), 1362-1370.
- O'Donoghue, M.L., Braunwald, E., White, H.D., et al. Effect of darapladib on major coronary events after an acute coronary syndrome: The SOLID-TIMI 52 randomized clinical trial. JAMA, 2014, 312 (10), 1006-1015.
- Nicholls, S.J., Kastelein, J.J.P., Schwartz, G.G., et al. Varespladib and cardiovascular events in patients with an acute coronary syndrome: The VISTA-16 randomized clinical trial. JAMA, 2014, 311 (3), 252-262.
- O'Donoghue, M.L., Glaser, R., Cavender, M.A., et al. Effect of losmapimod on cardiovascular outcomes in patients hospitalized with acute myocardial infarction: A randomized clinical trial. JAMA, 2016, 315 (15), 1591-1599.
- Kosmas, C.E., Silverio, D., Sourlas, A., et al. Anti-inflammatory therapy for cardiovascular disease. Ann Transl Med, 2019, 7 (7), 147.
- Tardif, J.C., Kouz, S., Waters, D.D., et al. Efficacy and safety of low-dose colchicine after myocardial infarction. N Engl J Med, 2019, 381 (26), 2497-2505.
- Martínez, G.J., Robertson, S., Barraclough, J., et al. Colchicine Acutely Suppresses Local Cardiac Production of Inflammatory Cytokines in Patients With an Acute Coronary Syndrome. J Am Heart Assoc, 2015, 4 (8), e002128.
- Nidorf, S.M., Eikelboom, J.W., Budgeon, C.A., et al. Low-dose colchicine for secondary prevention of cardiovascular disease. J Am Coll Cardiol, 2013, 61 (4), 404-410.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.