Introduction
Les coronaropathies athéroscléreuses sont encore aujourd'hui une des principales causes de mortalité, de morbidité et de coûts de santé à travers le monde1. L'identification et le contrôle agressif des facteurs de risque traditionnels de l'athérosclérose, tels que l'hypertension, le diabète, le tabagisme et le cholestérol, ont permis de réduire fortement le nombre d'événements cardiovasculaires majeurs (MACE)2. En dépit du traitement actuel de ces facteurs de risque chez les patients atteints d'une coronaropathie avérée, le risque cardiovasculaire de ces patients reste élevé, avec une incidence des MACE pouvant atteindre 20 % au cours des trois années suivant la survenue d'un infarctus du myocarde3. Ce chiffre peut s'expliquer par le fait que l'athérosclérose possède une pathophysiologie plus complexe qu'une simple infiltration de cholestérol dans l'intima. Des études expérimentales et cliniques ont montré que l'inflammation joue un rôle important dans l'apparition et la progression de l'athérosclérose, ainsi que dans la survenue de complications thrombotiques4. Cet article explique le rôle de l'inflammation dans la pathophysiologie de l'athérosclérose et revient sur les données récentes d'études cliniques portant sur des traitements anti-inflammatoires, en particulier la colchicine, dans la prévention cardiovasculaire secondaire.
L'inflammation dans la pathophysiologie de l'athérosclérose
Aux premières phases de l'athérosclérose, l'exposition à des facteurs externes nocifs, tels que l'hypercholestérolémie, l'hypertension et les cytokines pro-inflammatoires, entraîne une rupture de la barrière formée par l'intima et une retenue du cholestérol LDL au niveau sous-intimal, à la suite d'interactions avec les protéoglycanes qui se trouvent dans la matrice extracellulaire5, 6 (figure 1).
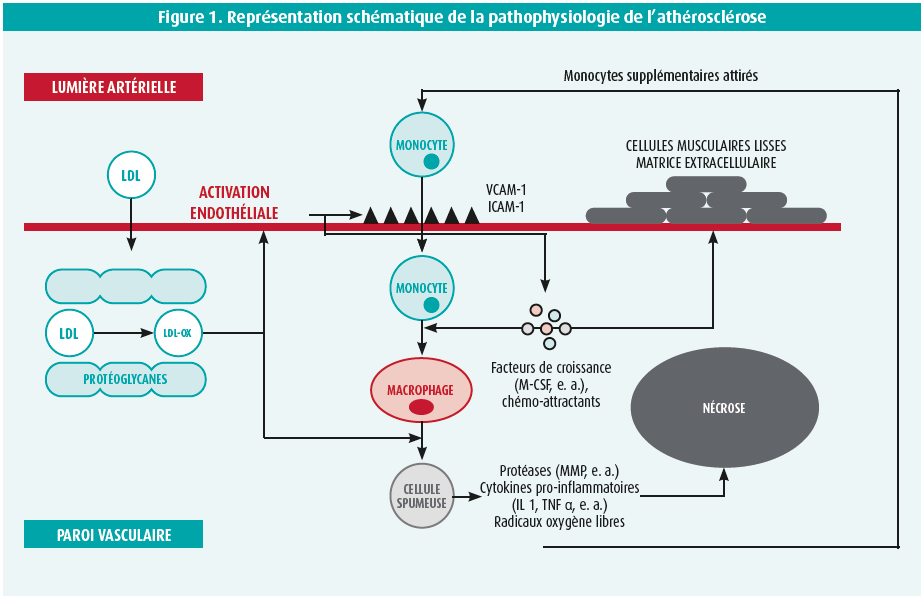
Cette interaction induit une oxydation des particules de cholestérol ainsi qu'une activation des cellules endothéliales, au cours de laquelle différentes molécules d'adhésion (VCAM-1 et ICAM-1, notamment), qui facilitent la liaison et l'absorption sous-endothéliale des cellules immunitaires (neutrophiles, monocytes et lymphocytes T), sont libérées5-7. En outre, les cellules endothéliales activées libèrent de grandes quantités de facteurs de croissance qui stimulent la prolifération des cellules musculaires lisses ainsi que de la matrice extracellulaire et qui attirent des monocytes et les stimulent à se transformer en macrophages, puis finalement en cellules spumeuses après absorption du cholestérol LDL oxydé6, 7. Les cellules spumeuses qui s'accumulent libèrent à leur tour des cytokines proinflammatoires, des protéases et des radicaux oxygène libres; elles attirent ainsi des monocytes supplémentaires et provoquent l'apoptose des cellules dans les couches plus profondes7, 8. Cette cascade se renforce sans cesse, de sorte qu'une plaque d'athérome, entourée d'une coque de tissu conjonctif (fibro-athérome) et dotée d'un noyau nécrotique, s'accumule7, 8. Les lymphocytes T infiltrent ce noyau nécrotique et, en conjonction avec les cellules spumeuses, libèrent des cytokines pro-inflammatoires, entraînant ainsi, notamment, l'activation de l'inflammasome NLRP-3 (figure 2). Cet inflammasome activé libère principalement les interleukines pro-inflammatoires IL-1β et IL-18, qui provoquent, plus loin dans la cascade, la production d'IL-6 et, finalement, la formation de protéines C-réactives (CRP) dans le foie7, 9. Le processus inflammatoire jusqu'alors local s'étend ainsi de plus en plus vers la circulation systémique. La cascade de signaux du NLRP-3 s'avère dès lors être une des principales cascades dans le processus de l'athérogenèse et se révèle importante en cas d'événements cardiovasculaires récidivants chez les patients atteints d'athérosclérose10-12.
Le traitement inflammatoire dans l'athérosclérose
Compte tenu du nombre croissant de données expérimentales et épidémiologiques sur le rôle de l'inflammation dans la pathophysiologie de l'athérosclérose, de plus en plus d'études ont été menées, ces dernières années, sur les traitements anti-inflammatoires dans la prévention cardiovasculaire. Tant de nouveaux traitements anti-inflammatoires spécifiques que la réutilisation d'anciens médicaments anti-inflammatoires ont été étudiés dans ce contexte.
Le canakinumab et l'étude CANTOS: proof of concept
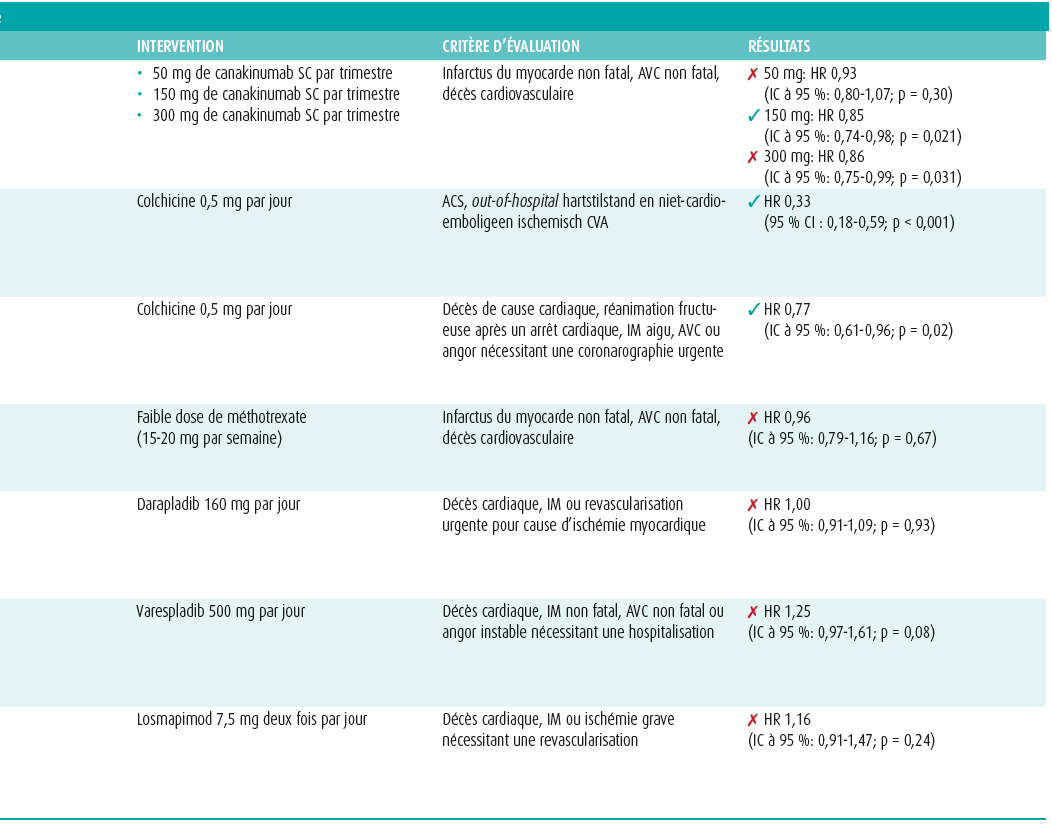
Le canakinumab est un anticorps monoclonal humain qui bloque l'action des IL-1β et réduit les taux plasmatiques d'IL-6 et de hsCRP en aval13. Ainsi que nous l'avons déjà signalé, ces cytokines pro-inflammatoires jouent un rôle central dans le processus d'athérogenèse (avec les autres cytokines de la cascade de signaux du NLRP-3) (figures 1 et 2)14. En 2017, l'étude 'Canakinumab Anti-Inflammatory Thrombosis Outcomes Study' (CANTOS) a examiné si le canakinumab pouvait de ce fait induire une réduction des maladies cardiovasculaires14. Lors de cette étude, 10 061 patients ayant subi un infarctus du myocarde et présentant un taux de CRP ultra sensible (hsCRP) ≥ 2 mg/l ont été randomisés dans quatre bras, selon un ratio de 1,5:1:1:1. Le premier groupe a reçu un placebo, tandis que les trois autres groupes ont reçu différentes doses de canakinumab (respectivement 50 mg, 150 mg et 300 mg tous les trois mois, par voie sous-cutanée). Le critère d'évaluation principal était composé d'un infarctus du myocarde (IM) non fatal, d'un accident vasculaire cérébral (AVC) et du décès cardiovasculaire. Après un suivi d'une durée moyenne de 3,7 ans, les doses les plus élevées (150 mg et 300 mg) se sont avérées donner lieu à une réduction de 15 % du risque en ce qui concerne le critère d'évaluation principal, mais seule la dose de 150 mg a atteint le niveau de significativité prédéfini (HR 0,85; IC à 95 %: 0,74-0,98; p = 0,021)14. La dose plus faible a entraîné une réduction non significative de 7 %14, 15. En outre, la réduction du risque s'est avérée la plus grande chez les patients présentant la plus forte réduction des taux d'IL-6- et de hsCRP16. Ces données contribuent à l'hypothèse selon laquelle l'inflammation résiduelle accroît le risque cardiovasculaire16. Par ailleurs, il convient de souligner que le statut lipidique était bien contrôlé chez tous les patients dans tous les groupes de l'étude (traitement par statine chez ± 91 % des patients présentant un taux de cholestérol LDL médian de 82 mg/dl). Ceci laisse supposer que l'effet observé se produit indépendamment du statut lipidique14. Cependant, l'effet cardiovasculaire favorable a été en partie perdu en raison d'une augmentation de l'incidence des infections fatales14. En outre, le canakinumab est une préparation coûteuse (une injection de 150 mg coûte 10 828 EUR)17. Ces éléments ont fait que la recherche s'est orientée vers des préparations moins coûteuses ayant un profil d'effets indésirables plus favorable. Toutefois, l'essai CANTOS a été considéré comme un 'proof of concept' pour l'importance d'un traitement anti-inflammatoire ciblé dans la prévention secondaire des risques cardiovasculaires.
Le méthotrexate et l'étude CIRT
Le méthotrexate (MTX) est une préparation peu coûteuse et accessible utilisée pour traiter diverses pathologies inflammatoires18. Il est actif comme antagoniste de l'acide folique, par inhibition de l'enzyme dihydrofolate réductase19. La manière précise dont il exerce son action anti-inflammatoire demeure toutefois peu claire jusqu'à présent, mais l'inhibition de la prolifération des lymphocytes T et l'accumulation d'adénosine (qui possède des propriétés anti-inflammatoires) y contribueraient19. En outre, le MTX favoriserait le transport du cholestérol vers le foie et induirait ainsi une réduction de la formation de cellules spumeuses au niveau des plaques athéroscléreuses20. Dans le passé, quelques études rétrospectives ont déjà montré que les patients atteints de troubles rhumatologiques et traités à l'aide d'une faible dose de MTX connaissaient moins d'événements cardiovasculaires que les patients recevant un placebo ou un autre traitement21-23. Cette hypothèse a dès lors été plus amplement explorée en 2018, avec la publication de l'étude 'Cardiovascular Inflammation Reduction Trial' (CIRT)18. Cette étude a inclus 4 786 patients présentant un antécédent d'infarctus du myocarde et/ou une maladie pluritronculaire connue, atteints en outre de diabète de type 2 ou d'un syndrome métabolique, qui ont été randomisés dans deux bras. Ils ont ainsi reçu soit un traitement par placebo, soit un traitement par faible dose de MTX (15-20 mg par semaine). Le critère d'évaluation principal était identique à celui de l'étude CANTOS. Après un suivi médian de 2,3 ans, aucune différence significative n'a toutefois été observée en ce qui concerne ce critère d'évaluation principal (HR 0,96; IC à 95 %: 0,79-1,16; P = 0,67)18.
À cet égard, il est important de noter que, contrairement au canakinumab, le MTX n'est pas apparu réduire les taux sériques d'IL1-β, IL-6 et hsCRP18. L'effet cardiovasculaire bénéfique potentiel du traitement anti-inflammatoire semblait donc dépendre de la cascade qui était bloquée18. Quelques autres études randomisées de grande envergure portant sur des préparations anti-inflammatoires l'ont également montré (tableau 1). Ainsi, l'étude SOLID-TIMI 52, menée en 2014, n'a pas mis en évidence de différence, en termes cardiovasculaires, entre les patients randomisés à un traitement par darapladib (un inhibiteur de la phospholipase) ou à un placebo après un syndrome coronaire aigu24. Des résultats similaires ont été observés lors de l'essai VISTA-16 portant sur un autre inhibiteur de la phospholipase, à savoir le varespladib25. En 2016, le traitement par losmapimod (un inhibiteur de la MAP-kinase p38) s'est avéré ne pas entraîner de réduction significative du risque cardiovasculaire26. Jusqu'à présent, d'autres molécules anti-inflammatoires n'ont pas montré d'effet significatif (inhibiteurs de la 5-LO, activine A)27. En outre, toutes ces préparations avaient en commun de ne pas entraîner de réduction des taux sériques d'IL-1β, IL-6 et hsCRP18. L'hypothèse a dès lors été avancée qu'il convenait de viser l'inhibition de la cascade de signaux du NLRP-3 afin d'obtenir une réduction du risque cardiovasculaire18.

Colchicine: l'étude LoDoCo et l'étude COLCOT
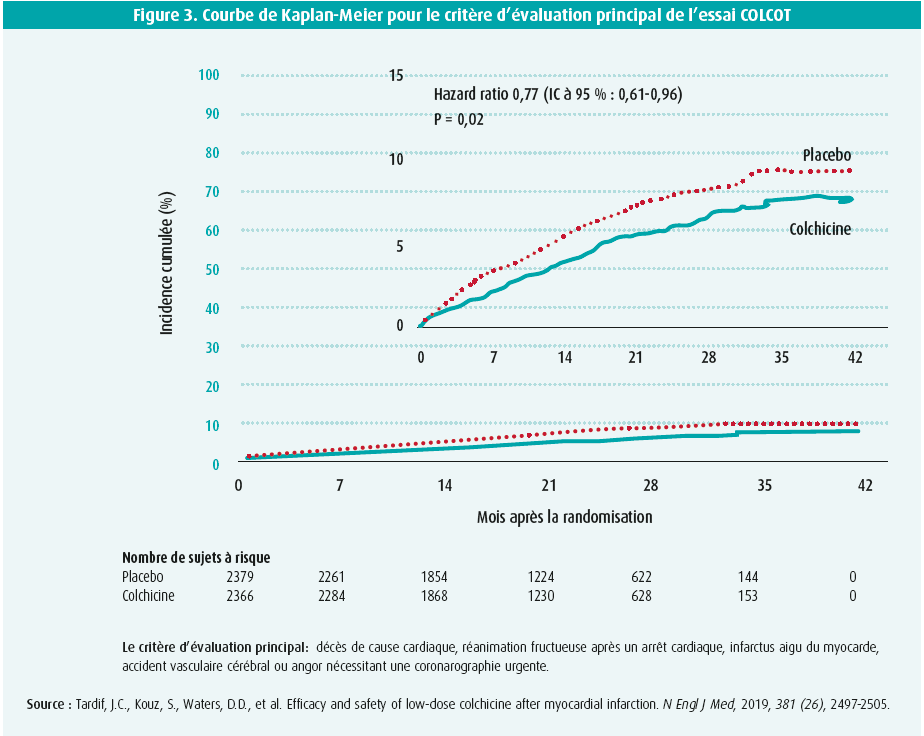
La recherche s'oriente donc vers un traitement anti-inflammatoire accessible, ayant principalement pour cible la cascade de signaux du NLRP-3 et un profil d'effets indésirables acceptable. La colchicine est une préparation anti-inflammatoire peu coûteuse, qui peut en outre être prise par voie orale28. Son action anti-inflammatoire est due, notamment, à l'inhibition de l'inflammasome NLRP-3, au cours de laquelle une diminution avérée des taux sériques d'IL-1β, IL-18, IL-6 et hsCRP se produit29. Lors de l'essai 'Low- Dose Colchicine for secondary prevention of cardiovascular disease' (étude LoDoCo), mené en 2013, 532 patients présentant une coronaropathie stable ont été randomisés à l'administration, ou pas, d'un traitement supplémentaire composé d'une faible dose de colchicine (0,5 mg/jour), en plus du traitement médicamenteux habituel30. Les patients recevant la colchicine ont présenté une réduction significative du critère d'évaluation principal (composé d'un syndrome coronaire aigu, d'un accident vasculaire cérébral et d'un arrêt cardiaque extra-hospitalier) (HR 0,33; IC à 95 %: 0,18-0,59; p < 0,001)30. Malgré les résultats spectaculaires, il convient de souligner que cette étude n'était pas contrôlée par placebo et que son envergure était relativement limitée. L'essai 'Colchicine Cardiovascular Outcomes Trial' (COLCOT), dont les résultats ont été publiés en 2019 dans le New England Journal of Medicine, a dès lors été mis sur pied afin de valider les résultats28. Cette étude a inclus 4 745 patients au cours des 30 jours suivant un infarctus du myocarde et les a randomisés à un traitement par une faible dose de colchicine (0,5 mg par jour) ou à un placebo28. Le critère d'évaluation principal était composé du décès de cause cardiaque, d'une réanimation fructueuse après un arrêt cardiaque, d'un infarctus aigu du myocarde, d'un accident vasculaire cérébral ou de symptômes d'angor nécessitant un cathétérisme urgent28. Après un suivi médian d'un peu moins de 2 ans, une réduction significative de 23 % du risque associé au critère d'évaluation principal a été observée (HR 0,77; IC à 95 %: 0,61-0,96; P = 0,02)28. Il est important de préciser que pratiquement tous les patients ont reçu un traitement standard adéquat par double anti-agrégation plaquettaire et une statine, et que ce traitement ne contribue donc pas aux résultats positifs28. Les effets indésirables les plus fréquemment rapportés étaient d'origine gastro-intestinale et consistaient principalement en une diarrhée (chez 9,7 % des sujets recevant la colchicine). Un peu plus d'infections ont également été rapportées (2,2 % contre 1,6 %), mais contrairement au canakinumab, la colchicine n'a pas été associée à une incidence accrue de sepsis et de choc septique28.
Avec la colchicine, il semble donc qu'une préparation peu coûteuse, sûre et aisément disponible, associée à une réduction avérée du risque cardiovasculaire, ait été (re)découverte. Plusieurs essais sont en cours afin de valider ces résultats, notamment l'essai LoDoCo2 (https://www.clinicaltrialsregister. eu/ctr-search/trial/2015- 005568-40/NL) et l'essai CLEAR-SYNERGY (https://clinicaltrials.gov/ct2/show/ NCT03048825). Si les résultats de ces essais sont également concordants, la colchicine pourra de plus en plus s'ériger comme stratégie supplémentaire afin de réduire le risque cardiovasculaire après un syndrome coronaire aigu9.
Conclusion
Des études expérimentales et épidémiologiques récentes ont montré que la cascade inflammatoire joue un rôle important dans la progression de l'athérosclérose ainsi que dans ses complications. Il est en outre apparu qu'un traitement anti-inflammatoire ciblé, plus particulièrement l'inhibition de la cascade de signaux du NLRP-3, entraîne une réduction efficace du risque cardiovasculaire. La colchicine, un ancien produit, peut, à cet égard, être une option peu coûteuse et sûre.
Références
- Benjamin, E.J., Muntner, P., Alonso, A., et al. Heart Disease and Stroke Statistics-2019 Update: A Report From the American Heart Association. Circulation, 2019, 139 (10), e56-528.
- Libby, P., Ridker, P.M., Hansson, G.K. Progress and challenges in translating the biology of atherosclerosis. Nature, 2011, 473, 317-325.
- Jernberg, T., Hasvold, P., Henriksson, M., et al. Cardiovascular risk in post-myocardial infarction patients: Nationwide real world data demonstrate the importance of a longterm perspective. Eur Heart J, 2015, 36 (19), 1163-1170a.
- Libby, P., Loscalzo, J., Ridker, P.M., Farkouh, M.E., Hsue, P.Y., Fuster, V., et al. Inflammation, Immunity, and Infection in Atherothrombosis: JACC Review Topic of the Week. J Am Coll Cardiol, 2018, 72 (17), 2071-2081.
- Seidman, M.A., Mitchell, R.N., Stone, J.R. Pathophysiology of Atherosclerosis. Cellular and Molecular Pathobiology of Cardiovascular Disease. Elsevier Inc., 2014, 221-237.
- Nguyen, M.T., Fernando, S., Schwarz, N., Tan, J.T., Bursill, C.A., Psaltis, P.J. Inflammation as a Therapeutic Target in Atherosclerosis. J Clin Med, 2019, 8 (8), 1109.
- Hansson, G.K. Mechanisms of disease: Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med, 2005, 352, 1685-1695.
- Lusis, A.J. Atherosclerosis. Nature, 2000, 407, 233-241.
- Ridker, P.M. From CANTOS to CIRT to COLCOT to Clinic: Will All Atherosclerosis Patients Soon Be Treated With Combination Lipid-Lowering and Inflammation-Inhibiting Agents? Circulation, 2020, 141 (10), 787-789.
- Luc, G., Bard, J.M., Juhan-Vague, I., et al. C-reactive protein, interleukin-6, and fibrinogen as predictors of coronary heart disease: The PRIME study. Arterioscler Thromb Vasc Biol, 2003, 23 (7), 1255-1261.
- Liuzzo, G., Biasucci, L.M., Gallimore, J.R., et al. The prognostic value of C-reactive protein and serum amyloid A protein in severe unstable angina. N Engl J Med, 1994, 331 (7), 417-424.
- Liu, D., Zeng, X., Li, X., Mehta, J.L., Wang, X. Role of NLRP3 inflammasome in the pathogenesis of cardiovascular diseases. Basic Res Cardiol, 2018, 113 (1), 1-14.
- Ridker, P.M., Howard, C.P., Walter, V., et al. Effects of interleukin-1β inhibition with canakinumab on hemoglobin A1c, lipids, C-reactive protein, interleukin-6, and fibrinogen a phase IIb randomized, placebocontrolled trial. Circulation, 2012, 126 (23), 2739-2748.
- Ridker, P.M., Everett, B.M., Thuren, T., et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med, 2017, 377 (12), 1119-1131.
- Aday, A.W., Ridker, P.M. Antiinflammatory Therapy in Clinical Care: The CANTOS Trial and Beyond. Front Cardiovasc Med, 2018, 5, 62.
- Ridker, P.M., MacFadyen, J.G., Everett, B.M., et al. Relationship of C-reactive protein reduction to cardiovascular event reduction following treatment with canakinumab: a secondary analysis from the CANTOS randomised controlled trial. Lancet, 2018, 391 (10118), 319-328.
- BCFI-CBIP. Canakinumab - BCFI. Consulté le 9 avril 2020. Disponible sur: https://www.bcfi.be/nl/ chapters/13?frag=18804<view=pvt<vmp_ group=40071.
- Ridker, P.M., Everett, B.M., Pradhan, A., et al. Low-dose methotrexate for the prevention of atherosclerotic events. N Engl J Med, 2019, 380 (8), 752-762.
- Cutolo, M., Sulli, A., Pizzorni, C., Seriolo, B., Straub, R.H. Anti-inflammatory mechanisms of methotrexate in rheumatoid arthritis. Ann Rheum Dis, 2001, 60 (8), 729-735.
- Reiss, A.B., Carsons, S.E., Anwar, K., et al. Atheroprotective effects of methotrexate on reverse cholesterol transport proteins and foam cell transformation in human THP-1 monocyte/macrophages. Arthritis Rheum, 2008, 58 (12), 3675-3683.
- Choi, H.K., Hernán, M.A., Seeger, J.D., et al. Methotrexate and mortality in patients with rheumatoid arthritis: A prospective study. Lancet, 2002, 1173-1177.
- Westlake, S.L., Colebatch, A.N., Baird, J., et al. The effect of methotrexate on cardiovascular disease in patients with rheumatoid arthritis: a systematic literature review. Rheumatology, 2010, 49 (2), 295-307.
- Micha, R., Imamura, F., Wyler Von Ballmoos, M., et al. Systematic review and metaanalysis of methotrexate use and risk of cardiovascular disease. Am J Cardiol, 2011, 108 (9), 1362-1370.
- O'Donoghue, M.L., Braunwald, E., White, H.D., et al. Effect of darapladib on major coronary events after an acute coronary syndrome: The SOLID-TIMI 52 randomized clinical trial. JAMA, 2014, 312 (10), 1006-1015.
- Nicholls, S.J., Kastelein, J.J.P., Schwartz, G.G., et al. Varespladib and cardiovascular events in patients with an acute coronary syndrome: The VISTA-16 randomized clinical trial. JAMA, 2014, 311 (3), 252-262.
- O'Donoghue, M.L., Glaser, R., Cavender, M.A., et al. Effect of losmapimod on cardiovascular outcomes in patients hospitalized with acute myocardial infarction: A randomized clinical trial. JAMA, 2016, 315 (15), 1591-1599.
- Kosmas, C.E., Silverio, D., Sourlas, A., et al. Anti-inflammatory therapy for cardiovascular disease. Ann Transl Med, 2019, 7 (7), 147.
- Tardif, J.C., Kouz, S., Waters, D.D., et al. Efficacy and safety of low-dose colchicine after myocardial infarction. N Engl J Med, 2019, 381 (26), 2497-2505.
- Martínez, G.J., Robertson, S., Barraclough, J., et al. Colchicine Acutely Suppresses Local Cardiac Production of Inflammatory Cytokines in Patients With an Acute Coronary Syndrome. J Am Heart Assoc, 2015, 4 (8), e002128.
- Nidorf, S.M., Eikelboom, J.W., Budgeon, C.A., et al. Low-dose colchicine for secondary prevention of cardiovascular disease. J Am Coll Cardiol, 2013, 61 (4), 404-410.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.