Inleiding
Hypertrofe cardiomyopathie (HCM) is een erfelijke aandoening met een verhoogd risico op plotse dood (SCD)1. Er zijn geen gerandomiseerde studies om de implantatie van een implantable cardioverter-defibrillator (ICD) in patiënten met HCM te leiden. Aanbevelingen zijn gebaseerd op observationele, retrospectieve cohort studies2.
Er werd een klinisch model ontwikkeld om het risico op SCD en de noodzaak voor een ICD in primaire preventie in te schatten. Dit model is gebaseerd op verschillende variabelen: leeftijd, familiale voorgeschiedenis van SCD, onverklaarde syncope, linker ventrikel outflowtract gradiënt, maximale linker ventrikel wanddikte, linker atriale diameter en non-sustained ventrikeltachycardie (NSVT)3. Dit werd gevalideerd, maar wordt aangevochten door sommigen met de suggestie dat sommige patiënten met een hoog risico worden onderbehandeld als deze risicoscore wordt toegepast4.
ICD-implantatie in primaire preventie blijft wat controversieel vanwege de angst dat jongere patiënten met HCM vatbaar zijn voor complicaties zoals onterechte schokken (inappropriate shocks, IAS), proceduregerelateerde complicaties, falen van de elektrode op lange termijn en het risico op infectie5-8.
De subcutane ICD (S-ICD) werd ontwikkeld om deze zaken te voorkomen. Verschillende cohorten of registers tonen aan dat de S-ICD efficiënt is bij hoogrisicopatiënten, evenwel met een risico op onterechte schokken9-12. Het nadeel van deze registers is dat er geen directe vergelijking tussen de S-ICD en de transveneuze ICD (TV-ICD) is.
In de huidige retrospectieve studie rapporteren we de resultaten van 35 patiënten met HCM die een S-ICD of TV-ICD kregen in twee Belgische ziekenhuizen. We vergelijken de veiligheid en doeltreffendheid van beide ICD types tijdens de implantatie en opvolging.
Methoden
35 patiënten met HCM die een ICD kregen tussen 1 januari 2013 en 30 juni 2017 in het Universitaire ziekenhuis te Gent en Kliniek Sint Jan in Brussel werden bestudeerd met goedkeuring door het Ethsich Comité van de Universiteit van Gent.
Implantatie van een ICD was initieel gebaseerd op de aanwezigheid van risicofactoren voor SCD en later op de huidige 'guidelines' voor de aanpak van HCM2. Voor deze analyse werd de HCM-SCD-calculator retrospectief gebruikt om het risico op SCD en de nood voor implantatie van een ICD in primaire preventie te berekenen. Het type ICD werd bepaald door de verwijzende of implanterende arts.
Bij S-ICD-patiënten werd de 'dual zone' geprogrammeerd met een conditionele zone (ondergrens tussen 180 en 230 bpm) en een shock-zone (ondergrens tussen 230 en 250 bpm). Bij TV-ICD's werd de detectiegrens voor ventrikelfibrillatie (VF) geprogrammeerd boven 207 bpm (tot 230 bpm) meestal met een detectiezone voor ventrikeltachycardie (VT) boven 170 of 180 bpm.
Statistische analyse
Variabelen werden vergeleken met gebruik van de non-parametrische statistiek indien van toepassing. Means ± standaard deviaties worden gebruikt in de tabellen en voor beschrijvende doeleinden in de tekst.
Resultaten
Patiëntkenmerken
Vanaf januari 2013 tot juni 2017 werd 35 patiënten geïncludeerd. De patiëntkenmerken worden getoond in tabel 1.
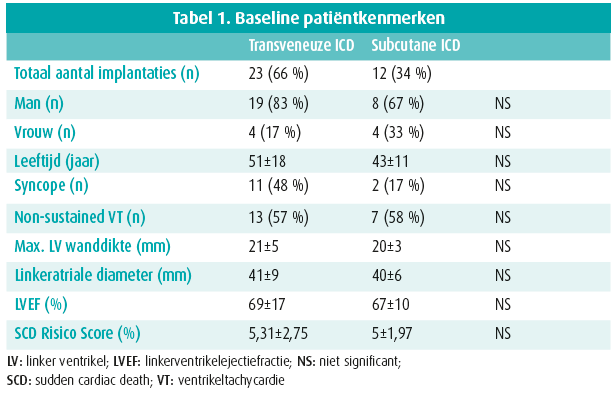
De gemiddelde leeftijd bij implantatie was 48±17 jaar. Er waren 27 mannelijke en 8 vrouwelijke patiënten. Dertien patiënten maakten een syncope door en twintig patiënten hadden een bewezen NSVT. Drie patiënten kregen een ICD in secundaire preventie.
De gemiddelde linkerventrikelejectiefractie (LVEF) bedroeg 68±15 %. De gemiddelde linkerventrikelwanddikte was 21±5mm en de gemiddelde linkeratriale diameter was 41±8 mm.
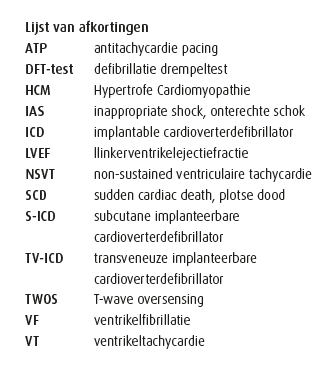
De gemiddelde 2014 ESC Risk Score voor patiënten met HCM en een ICD in primaire preventie was 5,23±2,6 %. In totaal hadden elf patiënten een hoog risicoscore (≥ 6 %) en twaalf patiënten een intermediaire risicoscore (≥ 4 % and < 6 %). De overige negen patiënten met een lage risicoscore hadden één belangrijke risicofactor en kregen een ICD voor de publicatie van de richtlijnen van 2014. De verdeling van S-ICD en TV-ICD over de drie groepen was vergelijkbaar met een relatief hoog aandeel van S-ICD-patiënten met een hoog risico (figuur 1).
Screening voor S-ICD
We includeerden alle patiënten met HCM die een ICD kregen sedert januari 2013. De S-ICD was echter pas beschikbaar in België vanaf november 2013.
Patiënten zonder indicatie voor pacing werden geïmplanteerd als ze slaagden voor de manuele ecg-screening voor S-ICD met ≥ 2 sensing vectoren. Vier patiënten kregen een TV-ICD wegens falen van de ecg-screening voor S-ICD.
Uiteindelijk kregen twaalf patiënten een S-ICD (34 %) en 23 patiënten (66 %) een TV-ICD.
Onder de twaalf patiënten met een S-ICD kregen er nog vier een eerstegeneratietoestel (Cameron Health SQ-RX 1010®), de rest een lateregeneratietoestel (EMBLEM®).
Initiële opvolging: implantatie, DFT-testing en programmatie
Er traden geen complicaties op bij de implantatie van de S-ICD. In de TV-ICD groep was er bij één patiënt noodzaak tot het herplaatsen van de ventriculaire elektrode wegens vroegtijdige dislocatie.
Alle S-ICD-patiënten, met uitzondering van twee, ondergingen een defibrillatiedrempeltest (DFT-test). Bij één patiënt gebeurde geen DFT-test wegens zwangerschap. Negen patiënten hadden een succesvolle DFT-test met 65 Joules en dit voor één of twee geïnduceerde episodes van VF. Bij één patiënt was er een succesvolle DFT-test met resp. 80 en 65 Joules met omgekeerde polariteit.
In de TV-ICD-groep gebeurde er bij vijf patiënten geen DFT-test. Bij de overige patiënten was er een succesvolle DFTtest. Wegens een hoge DFT-test van 41 Joules werd er bij één patiënt een dual coil shock-lead geplaatst met reductie van de DFT-test naar 21 Joules.
TV-ICD's werden geprogrammeerd volgens de MADIT-RIT-criteria13. Bij één patiënt werd enkel een VF-zone geprogrammeerd. Bij de S-ICD-groep werd bij zeven patiënten de primary sensing vector geprogrammeerd, de secondary en alternate sensing vector in resp. twee en drie patiënten.
Langetermijnopvolging: terechte en onterechte therapie
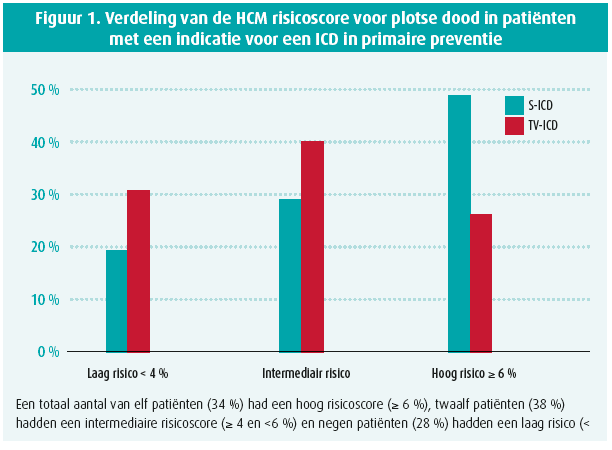
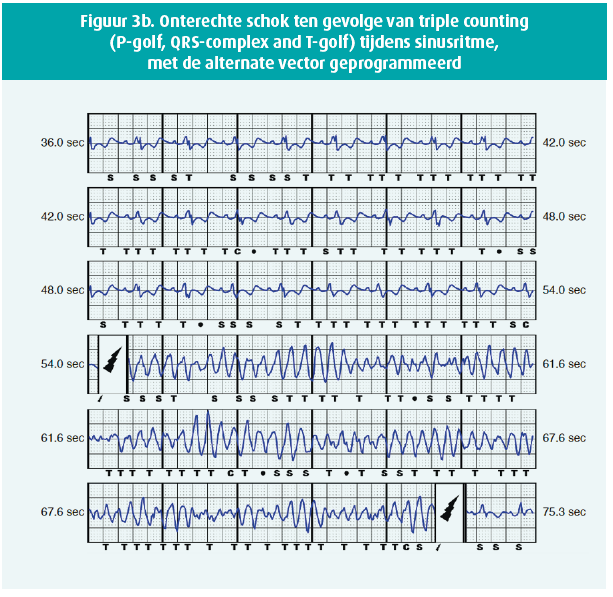
De gemiddelde opvolging was 819±468 dagen in de TV-ICD-groep en 444±356 dagen in de S-ICD-groep (p < 0,05). Twee patiënten met voorafgaand een out of hospital arrest, kregen een terechte schok met de S-ICD (figuur 2) voor resp. VF en een snelle VT degenererend naar VF. In de S-ICD-groep was er tevens één NSVT. Drie patiënten met een S-ICD van de eerste generatie (Cameron Health SQ-RX 1010®) kregen een onterechte schok (IAS) waarvan twee ten gevolge van T-wave oversensing (TWOS). De eerste patiënt was een 30-jarige dame die een onterechte schok in rust kreeg. Na herprogrammatie van de alternate naar primary sensing vector trad geen IAS meer op. De tweede patiënt, een 47-jarige man, kreeg een IAS tijdens inspanning ten gevolge van TWOS (figuur 3A). Na herprogammatie van de secondary naar de primary sensing vector trad geen TWOS meer op noch in rust, noch tijdens inspanningstest. De derde patiënt kreeg een IAS (figuur 3B) ten gevolge van triple counting van de P-golf, QRS-complex en T-golf tijdens sinusritme. Na herprogrammatie van de alternate naar de primary vector was er geen probleem van oversensing meer.
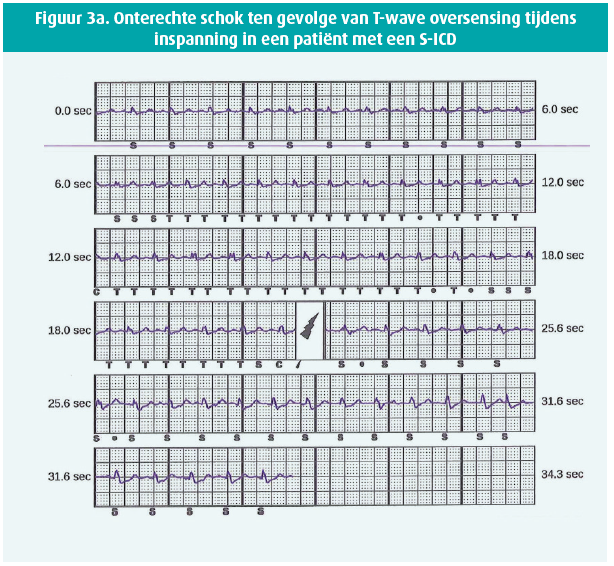
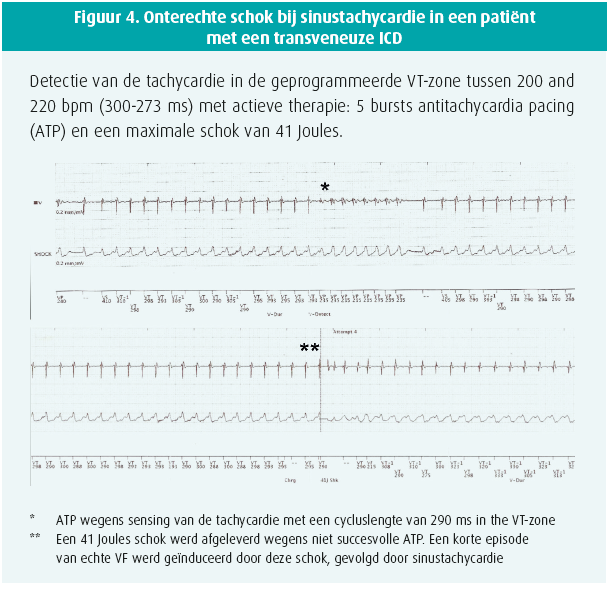
In de TV-ICD groep kreeg een 17-jarige jongeman een IAS ten gevolge van misclassificatie van sinustachycardie tijdens inspanning in de VT-zone wat leidde tot antitachycardiepacing (ATP) en een schok (figuur 4). Het toestel werd geprogrammeerd met enkel een VF-zone > 220bpm.
De ecg-screening voor S-ICD pre-implantatie faalde bij deze patiënt zodat een TV-ICD geplaatst werd.
Complicaties en mortaliteit
De complicaties in beide ICD-groepen worden weergegeven in tabel 2. Er trad geen infectie op in beide patiëntengroepen. Behoudens de eerder vermelde vroegtijdige herplaatsing van één ventriculaire shock-lead waren er twee leadbreuken van de rechterventriculaire shock-lead in de TV-ICD-groep. In beide gevallen gebeurde er een extractie van de defecte elektrode zonder complicatie en werd een nieuwe transveuze elektrode geplaatst.
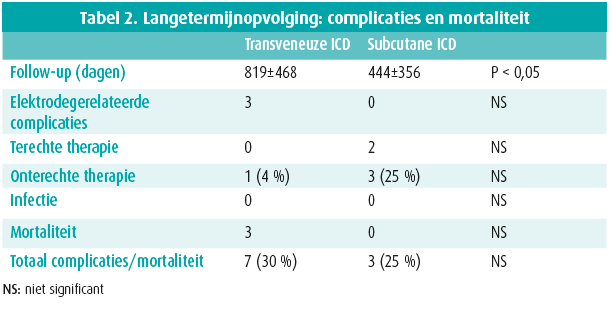
Drie patiënten met een TV-ICD overleden, twee ten gevolge van hartfalen en één van een niet-cardiale oorzaak.
Er was één cerebrovasculair accident (CVA) in de TV-ICD-groep, waarschijnlijk niet gerelateerd aan de ICD-behandeling.
Discussie
Deze studie vergelijkt de S-ICD met de TV-ICD bij patiënten met HCM.
Er bestaan slechts enkele studies die de waarde van de S-ICD in HCM bestuderen. Ze waren beperkt tot de implantatie of hadden een opvolging met korte duur9-12. In een recente prospectieve studie met 849 patiënten, de PRAETORIAN-studie, bleek de S-ICD niet inferieur ten opzichte van de TV-ICD. In deze studie kregen 22 patiënten met HCM een ICD waarvan 15 (3,5 %) een S-ICD en 7 (1,7 %) een TV-ICD14. In een meta-analyse werden meerdere meerdere patiënten met HCM geïncludeerd, maar hier werden geen specifieke resultaten gepresenteerd15.
De belangrijkste conclusie in al deze studies is dat de S-ICD even effectief is in de behandeling van levensbedreigende ritmestoornissen en tijdens DFT-testing, net zoals in onze studie. Verder waren er geen elektrodegerelateerde problemen in onze analyse. Onterechte therapie trad op in beide groepen.
Terechte therapie
Slechts twee patiënten kregen een terechte schok. Beiden hadden een S-ICD na een gedocumenteerde hartstilstand. De noodzaak voor terminatie met een schok bij de geregistreerde ritmestoornissen was duidelijk, ATP zou zinloos geweest zijn. Dit aantal interventies was te verwachten over een looptijd van twee jaar met een berekend gemiddeld risico van ongeveer 5 % per jaar in de groep met primaire preventie2. Een incidentie van terechte interventies in secundaire preventie van 6,8 % per jaar werd gerapporteerd, met een 4,8 % risico in een gemengde groep8, 16. Een recente multicentrische studie rapporteert eveneens slechts twee van de 88 patiënten met HCM en een S-ICD die een terechte schok kregen. Beiden werden geïmplanteerd in secundaire preventie17.
Onterechte therapie
Uit verschillende studies wordt een wisselend percentage van onterechte interventies bij patiënten met HCM en een TV-ICD weerhouden van 3,7 % tot 4,9 % per jaar8, 16. In een Zweeds register trad dit zelfs op in ongeveer 14,3 % over 5 jaar18.
Voor de S-ICD lijken de gegevens op het eerste zicht vergelijkbaar. In een prospectieve, single-center studie met achttien patiënten trad er 22 % IAS op ondanks correcte dual-zone programmatie10. Dit is in tegenstelling met de gegevens uit het EFFORTLESS-register waar IAS slechts in 12,5 % van de patiënten optrad met de meerderheid ten gevolge van TWOS. Er was een vermindering met 47 % door dual-zone programmatie9. Weinstock et al. rapporteert slechts in 1 op 15 patiënten een IAS na zorgvuldige ecg-screening pre-implantatie12. In een recente multicentrische studie bij patiënten met HCM en S-ICD werden er negen IAS gerapporteerd in vijf patiënten waarvan vijf op basis van TWOS, twee ten gevolge van atriale fibrillatie en drie op basis van sinustachcyardie. Dit komt neer op een incidentie van 3,8 % per jaar17.
In onze retrospectieve analyse waren er drie van de twaalf patiënten met een S-ICD die een IAS kregen: twee ten gevolge van TWOS, één ten gevolge van oversensing van de P- en T-golf. Alle drie de patiënten hadden een eerstegeneratie-S-IcD (zonder Smart Pass®).
Een hoge R:T-verhouding is noodzakelijk voor de correcte werking van de S-ICD. Ecg-screening voor implantatie vermindert het risico op IAS. Bij 7,4 % faalt deze ecg-screening. HCM, overgewicht, verlengde QRS-duur en een R:T-verhouding < 3 in de ecg-afleiding met de hoogste T-golf zijn onafhankelijk geassocieerd met falen van de screening19. In 165 patiënten met HCM werd een falen van ecg-screening van 16 % gerapporteerd. De voornaamste reden was een hoge T-golf, gevolgd door T-golfinversie in > 2 afleidingen op het 12 afleidingen-ecg en voorafgaande myectomie20. Recent werd een falen van ecg-screening van 38 % gerapporteerd bij patiënten met gevorderde ziekte21. De R:T-verhouding is wisselend en kan wijzigen tijdens de opvolging, voornamelijk tijdens tachycardie. Dit suggereert dat een inspanningstest bij de screening nuttig zou kunnen zijn. Bij ongeveer 10 % faalde de ecg-screening tijdens inspanning21. Andere groepen waren positiever en suggereren een rechter parasternale elektrodeplaatsing22.
Ondanks screening met inspanningstest ontwikkelde één van onze patiënten triple counting. Het probleem van TWOS kon in onze patiënten opgelost worden met herprogrammatie van de sensing vector.
Een nieuw discriminatiealgortime om TWOS te reduceren, Smart Pass®, werd beschikbaar in de S-ICD Emblem® generatie zonder effect te hebben op de discriminatie voor tachycardie. Validatie van het algoritme toonde dat IAS ten gevolge van TWOS kon vermeden worden met 39.8 ± 11.4 %23. Langetermijnopvolging is nodig om deze bevindingen te bevestigen in de popultatie met HCM. Een recente studie suggereert dat de leercurve een rol speelt en dat nieuwe algoritmes effectief zijn in de subgroep met HCM24.
Om onterechte schokken te vermijden bij patiënten met HCM is een goede ecg-screening pre-implantatie aangewezen, eventueel zelfs tijdens inspanning. Daarnaast adviseren we het aan-programmeren van Smart Pass®, programmatie van dual zone en navolgen van de huidige richtlijnen met hoge cut-off voor tachyprogrammatie.
Elektrodegerelateerde complicatie
In een meta-analyse van 2 190 patiënten met HCM en een TV-ICD trad er in 7 % een disfunctie en in 3 % een dislocatie van de elektrode op5. In een grotere, meer recente meta-analyse rapporteert met slechts 1,4 % disfunctie van de elektrode en 1,3 % dislocatie8. In het Zweeds register was de meerderheid van heringrijpen te wijten aan de elektrode (70 % van 150 procedures in 321 patiënten)18.
Dit komt overeen met onze bevindingen. In de S-ICD-groep trad er geen elektrodedisfunctie of -dislocatie op. Een recente update van de EFFORTLESS-studie met data van 106 patiënten met HCM toonde geen verschillen in complicatierisico ten opzichte van de andere patiënten zonder HCM25.
DFT-test
In deze studie kan een geïnduceerde VF steeds gerecoventeerd worden naar sinusritme met de S-ICD net zoals in 2 recente studies11,12. In een subanalyse van de SIMPLE-studie is er geen bijkomend voordeel aangetoond van een DFT-test bij de transveneuze ICD bij patiënten met HCM. Dergelijke gegevens zijn voorlopig nog niet beschikbaar voor de S-ICD26.
Beperkingen
Deze retrospectieve studie beschrijft een intermediaire opvolging van een beperkt aantal patiënten met HCM en een ICD. Enkele patiënten werden geëxcludeerd voor een S-ICD-implantatie op basis van rigoreuze ecg-screening voor implantatie (≥ 2 sensing vectoren). Een werkelijk vergelijking tussen de beide groepen kan niet gemaakt worden door het retrospectieve karakter van de studie.
Besluit
In deze kleine, retrospectieve, double-center studie is de haalbaarheid en veiligheid van de implantatie van een S-ICD bij patiënten met HCM vergelijkbaar met een TV-ICD.
Er is geen significant verschil in het aantal complicaties tijdens de korte- en langetermijnopvolging. De S-ICD bleek effectief tijdens de intra-operatieve DFT-test en in de behandeling van levensbedreigende ritmestoornissen tijdens opvolging. Er waren geen ICD- of elektrodegerelateerde complicaties in de S-ICD-groep. Er was enkel terechte therapie in de kleine groep met S-ICD in secundaire preventie.
Referenties
- Elliott PM, Gimeno JR, Thaman R, Shah J, Ward D, Dickie S, et al. Historical trends in reported survival rates in patients with hypertrophic cardiomyopathy. Heart, 2006, 92, 785791.
- Elliott PM, Anastasakis A, Borger MA, Borggrefe M, Cecchi F, Charron P, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy. Eur Heart J, 2014, 35, 27332779.
- O'Mahony C, Jichi F, Pavlou M, Monserrat L, Anastasakis A, Rapezzi C, et al. A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM RiskSCD). Eur Heart J, 2014, 35, 20102020.
- Maron MS, Rowin EJ, Wessler BS, Mooney PJ, Fatima A, Patel P, MD, et al. Enhanced American College of Cardiology/American Heart Association strategy for prevention of sudden cardiac death in highrisk patients with hypertrophic cardiomyopathy. JAMA Cardiol, 2019, 4, 644657.
- Schinkel AFL, Vriesendorp PA, Sijbrands EJG, Jordaens LJ, ten Cate FJ, Michels M. Outcome and complications after implantable cardioverter defibrillator therapy in hypertrophic cardiomyopathy: systematic review and metaanalysis. Circ Heart Fail, 2012, 5, 552559.
- Maron BJ. Risk stratification and role of implantable defibrillators for prevention of sudden death in patients with hypertrophic cardiomyopathy. Circ J, 2010, 74, 227182.
- O'Mahony C, Lambiase PD, Quarta G, Cardona M, Calcagnino M, Tsovolas K, et al. The longterm survival and the risks and benefits of implantable cardioverter defibrillators in patients with hypertrophic cardiomyopathy. Heart, 2011, 98, 11625.
- Wang N, Xie A, Tjahjono R, Tian DH, Phan S, Yan TD, et al. Implantable cardioverter defibrillator therapy in hypertrophic cardiomyopathy: an updated systematic review and metaanalysis of outcomes and complications. Ann Cardiothorac Surg, 2017, 6, 298306.
- Lambiase P, Gold M, Hood M, Boersma L, Theuns DA, Burke MC, et al. Evaluation of subcutaneous ICD early performance in hypertrophic cardiomyopathy from the pooled EFFORTLESS and IDE cohorts. Heart Rhythm, 2016, 13, 10661074.
- Frommeyer G, Dechering D, Zumhagen S, Löher A, Köbe J, Eckardt L, et al. Longterm followup of subcutaneous ICD systems in patients with hypertrophic cardiomyopathy: a singlecenter experience. Clin Res Cardiol, 2016, 105, 8993.
- Maurizi N, Tanini I, Olivotto I, Amendola E, Limongelli G, Losi MA, et al. Effectiveness of subcutaneous implantable cardioverterdefibrillator testing in patients with hypertrophic cardiomyopathy. Int J Cardiol, 2017, 231, 115-119.
- Weinstock J, Bader YH, Maron MS, Rowin EJ, Link MS. Subcutaneous Implantable Cardioverter Defibrillator in Patients with Hypertrophic Cardiomyopathy: An Initial Experience. J Am Heart Assoc, 2016, 5(2).
- Moss AJ, Schuger C, Beck CA, Brown MW, Cannom DS, Daubert JP, et al. Reduction in inappropriate therapy and mortality through ICD programming. N Engl J Med, 2012, 367, 22752283.
- Knops RE, Olde Nordkamp L, Delnoy PPHM, Boersma L, Kuschyk J, ElChami M, et al. A prospective, randomized Comparison of subcutaneous and transvenous Implantable Cardioverter Defibrillator Therapy (PRAETORIAN). N Engl J Med, 2010, 383, 526536.
- BasuRay I, Liu J, Jia X, Gold M, Ellenbogen K, Dinicolantanio J, et al. Subcutaneous versus tranvenous implantable defibrillator therapy. A metaanalysis of casecontrol studies. JACC: Clinical Electrophysiology, 2017, 3, 1475-1483.
- Vriesendorp PA, Schinkel AF, Van Cleemput J, Willems R, Jordaens LJ, Theuns DA, et al. Implantable cardioverterdefibrillators in hypertrophic cardiomyopathy: patient outcomes, rate of appropriate and inappropriate interventions, and complications. Am Heart J, 2013, 166, 496502.
- Nazer B, Dale Z, Carrasssa G, Reza N, Ustunkaya T, Papoutsidakis N, et al. Appropriate and inappropriate shocks in hypertrophic cardiomyopathy patients with subcutaneous implantable cardioverterdefibrillators: an international multicenter study. Heart Rhythm, 2020, 17, 11071114.
- Magnusson P, Gadler F, Liv P, Mörner S. Hypertrophic cardiomyopathy and implantable defibrillators in Sweden: inappropriate shocks and complications requiring surgery. J Cardiovasc Electrophysiol, 2015, 10, 1088-94.
- Olde Nordkamp L, Warnaars J, Kooiman K, de Groot JR, Rosenmöller BR, Wilde AA, et al. Which patients are not suitable for a subcutaneous ICD: incidence and predictors of failed QRSTwave morphology screening. J Cardiovasc Electrophysiol, 2014, 25, 494-499.
- Maurizi N, Olivotto I, Olde Nordkamp L, Baldini K, Fumagalli C, Brouwer TF, et al. Prevalence of subcutaneous implantable cardioverterdefibrillator candidacy based on template ECG screening in patients with hypertrophic cardiomyopathy. Heart Rhythm, 2016, 13, 457-463.
- Srinivasan NT, Patel KH, Qamar K, Taylor A, Bacà M, Providência R, et al. Disease severity and exercise testing reduce subcutaneous implantable cardioverterdefibrillator left sternal ECG screening success in hypertrophic cardiomyopathy. Circ Arrhythm Electrophysiol, 2017, 10, e004801. doi: 10.1161/CIRCEP. 117.004801.
- Francia P, Adduci C, Palano F, Semprini L, Serdoz A, Montesanti D, et al. Eligibility for the subcutaneous implantable cardioverterdefibrillator in patients with hypertrophic cardiomyopathy. J Cardiovasc Electrophysiol, 2015, 26, 893-899.
- Brisben AJ, Burke MC, Knight BP, Hahn SJ, Herrmann KL, Allavatam V, et al. A new algorithm to reduce inappropriate therapy in the SICD system. J Cardiovasc Electrophysiol, 2015, 26, 417-423.
- Rudic B, Tülümen E, Berlin V, Röger S, Stach K, Liebe V, et al. Low prevalence of inappropriate shocks in patients with inherited arrhythmia syndromes with the subcutaneous implantable defibrillator single center experience and long-term follow-up. J Am Heart Assoc, 2017, 6(10).
- Boersma L, Barr C, Knops R, Theuns D, Eckardt L, Neuzil P, et al. Implant and midterm outcomes of the subcutaneous implantable cardioverterdefibrillator registry: The EFFORTLESS Study. J Am Coll Cardiol, 2017, 70, 830-841.
- Vamos M, Healey JS, Wang J, Connolly SJ, Mabo P, Van Erven L, et al. Implantable cardioverter defibrillator therapy in hypertrophic cardiomyopathy: a SIMPLE substudy. Heart Rhythm, 2016, 13, 504-10.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.