Inleiding
La cardiomyopathie hypertrophique (CMH) est une maladie héréditaire qui comporte un risque accru de mort subite (MSC)1. Il n'existe aucune étude randomisée afin de guider la pose d'un défibrillateur cardioverteur automatique (DAI) chez les patients atteints de CMH. Les recommandations reposent sur des études de cohorte observationnelles rétrospectives2.
Un modèle clinique a été développé afin d'estimer le risque de MSC et la nécessité d'implanter un DAI en prévention primaire. Ce modèle est basé sur différentes variables: âge, antécédents familiaux de MSC, syncope inexpliquée, gradient intraventriculaire du ventricule gauche, épaisseur maximale de la paroi du ventricule gauche, diamètre de l'oreillette gauche et tachycardie ventriculaire non soutenue (NSVT)3. Bien que validé, il est contesté par certains, qui avancent que si ce score de risque est appliqué, des patients présentant un risque élevé sont sous-traités4.
L'implantation d'un DAI en prévention primaire demeure controversée en raison de la crainte que les patients plus jeunes atteints de CMH soient sujets à des complications telles que des chocs inappropriés (IAS), à des complications liées à la procédure, à une défaillance de l'électrode à long terme et à un risque d'infection5-8.
Le DAI sous-cutané (DAI-S) a été développé afin d'éviter de telles situations. Divers registres ou cohortes montrent que le DAI-S est efficace chez les patients à haut risque, mais présente un risque de chocs inappropriés9-12. L'inconvénient de ces registres est l'absence de comparaison directe entre le DAI-S et le DAI transveineux (DAI-TV).
Dans la présente étude rétrospective, nous rapportons les résultats de 35 patients atteints de CMH chez qui un DAI-S ou un DAI-TV a été implanté, dans deux hôpitaux belges. Nous comparons la sécurité et l'efficacité des deux types d'DAI pendant l'implantation et le suivi.
Méthodes
35 patients atteints de CMH chez lesquels un DAI a été implanté entre le 1er janvier 2013 et le 30 juin 2017, à l'Universitaire ziekenhuis, à Gand, ou à la Clinique Saint-Jean, à Bruxelles, ont été étudiés avec l'accord du Comité d'éthique de l'Université de Gand.
L'implantation d'un DAI reposait à l'origine sur la présence de facteurs de risque de MSC, puis sur les directives actuelles en matière de prise en charge de la CMH2.
Pour cette analyse, le calculateur HCM Risk-SCD a été utilisé de manière rétrospective afin de déterminer le risque de MSC et la nécessité d'implantation d'un DAI en prévention primaire. Le type de DAI a été déterminé par le médecin référent ou implantateur.
Chez les patients recevant un DAI-S, la « dual zone » a été programmée sous forme d'une zone conditionnelle (limite inférieure entre 180 et 230 bpm) et d'une zone de choc (limite inférieure entre 230 et 250 bpm). Chez les patients recevant un DAI-TV, la zone de détection de la fibrillation ventriculaire (FV) a été programmée au-dessus de 207 bpm (jusqu'à 230 bpm), généralement avec une zone de détection de la tachycardie ventriculaire (TV) supérieure à 170 ou 180 bpm.
Analyse statistique
Diverses variables ont été comparées à l'aide de la statistique non paramétrique, le cas échéant. Les moyennes ± écarts types sont utilisées dans les tableaux et à des fins descriptives dans le texte.
Résultats
Caractéristiques des patients
Trente-cinq patients ont été inclus de janvier 2013 à juin 2017. Les caractéristiques des patients sont présentées dans le tableau 1.
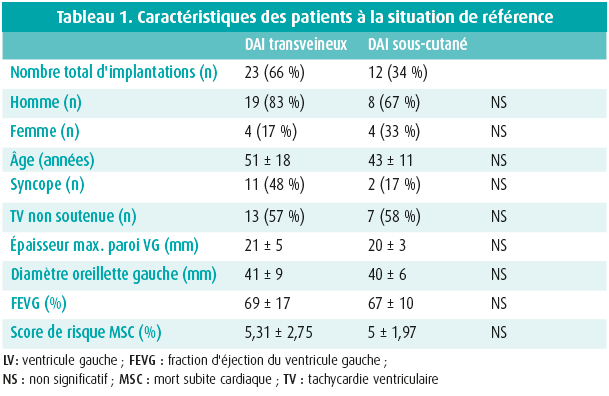
L'âge moyen à l'implantation était de 48 ± 17 ans. Vingt-sept hommes et huit femmes ont été inclus. Treize patients ont fait une syncope et 20 patients ont développé une NSVT avérée. Trois patients ont reçu un DAI en prévention secondaire.
La fraction d'éjection du ventricule gauche (FEVG) moyenne était de 68 ± 15 %. L'épaisseur moyenne de la paroi du ventricule gauche était de 21 ± 5 mm et le diamètre moyen de l'oreillette gauche était de 41 ± 8 mm.
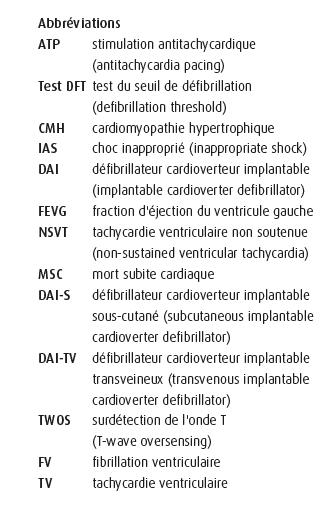
Le score de risque de l'ESC 2014 moyen pour les patients atteints de CMH et recevant un DAI en prévention primaire était de 5,23 ± 2,6 %. Au total, onze patients présentaient un score de risque élevé (≥ 6 %) et douze patients présentaient un score de risque intermédiaire (≥ 4 % et < 6 %). Les neuf autres patients dont le score de risque était faible présentaient un facteur de risque important et ont reçu un DAI avant la publication des directives de 2014. La distribution des DAI-S et des DAI-TV dans les trois groupes était comparable, avec une part relativement élevée de patients DAI-S présentant un risque élevé (figure 1).
Sélection en vue de l'implantation d'un DAI-S
Nous avons inclus tous les patients atteints de CMH chez qui un DAI a été implanté depuis janvier 2013. Toutefois, le DAI-S n'est disponible en Belgique que depuis novembre 2013.
Les patients sans indication pour la stimulation ont été implantés s'ils obtenaient un résultat satisfaisant à la sélection manuelle par ECG pour un DAI-S avec ≥ 2 vecteurs de détection. Quatre patients ont reçu un DAI-TV à la suite d'un échec à la sélection par ECG pour un DAI-S.
Finalement, douze patients ont reçu un DAI-S (34 %) et vingt-trois patients (66 %) ont reçu un DAI-TV.
Sur les douze patients chez qui un DAI-S a été implanté, quatre ont reçu un appareil de première génération (Cameron Health SQ-RX 1010®) et les autres ont reçu un appareil d'une génération plus récente (EMBLEM®).
Suivi initial: implantation, test DFT et programmation
Aucune complication n'est survenue lors de l'implantation des DAI-S. Dans le groupe DAI-TV, le repositionnement de l'électrode ventriculaire a été nécessaire chez un patient en raison d'un déplacement précoce.
Tous les patients DAI-S, sauf deux, ont subi un test du seuil de défibrillation (test DFT). Le test DFT n'a pas été réalisé chez une patiente, car celle-ci était enceinte. Neuf patients ont subi avec succès le test DFT à 65 joules, pour un ou deux épisodes induits de FV. Un patient a subi avec succès le test DFT à 80 et 65 joules avec polarité inversée.
Dans le groupe DAI-TV, le test DFT n'a pas été réalisé chez cinq patients. Le test DFT a été réalisé avec succès chez les autres patients. En raison d'un test DFT élevé de 41 joules, une sonde double coil a été posée chez un patient, avec réduction du test DFT à 21 joules.
Les DAI-TV ont été programmés selon les critères MADIT-RIT13. Chez un patient, seule une zone de FV a été programmée. Dans le groupe DAI-S, le vecteur de détection primaire a été programmé chez sept patients, le vecteur de détection secondaire chez deux patients et le vecteur de détection alternatif chez trois patients.
Suivi à long terme: choc approprié et inapproprié
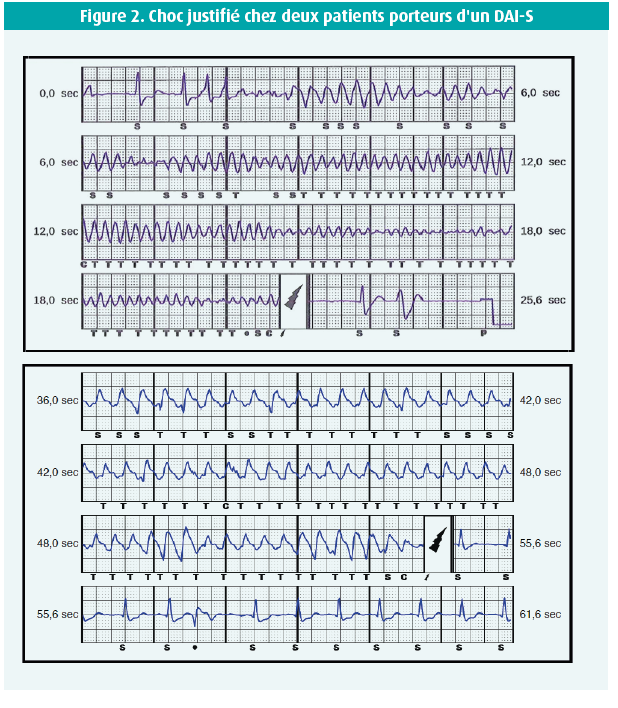
Le suivi moyen était de 819 ± 468 jours dans le groupe DAI-TV et de 444 ± 356 jours dans le groupe DAI-S (p < 0,05). Deux patients ayant été victimes précédemment d'un arrêt cardiaque extrahospitalier ont reçu un choc approprié administré par le DAI-S (figure 2), respectivement pour une FV et une TV dégénérant rapidement en FV. Un patient a également été victime d'une NSTV dans le groupe DAI-S.
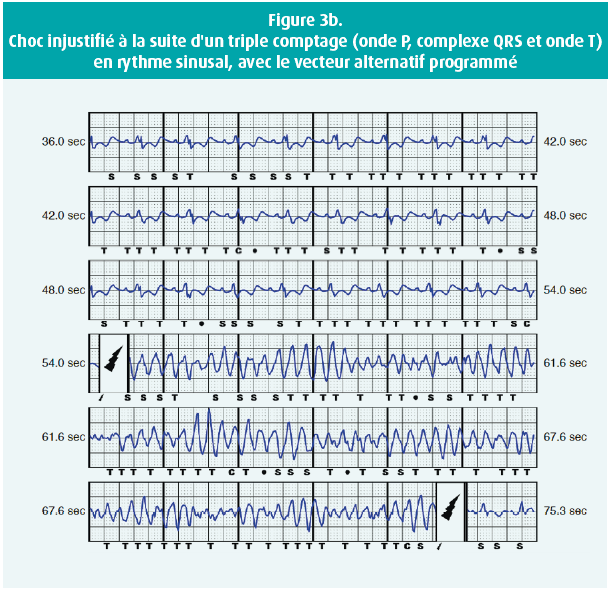
Trois patients porteurs d'un DAI-S de première génération (Cameron Health SQ-RX 1010®) ont reçu un choc inapproprié (IAS), dont deux à la suite d'une surdétection de l'onde T (TWOS). Le premier patient était une femme de 30 ans qui a reçu un choc inapproprié au repos. Après reprogrammation du vecteur de détection alternatif en primaire, plus aucun IAS ne s'est produit. Le deuxième patient, un homme de 47 ans, a reçu un IAS pendant un effort, à la suite d'une TWOS (figure 3A). Après reprogrammation du vecteur de détection secondaire en primaire, plus aucune TWOS ne s'est produite, ni au repos, ni pendant l'épreuve d'effort. Le troisième patient a reçu un IAS (figure 3B) à la suite d'un triple comptage de l'onde P, du complexe QRS et de l'onde T en rythme sinusal. Après reprogrammation du vecteur de détection alternatif en primaire, plus aucun problème de surdétection n'est survenu.

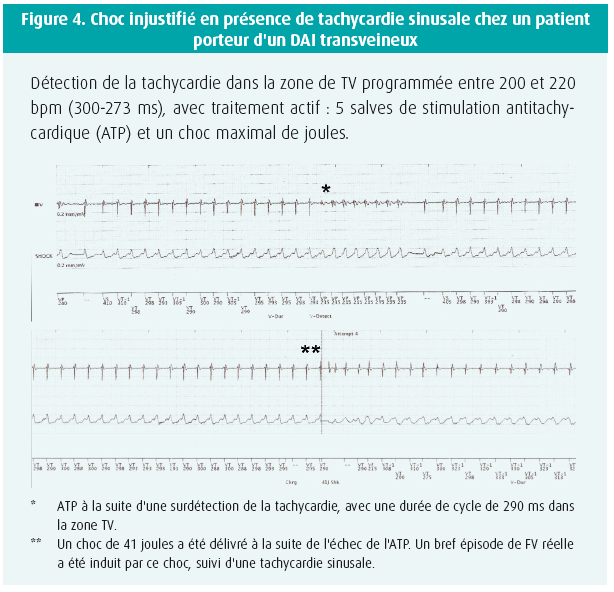
Dans le groupe DAI-TV, un jeune homme de 17 ans a reçu un IAS à la suite d'une erreur de classification d'une tachycardie sinusale pendant l'effort dans la zone de TV, ce qui a induit une stimulation antitachycardique (ATP) et un choc (figure 4). L'appareil a été programmé uniquement avec une zone de FV > 220 bpm. La sélection par ECG avant l'implantation du DAI-S échouait chez ce patient, donc un DAI-TV a été implanté.
Complications et mortalité
Les complications survenues dans les deux groupes sont présentées dans le tableau 2. Acune infection n'est survenue dans aucun des deux groupes de patients. Hormis le repositionnement précoce déjà mentionné d'une électrode de défibrillation ventriculaire, deux électrodes de défibrillation ventriculaire droites se sont brisées dans le groupe DAI-TV. Dans les deux cas, l'électrode défectueuse a été extraite sans complications et une nouvelle électrode transveineuse a été posée.
Trois patients porteurs d'un DAI-TV sont décédés: deux à la suite d'une insuffisance cardiaque et un de cause non cardiaque.
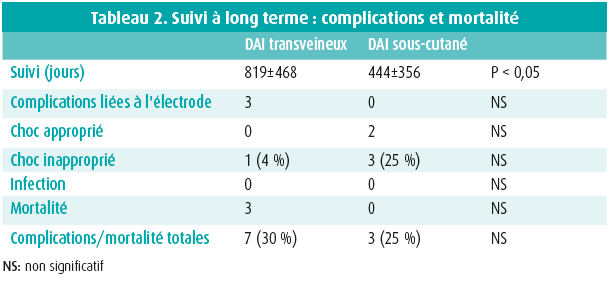
Un patient a été victime d'un accident vasculaire cérébral (AVC) dans le groupe DAI-TV, probablement sans lien avec le traitement par DAI.
Commentaire
Cette étude compare le DAI-S et le DAI-TV chez des patients atteints de CMH.
Seules quelques études se sont intéressées à la valeur du DAI-S dans la CMH. Celles-ci se limitaient à l'implantation ou possédaient un suivi de courte durée9-12. Dans une étude prospective récente incluant 849 patients, l'étude PRAETORIAN, le DAI-S s'est avéré non inférieur au DAI-TV. Lors de cette étude, un DAI a été implanté chez 22 patients atteints de CMH: 15 (3,5 %) ont reçu un DAI-S et 7 (1,7 %) ont reçu un DAI-TV14. Plusieurs patients atteints de CMH ont été inclus dans une méta-analyse, mais aucun résultat spécifique n'a été présenté15.
La principale conclusion de toutes ces études est que le DAI-S est aussi efficace dans le traitement des troubles du rythme engageant le pronostic vital du patient et pendant le test DFT, comme dans notre étude. En outre, il n'y avait aucun problème lié aux électrodes dans notre analyse. Des chocs inappropriés ont été délivrés dans les deux groupes.
Choc approprié
Seuls deux patients ont reçu un choc approprié. Tous deux avaient reçu un DAI-S après un arrêt cardiaque documenté. La nécessité de mettre fin au moyen d'un choc aux troubles du rythme enregistrés était claire, l'ATP aurait été inutile. Ce nombre d'interventions était attendu sur une durée de deux ans, avec un risque moyen calculé de 5 % environ par an dans le groupe en prévention primaire2. Une incidence annuelle de 6,8 % d'interventions appropriées en prévention secondaire a été rapportée, avec un risque de 4,8 % dans un groupe mixte8, 16. Une étude multicentrique récente ne fait également état que de deux patients sur 88 atteints de CMH et porteurs d'un DAI-S ayant reçu un choc approprié, tous deux implantés en prévention secondaire17.
Choc inapproprié
Chez les patients atteints de CMH et porteurs d'un DAI-TV, un pourcentage variable d'interventions inappropriées de 3,7 % à 4,9 % par an, a été retenu de diverses études8, 16. Dans un registre suédois, ce chiffre est même d'environ 14,3 % sur une durée de cinq ans18.
Pour le DAI-S, les données semblent à première vue comparables. Dans une étude prospective monocentrique, incluant dixhuit patients, 22 % d'IAS se sont produits, malgré une programmation correcte des deux zones de fréquences cardiaques10. Ce chiffre est en contradiction avec les données du registre EFFORTLESS, selon lequel un IAS n'est survenu que chez 12,5 % des patients, dans la majorité des cas à la suite d'une TWOS. Une réduction de 47 % a été obtenue après programmation des deux zones de fréquences cardiaques9. Weinstock et al. ne font état d'un IAS que chez un patient sur quinze après une sélection soigneuse par ECG avant implantation12. Lors d'une étude multicentrique récente menée auprès de patients atteints de CMH et porteurs d'un DAI-S, neuf IAS ont été rapportés chez cinq patients, parmi lesquels cinq à la suite d'une TWOS, deux à la suite d'une fibrillation auriculaire et trois à la suite d'une tachycardie sinusale. Ces chiffres reviennent à une incidence de 3,8 % par an17.
Dans notre analyse rétrospective, trois des douze patients porteurs d'un DAI-S ont reçu un IAS: deux à la suite d'une TWOS et un à la suite d'une surdétection de l'onde P et de l'onde T. Ces trois patients étaient porteurs d'un DAI-S de première génération (sans Smart Pass®).
Un ratio R/T élevé est nécessaire au fonctionnement correct du DAI-S. La sélection par ECG avant l'implantation réduit le risque d'IAS. Cette sélection par ECG échoue chez 7,4 %. Une CMH, un surpoids, un allongement du QRS et un ratio R/T < 3 à la dérivation de l'ECG où l'onde T est la plus élevée sont associés de manière indépendante à l'échec de la sélection19. Un échec de la sélection par ECG de 16 % a été rapporté dans un groupe de 165 patients atteints de CMH. Les principales raisons de cet échec étaient une onde T élevée, suivie par une inversion de l'onde T dans plus de 2 dérivations à l'ECG à 12 dérivations et une myectomie préalable20. Récemment, un échec de la sélection par ECG de 38 % a été rapporté chez des patients atteints de la maladie à un stade avancé21. Le ratio R/T est variable et peut évoluer pendant le suivi, principalement pendant la tachycardie, ce qui suggère qu'une épreuve d'effort lors de la sélection pourrait être utile. Chez environ 10 %, la sélection par ECG a échoué pendant l'effort21. D'autres groupes étaient plus positifs et suggèrent un positionnement parasternal droit de l'électrode22.
Malgré la sélection avec épreuve d'effort, un de nos patients a développé un triple comptage. Chez nos patients, le problème de la TWOS a pu être résolu grâce à une reprogrammation du vecteur de détection.
Un nouvel algorithme de discrimination afin de réduire la TWOS, Smart Pass®, est désormais disponible dans la génération Emblem® de DAI-S, sans incidence sur la discrimination pour la tachycardie. La validation de l'algorithme a montré que l'IAS à la suite d'une TWOS pouvait être évité à 39,8 ± 11,4 %23. Un suivi à long terme est nécessaire afin de confirmer ces observations dans la population atteinte de CMH. Une étude récente permet de supposer que la courbe d'apprentissage joue un rôle et que de nouveaux algorithmes sont efficaces dans le sous-groupe atteint de CMH24.
Afin d'éviter les chocs injustifiés chez les patients atteints de CMH, une sélection par ECG correcte avant l'implantation est indiquée, éventuellement pendant l'effort. En outre, nous conseillons l'activation de Smart Pass®, la programmation des deux zones de fréquences cardiaques et le suivi des directives actuelles comportant une limite élevée pour la programmation des valeurs de la tachycardie.
Complications liées à l'électrode
Dans une méta-analyse de 2 190 patients atteints de CMH et porteurs d'un DAI-TV, une dysfonction est survenue chez 7 % et un déplacement de l'électrode chez 3 %5. Dans une grande méta-analyse plus récente, seuls 1,4 % de dysfonctions de l'électrode et 1,3 % de déplacements sont rapportés8. Dans le registre suédois, la majorité des réinterventions était due à l'électrode (70 % des 150 procédures chez 321 patients)18.
Ces chiffres correspondent à nos observations. Dans le groupe DAI-S, aucune dysfonction ni aucun déplacement de l'électrode ne se sont produits. Une mise à jour récente de l'étude EFFORTLESS, incluant les données de 106 patients atteints de CMH, n'a mis en évidence aucun risque de complication par rapport aux autres patients sans CMH25.
Test DFT
Dans cette étude, une FV induite a toujours pu être reconvertie en rythme sinusal avec le DAI-S, comme dans deux études récentes11, 12. Dans une sous-analyse de l'étude SIMPLE, aucun avantage supplémentaire d'un test DFT en cas d'DAI transveineux chez des patients atteints de CMH n'a été démontré. De telles données ne sont pas encore disponibles pour le DAI-S26.
Limitations
Cette étude rétrospective décrit un suivi intermédiaire d'un nombre limité de patients atteints de CMH et porteurs d'un DAI. Quelques patients ont été exclus en vue de l'implantation d'un DAI-S, sur la base d'une sélection rigoureuse par ECG avant l'implantation (≥ 2 vecteurs de détection). Une comparaison réelle entre les deux groupes ne peut être faite en raison de la nature rétrospective de l'étude.
Conclusion
Dans cette petite étude rétrospective, menée dans deux centres, la faisabilité et la sécurité de l'implantation d'un DAI-S chez les patients atteints de CMH sont comparables avec celles de l'implantation d'un DAI-TV.
Il n'existe pas de différences significatives en ce qui concerne le nombre de complications à court et long termes pendant le suivi. Le DAI-S s'est avéré efficace pendant le test DFT intra-opératoire et pendant le traitement des troubles du rythme engageant le pronostic vital pendant le suivi. Il n'y a pas eu de complications liées à le DAI ou à l'électrode dans le groupe DAI-S. Un choc justifié a été administré uniquement dans le petit groupe porteur d'un DAI-S en prévention secondaire.
Références
- Elliott PM, Gimeno JR, Thaman R, Shah J, Ward D, Dickie S, et al. Historical trends in reported survival rates in patients with hypertrophic cardiomyopathy. Heart, 2006, 92, 785791.
- Elliott PM, Anastasakis A, Borger MA, Borggrefe M, Cecchi F, Charron P, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy. Eur Heart J, 2014, 35, 27332779.
- O'Mahony C, Jichi F, Pavlou M, Monserrat L, Anastasakis A, Rapezzi C, et al. A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM RiskSCD). Eur Heart J, 2014, 35, 20102020.
- Maron MS, Rowin EJ, Wessler BS, Mooney PJ, Fatima A, Patel P, MD, et al. Enhanced American College of Cardiology/American Heart Association strategy for prevention of sudden cardiac death in highrisk patients with hypertrophic cardiomyopathy. JAMA Cardiol, 2019, 4, 644657.
- Schinkel AFL, Vriesendorp PA, Sijbrands EJG, Jordaens LJ, ten Cate FJ, Michels M. Outcome and complications after implantable cardioverter defibrillator therapy in hypertrophic cardiomyopathy: systematic review and metaanalysis. Circ Heart Fail, 2012, 5, 552559.
- Maron BJ. Risk stratification and role of implantable defibrillators for prevention of sudden death in patients with hypertrophic cardiomyopathy. Circ J, 2010, 74, 227182.
- O'Mahony C, Lambiase PD, Quarta G, Cardona M, Calcagnino M, Tsovolas K, et al. The longterm survival and the risks and benefits of implantable cardioverter defibrillators in patients with hypertrophic cardiomyopathy. Heart, 2011, 98, 11625.
- Wang N, Xie A, Tjahjono R, Tian DH, Phan S, Yan TD, et al. Implantable cardioverter defibrillator therapy in hypertrophic cardiomyopathy: an updated systematic review and metaanalysis of outcomes and complications. Ann Cardiothorac Surg, 2017, 6, 298306.
- Lambiase P, Gold M, Hood M, Boersma L, Theuns DA, Burke MC, et al. Evaluation of subcutaneous ICD early performance in hypertrophic cardiomyopathy from the pooled EFFORTLESS and IDE cohorts. Heart Rhythm, 2016, 13, 10661074.
- Frommeyer G, Dechering D, Zumhagen S, Löher A, Köbe J, Eckardt L, et al. Longterm followup of subcutaneous ICD systems in patients with hypertrophic cardiomyopathy: a singlecenter experience. Clin Res Cardiol, 2016, 105, 8993.
- Maurizi N, Tanini I, Olivotto I, Amendola E, Limongelli G, Losi MA, et al. Effectiveness of subcutaneous implantable cardioverterdefibrillator testing in patients with hypertrophic cardiomyopathy. Int J Cardiol, 2017, 231, 115-119.
- Weinstock J, Bader YH, Maron MS, Rowin EJ, Link MS. Subcutaneous Implantable Cardioverter Defibrillator in Patients with Hypertrophic Cardiomyopathy: An Initial Experience. J Am Heart Assoc, 2016, 5(2).
- Moss AJ, Schuger C, Beck CA, Brown MW, Cannom DS, Daubert JP, et al. Reduction in inappropriate therapy and mortality through ICD programming. N Engl J Med, 2012, 367, 22752283.
- Knops RE, Olde Nordkamp L, Delnoy PPHM, Boersma L, Kuschyk J, ElChami M, et al. A prospective, randomized Comparison of subcutaneous and transvenous Implantable Cardioverter Defibrillator Therapy (PRAETORIAN). N Engl J Med, 2010, 383, 526536.
- BasuRay I, Liu J, Jia X, Gold M, Ellenbogen K, Dinicolantanio J, et al. Subcutaneous versus tranvenous implantable defibrillator therapy. A metaanalysis of casecontrol studies. JACC: Clinical Electrophysiology, 2017, 3, 1475-1483.
- Vriesendorp PA, Schinkel AF, Van Cleemput J, Willems R, Jordaens LJ, Theuns DA, et al. Implantable cardioverterdefibrillators in hypertrophic cardiomyopathy: patient outcomes, rate of appropriate and inappropriate interventions, and complications. Am Heart J, 2013, 166, 496502.
- Nazer B, Dale Z, Carrasssa G, Reza N, Ustunkaya T, Papoutsidakis N, et al. Appropriate and inappropriate shocks in hypertrophic cardiomyopathy patients with subcutaneous implantable cardioverterdefibrillators: an international multicenter study. Heart Rhythm, 2020, 17, 11071114.
- Magnusson P, Gadler F, Liv P, Mörner S. Hypertrophic cardiomyopathy and implantable defibrillators in Sweden: inappropriate shocks and complications requiring surgery. J Cardiovasc Electrophysiol, 2015, 10, 1088-94.
- Olde Nordkamp L, Warnaars J, Kooiman K, de Groot JR, Rosenmöller BR, Wilde AA, et al. Which patients are not suitable for a subcutaneous ICD: incidence and predictors of failed QRSTwave morphology screening. J Cardiovasc Electrophysiol, 2014, 25, 494-499.
- Maurizi N, Olivotto I, Olde Nordkamp L, Baldini K, Fumagalli C, Brouwer TF, et al. Prevalence of subcutaneous implantable cardioverterdefibrillator candidacy based on template ECG screening in patients with hypertrophic cardiomyopathy. Heart Rhythm, 2016, 13, 457-463.
- Srinivasan NT, Patel KH, Qamar K, Taylor A, Bacà M, Providência R, et al. Disease severity and exercise testing reduce subcutaneous implantable cardioverterdefibrillator left sternal ECG screening success in hypertrophic cardiomyopathy. Circ Arrhythm Electrophysiol, 2017, 10, e004801. doi: 10.1161/CIRCEP. 117.004801.
- Francia P, Adduci C, Palano F, Semprini L, Serdoz A, Montesanti D, et al. Eligibility for the subcutaneous implantable cardioverterdefibrillator in patients with hypertrophic cardiomyopathy. J Cardiovasc Electrophysiol, 2015, 26, 893-899.
- Brisben AJ, Burke MC, Knight BP, Hahn SJ, Herrmann KL, Allavatam V, et al. A new algorithm to reduce inappropriate therapy in the SICD system. J Cardiovasc Electrophysiol, 2015, 26, 417-423.
- Rudic B, Tülümen E, Berlin V, Röger S, Stach K, Liebe V, et al. Low prevalence of inappropriate shocks in patients with inherited arrhythmia syndromes with the subcutaneous implantable defibrillator single center experience and long-term follow-up. J Am Heart Assoc, 2017, 6(10).
- Boersma L, Barr C, Knops R, Theuns D, Eckardt L, Neuzil P, et al. Implant and midterm outcomes of the subcutaneous implantable cardioverterdefibrillator registry: The EFFORTLESS Study. J Am Coll Cardiol, 2017, 70, 830-841.
- Vamos M, Healey JS, Wang J, Connolly SJ, Mabo P, Van Erven L, et al. Implantable cardioverter defibrillator therapy in hypertrophic cardiomyopathy: a SIMPLE substudy. Heart Rhythm, 2016, 13, 504-10.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.