Inleiding
Een atriumseptumdefect (ASD) behoort tot de meest voorkomende congenitale hartaandoeningen. Onbehandeld leidt het tot een blijvende links-rechtsshunt met secundaire volumeoverbelasting van het rechterhartsysteem. De structurele en elektrische omvorming (Engels: remodeling) die hierbij optreedt, vormt een substraat voor zowel tachyaritmie als conductieproblemen. Dit artikel beoogt een overzicht te geven van de aritmieën en conductiestoornissen gerelateerd aan ASD, alsook de invloed van ASD-correctie op de aritmogenese.
Achtergrond
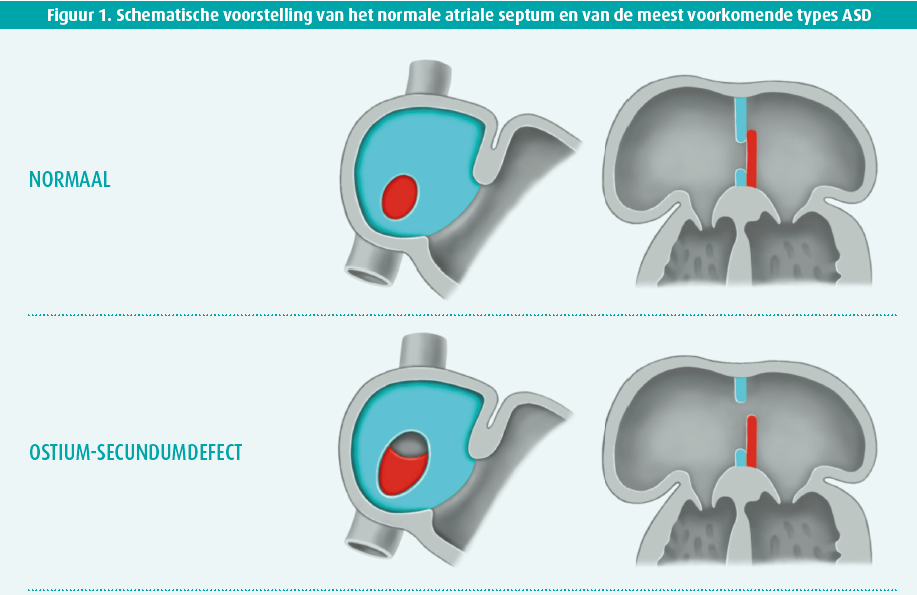
Een atriumseptumdefect (ASD) is een van de meest voorkomende vormen van congenitale hartaandoeningen met een geschatte incidentie van één tot drie per duizend geboortes, al is dit cijfer mogelijk een onderschatting gezien het veelal silentieuze karakter van de aandoening.1 Het spectrum van ASD wordt onderverdeeld in verschillende types op basis van de anatomische lokalisatie van het defect (figuur 1). Het meest voorkomende type is het ostium-secundumdefect en behelst ongeveer 80 % van alle ASD2. Een dergelijk defect bevindt zich in de regio van de fossa ovalis.2 Het tweede meest prevalente type is het ostium-secundumdefect (15 %) die zich in de nabijheid van de crux bevindt (aanhechtingspunt van de atrioventriculaire kleppen aan het cardiaal skelet). Gezien de nabije ligging bij het klepsysteem gaat dit defect typisch gepaard met misvorming van de atrioventriculaire (AV-) kleppen en een variabele graad van regurgitatie van ventrikel naar atrium.2 Het superior-sinus-venosusdefect (5 %) is gelokaliseerd nabij de ingang van de vena cava superior (VCS).2 Daarnaast zijn er nog twee zeldzaam voorkomende types ASD, namelijk het inferior-sinus-venosusdefect (< 1 %) en het sinus-coronariusdefect (< 1 %).2
Door de aanwezigheid van een ASD ontstaat een links-rechtsshunt die leidt tot een chronische volumeoverbelasting met een hemodynamische weerslag op voornamelijk het rechterhartsysteem, maar ook het linkerhart kan aangetast worden.3 Deze langdurige volumeoverbelasting geeft aanleiding tot een structurele omvorming van het hartspierweefsel met o.a. een vergroting van de individuele myocyten, ontwikkelen van interstitiële fibrose en (voor)kamervergroting tot gevolg.3, 4 Dit gaat gepaard met elektrische veranderingen in het hart die de patiënt voorbeschikt maakt voor het ontwikkelen van tachyaritmieën en conductieproblemen.3-5 Zowel de structurele als elektrische verandering verlopen meestal als een chronisch en insidieus proces waarbij symptomen zich vaak pas uiten op latere leeftijd. Symptoomontwikkeling is namelijk afhankelijk van het shuntvolume, wat op zijn beurt afhankelijk is van de compliantie en drukken van rechter- en linkerhart, alsook de grootte van het ASD.3 Een daling in compliantie van het linkerhart, of elke conditie waarbij de druk in het linkeratrium stijgt (o.a. hypertensie, ischemisch hartlijden of aorta-/mitraalkleplijden) kan het shuntvolume vergroten. Hierdoor kan een ASD dat op kinderleeftijd silentieus blijft, toch hemodynamisch en klinisch belangrijk worden naarmate de leeftijd vordert en de comorbiditeit toeneemt.3
Historisch gezien was een chirurgische correctie de enige behandeling van een ASD. In 1974 werd echter de eerste percutane ASD-correctie beschreven en in de decennia erna zijn verschillende methodes en devices ontwikkeld om een ASD percutaan te sluiten.6 Actueel zijn de twee meest gebruikte devices de Amplatzer Septal Occluder (St. Jude Medical, St. Paul, Minnesota) en de Gore HELEX (WL Gore & Associates, Flagstaff, Arizona).7 Hoewel een ostium-secundumdefect zowel chirurgisch als percutaan kan gesloten worden met lage mortaliteitscijfers (0-3 %) en goede langetermijnresultaten, draagt het percutaan sluiten van dergelijke defecten de voorkeur. Bij een percutane benadering vermijdt men namelijk een cardiopulmonaire bypass en sternotomie, en ziet men lagere morbiditeitscijfers en een kortere hospitalisatieduur. 2, 7-9 De chirurgische benadering wordt dan ook veelal voorbehouden voor die patiënten bij wie de anatomie een percutane sluiting niet toelaat (graad I-A-aanbeveling in de recente ESC-richtlijnen). 2, 7 De minder voorkomende defecten ter hoogte van het ostium primum, sinus venosus en sinus coronarius zijn veelal anatomisch ongeschikt voor percutane correctie en vereisen vaak een chirurgische benadering.10 Naast correctie van het defect zelf, laat het sluiten van een ASD eveneens toe om de structurele remodeling ten dele ongedaan te maken, een proces gekend als reverse remodeling. 3, 11 De elektrische veranderingen in het hart zijn echter veelal irreversibel van aard en dus blijven patiënten vaak een verhoogd risico op aritmie en conductieproblemen behouden.5, 12
Ritme- en conductieproblemen bij ASD
1. Tachyaritmieën
Atriale tachyaritmieën worden frequent gezien bij patiënten met een ASD, onafhankelijk van het type defect.4 Voorkamerfibrillatie of -flutter zijn hierbij het meest frequent. Hun incidentie is relatief zeldzaam op kinderleeftijd, maar stijgt naarmate ASD-herstel op latere leeftijd werd uitgevoerd.10, 12 Ongecorrigeerd bedraagt de incidentie van tachyaritmieën bij ASD-patiënten 10 % bij patiënten jonger dan 40 jaar, maar stijgt tot > 50 % bij individuen ouder dan 60 jaar.7, 12 Andere vormen van atriale ritmeproblematiek, zoals atriale ectopische tachycardie, AV nodale re-entrytachycardie (AVNRT) en AV re-entrytachycardie (AVRT), zijn eveneens meer prevalent dan in de algemene populatie.4 Het ontstaan van dergelijke aritmieën is gecorreleerd met de grootte van de shunt en de hemodynamische weerslag hiervan, zoals de aanwezigheid van pulmonale hypertensie.10
Tijdige correctie van een ASD doet de incidentie van dergelijke atriale tachyaritmieën dalen. Een systematische review en meta-analyse van Vecht toonde een significante daling in prevalentie van atriale tachyaritmie, dit zowel na een chirurgische (OR: 0,72; 95 % CI 0,60-0,87), als na een percutane sluiting (OR: 0,49; 95 % CI 0,32-0,76) en dit zowel in de eerste 30 dagen na correctie (OR: 0,80; 95 % CI 0,66-0,97), als bij opvolging tot 5 jaar na de procedure (OR: 0,47; 95 % CI 0,36-0,62).10 Ondanks deze reductie blijft ook na ASD-correctie de incidentie van atriale tachyaritmieën hoger dan in de algemene populatie, voornamelijk bij patiënten met een ASD-sluiting op oudere leeftijd, aanwezigheid van een grote shunt of bij comorbiditeiten.10, 13, 14 Vroegtijdige ASD-correctie werkt dus beschermend tegen het laattijdige optreden van atriale tachyaritmie, wat de rol van cardiale remodeling bevestigt.15
Niet alle tachyaritmieën kunnen echter worden toegeschreven aan de onderliggende structurele en elektrische omvorming van het hartspierweefsel, maar worden soms veroorzaakt door de ingreep an sich. Grofweg worden hierbij drie onderliggende pathofysiologische mechanismen beschreven. Een eerste groep betreft de aritmieën die zeer snel (dagen tot weken) na de procedure optreden en voornamelijk toe te schrijven zijn aan lokale irritatie van het conductieweefsel. Deze aritmieën komen voor bij 1-6 % van de procedures en verdwijnen spontaan bij twee op de drie patiënten in het eerste jaar na de procedure.3, 16-18 Een tweede groep zijn de patiënten die na een chirurgische benadering een de novo rechtszijdige aritmie ontwikkelen. Dat berust meestal op het ontstaan van een macro-re-entrycircuit die het atriotomielitteken, de patchranden of de cavo-tricuspidisthmus omvat.3 Eveneens kan een dergelijk littekenweefsel fungeren als origine van focale atriale tachycardie.19 Een derde groep omvat de patiënten die een percutane benadering kregen en bij wie de oorzaak van een persisterende atriale tachyaritmie haar origine vindt bij het device zelf. Het device veroorzaakt in dergelijke gevallen lokale irritatie, inflammatie en littekenvorming met atriale aritmie tot gevolg.3 Daarbij is gebleken dat noch het type device, noch de omvang ervan correleert met de incidentie van atriale aritmie.18 Studies die corrigeren voor het feit dat veelal grotere defecten chirurgisch gesloten worden, tonen overigens geen verschil in prevalentie van postoperatieve atriale aritmie bij percutane versus chirurgische ASD-sluiting. Dit ondanks de noodzakelijke atriotomie en de secundaire littekenvorming bij een chirurgische benadering.3, 10
Ondanks bewezen structurele remodeling van het rechterventrikel, is er tot op heden geen evidentie dat de aanwezigheid van een ASD eveneens aanleiding geeft tot een verhoogde incidentie van kamertachycardieën.3
2. Conductieproblemen
Net zoals tachyaritmieën, kunnen ook bradyaritmieën en conductieproblemen voorkomen ten gevolge van een ASD. Daarbij zijn zowel problemen met de sinusknoop als de AV-knoop gerapporteerd. Sinusknoopdisfunctie wordt voornamelijk gedocumenteerd bij sinus-venosusdefecten aangezien deze anatomisch nabij de sinusknoop liggen.4 De incidentie blijkt eveneens gecorreleerd met de leeftijd van de patiënt bij ASD-correctie, alsook met de shuntomvang.12, 20 Wat AV-knoopdisfunctie betreft, wordt een hooggradig AV-blok hoofdzakelijk gezien bij patiënten met een ostium-primumdefect vanwege de nabijheid van het defect bij de AV-knoop en de bundel van His.21 Bij de overige types ASD zijn dergelijke conductieproblemen eerder zeldzaam en komen zij voornamelijk voor als complicatie na chirurgisch of percutaan sluiten van het ASD, al bedraagt de incidentie hiervan < 1 % in verschillende retrospectieve studies. 20, 22 Bij de chirurgische benadering is dat meestal een uiting van peroperatieve schade aan het conductiesysteem, die meestal transiënt van aard is.7, 12, 22 Slechts zeer zelden moet worden overgegaan tot het plaatsen van een permanente pacemaker. Bij een percutane benadering treedt een hooggradig AV-blok eveneens zeer zelden op en presenteert het zich typisch in de eerste 24 uur na de procedure. Bovendien normaliseert ook hier de conductie vaak spontaan, of wanneer het device opnieuw verwijderd wordt.22 Gezien de link tussen de grootte van het defect (en dus de grootte van het device) en optreden van AV-conductieproblematiek, lijkt lokale druk van het device op de AV-knoop de meest plausibele pathofysiologische verklaring.22 Een studie van Suda et al. bij 162 patiënten toonde aan dat een devicegrootte van ≥ 19 mm of een geïndexeerde grootte van ≥ 0,18 mm/cm lichaamslengte een sterk voorbeschikkende factor bleek voor de ontwikkeling van een transiënt AV-blok.23 In tegenstelling tot het vroegtijdig optreden van AV-blok, is het laattijdig voorkomen van conductieproblemen na een ASD-correctie weinig beschreven. Zowel bij een percutane als chirurgische benadering beperkt de literatuur zich tot enkele casereports en wordt de incidentie lager dan 1 % ingeschat.7
Besluit
De meeste voorkomende aritmieën bij patiënten met een ASD zijn atriale tachyaritmieën, en dit zowel voor als na correctie van het defect. De incidentie neemt duidelijk toe met de leeftijd als het defect ongecorrigeerd blijft. ASD-correcties, zowel percutaan als chirurgisch, verminderen de kans op atriale tachyaritmieën op latere leeftijd. Toch blijft deze vaak hoger dan bij de algemene populatie. Het hoogste risico vinden we terug bij patiënten bij wie het ASD op oudere leeftijd wordt gesloten, de shunt groter is of meerdere comorbiditeiten aanwezig zijn. De mate van onderliggende structurele cardiale omvorming speelt aldus een belangrijke rol in de aritmogenese, al kan de ingreep an sich ook aan de basis van ritmeproblemen liggen.
Conductieproblemen zijn zeldzaam bij ASD-patiënten en het betreft meestal een sinusknoopdisfunctie in het geval van een sinus-venosusdefect of AV-blok in het geval het een ostium-primumdefect. Als conductieproblemen voorkomen als complicatie na een chirurgische, dan wel percutane ASD-correctie, treden zij meestal snel na de procedure op en zijn ze transiënt van aard. Laattijdige conductieproblemen bij ASD-patiënten zijn weinig frequent.
Referenties
- Martin, S.S., Shapiro, E.P., Mukherjee, M. Atrial septal defects - clinical manifestations, echo assessment, and intervention. Clin Med Insights Cardiol, 2014, 8 (Suppl 1), 93-98.
- Baumgartner, H., De Backer, J., Babu-Narayan, S.V., Budts, W., Chessa, M., Diller, G.-P., et al. 2020 ESC Guidelines for the management of adult congenital heart disease. Eur Heart J, 2020, 1-83.
- Chubb, H., Whitaker, J., Williams, S.E., Head, C.E., Chung, N.A., Wright, M.J., et al. Pathophysiology and Management of Arrhythmias Associated with Atrial Septal Defect and Patent Foramen Ovale. Arrhythmia Electrophysiol Rev, 2014, 3 (3), 168-172.
- Williams, M.R., Perry, J.C. Arrhythmias and conduction disorders associated with atrial septal defects. J Thorac Dis, 2018, 10 (Suppl 24), S2940-S2944.
- Morton, J.B., Sanders, P., Vohra, J.K., Sparks, P.B., Morgan, J.G., Spence, S.J., et al. Effect of chronic right atrial stretch on atrial electrical remodeling in patients with an atrial septal defect. Circulation, 2003, 107 (13), 1775-1782.
- King, T.D., Mills, N.L. Nonoperative closure of atrial septal defects. Surgery, 1974, 75 (3), 383-388.
- Jalal, Z., Hascoet, S., Baruteau, A. Long-term Complications After Transcatheter Atrial Septal Defect Closure: A Review of the Medical Literature. Can J Cardiol, 2016, 32 (11), 1315, e11-1315.e18.
- Butera, G., Carminati, M., Chessa, M., Youssef, R., Drago, M., Giamberti, A., et al. Percutaneous versus surgical closure of secundum atrial septal defect: comparison of early results and complications. Am Heart J, 2006, 151 (1), 228-234.
- Du, Z.D., Hijazi, Z.M., Kleinman, C.S., Silverman, N.H., Larntz, K. Comparison between transcatheter and surgical closure of secundum atrial septal defect in children and adults: results of a multicenter nonrandomized trial. J Am Coll Cardiol, 2002, 39 (11), 1836-1844.
- Vecht, J.A., Saso, S., Rao, C., Dimopoulos, K., Grapsa, J., Terracciano, C.M., et al. Atrial septal defect closure is associated with a reduced prevalence of atrial tachyarrhythmia in the short to medium term: a systematic review and meta-analysis. Heart, 2010, 96 (22), 1789-1797.
- Teo, K.S.L., Dundon, B.K., Molaee, P., Williams, K.F., Carbone, A., Brown, M.A., et al. Percutaneous closure of atrial septal defects leads to normalisation of atrial and ventricular volumes. J Cardiovasc Magn Reson, 2008, 10 (1), 55.
- Webb, G., Gatzoulis, M.A. Atrial septal defects in the adult: recent progress and overview. Circulation, 2006, 114 (15), 1645-1653.
- Duong, P., Ferguson, L.P., Lord, S., Murray, S., Shepherd, E., Bourke, J.P., et al. Atrial arrhythmia after transcatheter closure of secundum atrial septal defects in patients ≥ 40 years of age. Europace, 2017, 19 (8), 1322-1326.
- Gatzoulis, M.A., Freeman, M.A., Siu, S.C., Webb, G.D., Harris, L. Atrial arrhythmia after surgical closure of atrial septal defects in adults. N Engl J Med, 1999, 340 (11), 839-846.
- Roos-Hesselink, J.W., Meijboom, F.J., Spitaels, S.E.C., van Domburg, R., van Rijen, E.H.M., Utens, E.M.W.J., et al. Excellent survival and low incidence of arrhythmias, stroke and heart failure long-term after surgical ASD closure at young age. A prospective follow-up study of 21-33 years. Eur Heart J, 2003, 24 (2), 190-197.
- Alaeddini, J., Feghali, G., Jenkins, S., Ramee, S., White, C., Abi-Samra, F. Frequency of atrial tachyarrhythmias following transcatheter closure of patent foramen ovale. J Invasive Cardiol, 2006, 18 (8), 365-368.
Johnson, J.N., Marquardt, M.L., Ackerman, M.J., Asirvatham, S.J., Reeder, G.S., Cabalka, A.K., et al. Electrocardiographic changes and arrhythmias following percutaneous atrial septal defect and patent foramen ovale device closure. Catheter Cardiovasc Interv, 2011, 78 (2), 254-261. - Spies, C., Khandelwal, A., Timmermanns, I., Schräder, R. Incidence of atrial fibrillation following transcatheter closure of atrial septal defects in adults. Am J Cardiol, 2008, 102 (7), 902-906.
- de Groot, N.M.S., Zeppenfeld, K., Wijffels, M.C., Chan, W.K., Blom, N.A., Van der Wall, E.E., et al. Ablation of focal atrial arrhythmia in patients with congenital heart defects after surgery: role of circumscribed areas with heterogeneous conduction. Heart Rhythm, 2006, 3 (5), 526-535.
- Abaci, A., Unlu, S., Alsancak, Y., Kaya, U., Sezenoz, B. Short and long term complications of device closure of atrial septal defect and patent foramen ovale: meta-analysis of 28,142 patients from 203 studies. Catheter Cardiovasc Interv, 2013, 82 (7), 1123-1138.
- Goodman, D.J., Harrison, D.C., Cannom, D.S. Atrioventricular Conduction in Patients with Incomplete Endocardial Cushion Defect. Circulation, 1974, 49 (4), 631-637.
- Asakai, H., Eastaugh, L., Udekem, Y., Andreas, P. Atrioventricular block after ASD closure. Heart Asia, 2016, 8, 26-31.
- Suda, K., Raboisson, M.-J., Piette, E., Dahdah, N.S., Miró, J. Reversible atrioventricular block associated with closure of atrial septal defects using the Amplatzer device. J Am Coll Cardiol, 2004, 43 (9), 1677-1682.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.