Introduction
La communication interauriculaire (CIA) fait partie des cardiopathies congénitales les plus fréquentes. Si elle n'est pas traitée, elle entraîne un shunt gauche-droite persistant avec surcharge volémique secondaire du système cardiaque droit. Le remodelage structurel et électrique (remodeling) qui se produit dans ce contexte forme un substrat pour le développement d'une tachyarythmie et de troubles de la conduction. Cet article vise à offrir un aperçu des arythmies et des troubles de la conduction liés à la CIA, ainsi que de l'influence de la correction d'une CIA sur l'arythmogenèse.
Contexte général
La communication interauriculaire (CIA) est l'une des formes les plus fréquentes de cardiopathies congénitales, marquée par une incidence estimée de 1 à 3 pour 1000 naissances. L'incidence réelle est toutefois probablement supérieure au vu du caractère plutôt silencieux de l'affection.1 Le spectre de la CIA se subdivise en différents types selon la localisation anatomique de la communication (figure 1). La CIA de type ostium secundum est la plus courante, représentant environ 80 % e toutes les CIA2. Dans ce type de CIA, le défaut se situe dans la région de la fossa ovalis.2 Dans l'ordre de prévalence vient ensuite la CIA de type ostium primum (15 %), localisée à proximité de la croix (le point d'attache des valves auriculo-ventriculaires au squelette cardiaque). Compte tenu de la proximité du système valvulaire, ce type de CIA s'accompagne généralement d'une malformation des valves auriculo-ventriculaires (AV) et d'un degré variable de régurgitation du ventricule vers l'oreillette.2 La CIA de type superior sinus venosus (5 %) se localise à proximité de l'entrée de la veine cave supérieure (VCS)2. À cela viennent encore s'ajouter deux types de CIA rares, à savoir la CIA de type inferior sinus venosus (< 1 %) et la CIA du sinus coronaire (< 1 %).2
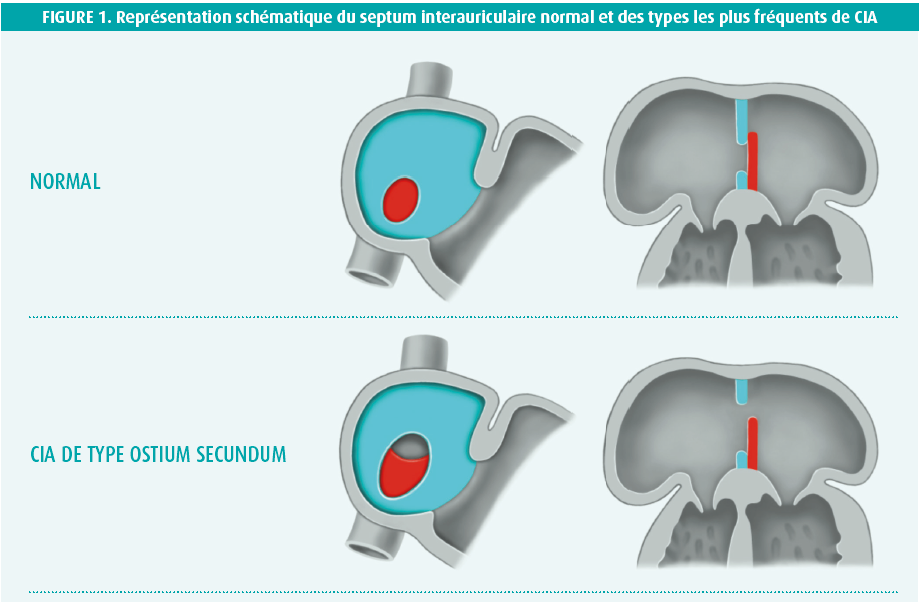
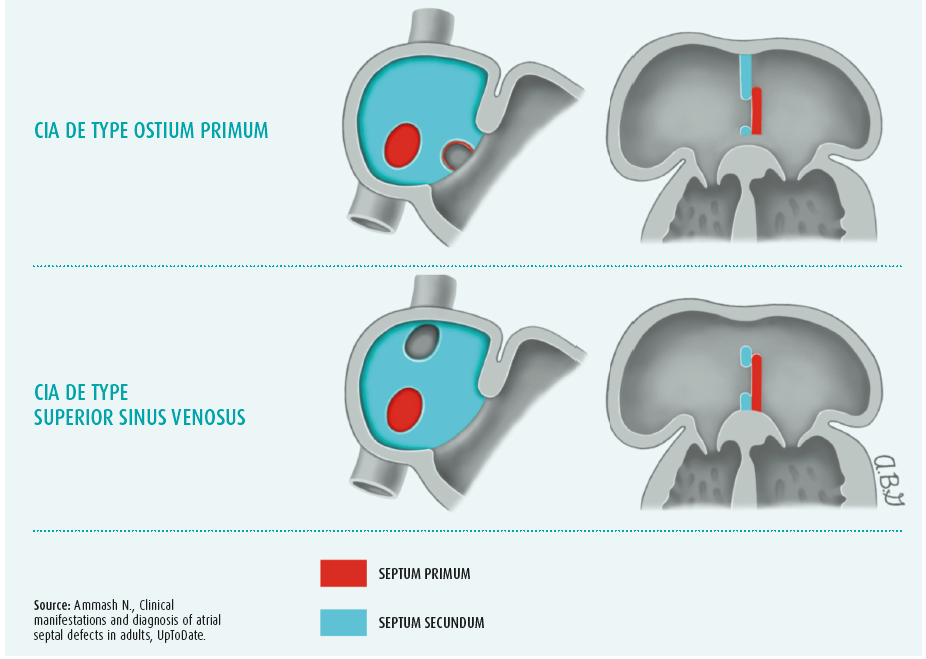
De la présence d'une CIA naît un shunt gauche-droite qui entraîne une surcharge volémique chronique, assortie de répercussions hémodynamiques principalement sur le coeur droit, mais le coeur gauche peut également être atteint.3 Cette surcharge volémique prolongée conduit à un remodelage structurel du tissu myocardique dont les conséquences sont, entre autres, une hyperplasie des myocytes individuels, un développement de fibrose interstitielle et une hyperplasie ventriculaire et/ou auriculaire.3, 4 Le tout s'accompagne de modifications électriques dans le coeur, qui prédisposent le patient au développement de tachyarythmies et de troubles de la conduction.3-5 Le remodelage structurel et électrique intervient la plupart du temps comme un processus chronique et insidieux, si bien que les symptômes ne se manifestent souvent qu'à un âge avancé. En effet, le développement de symptômes dépend du volume du shunt qui, à son tour, dépend de la compliance et de la pression du coeur droit et du coeur gauche, ainsi que de la taille de la CIA3. Une diminution de la compliance du coeur gauche, ou toute affection allant de pair avec une hausse de la pression dans l'oreillette gauche (e.a. hypertension, cardiopathie ischémique ou insuffisance aortique/mitrale), peut augmenter le volume du shunt. De ce fait, une CIA qui reste silencieuse durant l'enfance peut quand même devenir importante, d'un point de vue clinique et hémodynamique, au fil du temps et des comorbidités qui s'ajoutent.3
Historiquement, la correction chirurgicale était le seul traitement pour une CIA. Mais la première correction percutanée de CIA a été décrite en 1974 et, dans les décennies qui ont suivi, plusieurs méthodes et dispositifs ont été développés pour la fermeture percutanée des CIA6. À l'heure actuelle, les deux dispositifs les plus utilisés sont l'Amplatzer Septal Occluder (St. Jude Medical, St. Paul, Minnesota) et le Gore HELEX (WL Gore & Associates, Flagstaff, Arizona).7 Bien qu'une CIA de type ostium secundum puisse être fermée par voie chirurgicale ou percutanée avec un faible taux de mortalité (0-3 %) et de bons résultats à long terme, la fermeture percutanée est privilégiée. L'approche percutanée permet en effet d'éviter la circulation extracorporelle et la sternotomie, tout en offrant un taux de morbidité plus bas et une hospitalisation plus courte.2, 7-9 L'approche chirurgicale est donc généralement réservée aux patients dont l'anatomie fait obstacle à la fermeture percutanée (recommandation de classe IA dans les récentes directives de l'ESC).2, 7 Les communications moins fréquentes, au niveau de l'ostium primum, du sinus venosus et du sinus coronarius, sont pour la plupart inéligibles à la correction percutanée pour des raisons anatomiques, et requièrent souvent une approche chirurgicale.10 Outre la correction de la communication même, la fermeture d'une CIA permet également d'inverser partiellement le remodelage structurel selon un processus connu sous le nom de reverse remodeling.3, 11 En revanche, les modifications électriques subies dans le coeur sont pour la plupart irréversibles de nature et les patients restent donc souvent exposés à un risque accru d'arythmie et de troubles de la conduction.5, 12
Problèmes de rythme et de conduction dans la CIA
1. Tachyarythmies
Les tachyarythmies auriculaires sont fréquentes chez les patients CIA, quel que soit le type de communication4, les plus fréquentes étant la fibrillation ou le flutter auriculaire. Leur incidence est relativement rare dans l'enfance, mais augmente de plus en plus, plus la correction de la CIA est réalisée tard.10, 12 En l'absence de correction, l'incidence des tachyarythmies chez les patients CIA s'élève à 10 % avant l'âge de 40 ans, mais grimpe à plus de 50 % après l'âge de 60 ans.7, 12
D'autres formes d'arythmies auriculaires, comme la tachycardie auriculaire ectopique, la tachycardie par réentrée intranodale (TRIN) et la tachycardie par réentrée AV (TRAV), ont également une prévalence plus élevée que dans la population générale.4 La survenue de ces arythmies est liée à la taille du shunt et à ses répercussions hémodynamiques, comme la présence d'une hypertension pulmonaire.10
La correction précoce d'une CIA fait baisser l'incidence de telles tachyarythmies auriculaires. Une revue systématique et méta-analyse de J.A. Vecht a montré une baisse significative de la prévalence de tachyarythmie auriculaire, aussi bien après une fermeture chirurgicale (OR: 0,72; IC à 95 %: 0,60-0,87), qu'après une fermeture percutanée (OR: 0,49; IC à 95 %: 0,32-0,76), et ce tant dans les 30 premiers jours suivant la correction (OR: 0,80; IC à 95 %: 0,66-0,97), que lors du suivi jusqu'à cinq ans après la procédure (OR: 0,47; IC à 95 %: 0,36-0,62).10 En dépit de cette réduction, l'incidence des tachyarythmies auriculaires reste, également après la fermeture d'une CIA, plus élevée que dans la population générale, surtout parmi les patients chez qui la correction a été effectuée à un âge avancé, en présence d'un shunt important ou de comorbidités. 10, 13, 14 La correction précoce d'une CIA a donc des effets protecteurs contre l'apparition tardive d'une tachyarythmie auriculaire, ce qui confirme le rôle du remodelage cardiaque.15
Toutes les tachyarythmies ne peuvent cependant pas être attribuées au remodelage structurel et électrique sous-jacent du tissu myocardique; certaines sont parfois causées par l'intervention en soi. En résumé, trois mécanismes physiopathologiques sous-jacents sont décrits à cet égard. Un premier groupe concerne les arythmies qui apparaissent très vite (de quelques jours à quelques semaines) après la procédure et qui sont principalement dues à une irritation locale du tissu de conduction. Ces arythmies surviennent dans 1 à 6 % des procédures et disparaissent spontanément, chez deux patients sur trois, dans l'année qui suit l'intervention.3, 16-18 Un deuxième groupe englobe les patients qui développent une arythmie droite de novo après une approche chirurgicale. Le phénomène repose généralement sur l'apparition d'un circuit de macro-réentrées recouvrant la cicatrice de l'atriotomie, les bords du patch ou l'isthme cavo-tricuspidien.3 De même, un tel tissu cicatriciel peut être à l'origine d'une tachycardie atriale focale.19 Enfin, un troisième groupe reprend les patients qui ont subi une intervention percutanée et chez qui la cause d'une tachyarythmie auriculaire persistante trouve son origine dans le dispositif même. Dans ces cas, le dispositif occasionne une irritation, une inflammation et une fibrose locales, qui entraînent une arythmie auriculaire.3 Il s'est avéré que ni le type de dispositif, ni son étendue ne présentait de corrélation avec l'incidence de l'arythmie auriculaire.18 Les études qui apportent une correction pour le fait que la plupart des communications de plus grande ampleur sont fermées par abord chirurgical ne révèlent par ailleurs pas de différence de prévalence d'arythmie auriculaire postopératoire entre la fermeture percutanée et la fermeture chirurgicale d'une CIA. Et ce, malgré l'atriotomie nécessaire et la cicatrice qui en découle dans le cadre d'une approche chirurgicale.3, 10
Malgré le remodelage structurel démontré du ventricule droit, il n'existe à ce jour aucune preuve étayant le lien causal entre la présence d'une CIA et l'incidence accrue de tachycardies ventriculaires.3
2. Problèmes de conduction
Au même titre que les tachyarythmies, des bradyarythmies et troubles de la conduction peuvent survenir à la suite d'une CIA. Dans ce cadre, des problèmes ont été rapportés tant au niveau du noeud sinusal qu'au niveau du noeud AV. Le dysfonctionnement du noeud sinusal est principalement documenté dans les CIA de type sinus venosus, qui se situent à proximité du noeud sinusal.4 L'incidence semble également liée à l'âge du patient au moment de la correction de la CIA, ainsi qu'à l'ampleur du shunt.12, 20 En ce qui concerne le dysfonctionnement du noeud AV, un bloc AV de haut grade est essentiellement observé dans les CIA de type ostium primum du fait de la proximité de la communication avec le noeud AV et le faisceau de His.21 Dans les autres types de CIA, ces troubles de la conduction sont plutôt rares et se produisent principalement en tant que complications après la fermeture chirurgicale ou percutanée de la CIA, bien que leur incidence soit inférieure à 1 % dans diverses études rétrospectives.20, 22 Dans le cas d'une approche chirurgicale, il s'agit généralement d'une manifestation de lésions peropératoires occasionnées au système de conduction, qui sont la plupart du temps de nature transitoire.7, 12, 22 La pose d'un stimulateur cardiaque permanent n'est nécessaire que dans de très rares cas. Les blocs AV de haut grade sont également très rares en cas d'approche percutanée et, généralement, ils se manifestent dans les 24 heures qui suivent la procédure. Qui plus est, la conduction se normalise souvent spontanément, ou lorsque le dispositif est retiré.22 Vu le lien entre la taille de la communication (et donc la taille du dispositif) et la survenue de problèmes de conduction AV, la pression locale exercée par le dispositif sur le noeud AV semble être l'explication physiopathologique la plus plausible.22 Une étude de K. Suda et al., menée auprès de 162 patients, a montré qu'une taille de dispositif ≥ 19 mm ou une taille indexée de ≥ 0,18 mm/cm était un facteur prédisposant fort de développement d'un bloc AV transitoire.23 Contrairement à la survenue précoce d'un bloc AV, la survenue tardive de problèmes de conduction après la correction d'une CIA a été peu décrite. Que ce soit après une fermeture percutanée ou après une fermeture chirurgicale, la littérature se limite à quelques rapports de cas et l'incidence est estimée à moins de 1 %.7
Conclusion
Les arythmies les plus courantes chez les patients CIA sont les tachyarythmies auriculaires, et ce tant avant qu'après correction de la communication. En l'absence de fermeture, l'incidence augmente nettement avec l'âge. Les fermetures de CIA, aussi bien percutanées que chirurgicales, réduisent le risque de tachyarythmies auriculaires à un âge plus avancé. Malgré tout, ce risque reste souvent plus élevé que dans la population générale. Le risque est maximum chez les patients qui ont subi une intervention de correction à un âge avancé, lorsque le shunt est de grande ampleur ou en présence de plusieurs comorbidités. Le degré de remodelage cardiaque structurel sous-jacent joue ainsi un rôle important dans l'arythmogenèse, bien que l'intervention en soi puisse également être à l'origine de troubles du rythme.
Les problèmes de conduction sont rares chez les patients CIA et concernent généralement un dysfonctionnement du noeud sinusal dans le cas d'une CIA de type sinus venosus, ou un bloc AV dans le cas d'une CIA de type ostium primum. Lorsque des problèmes de conduction apparaissent en complication après la correction chirurgicale ou percutanée d'une CIA, ils surviennent le plus souvent rapidement après la procédure et sont de nature transitoire. Chez les patients CIA, les problèmes de conduction tardifs sont peu fréquents.
Références
- Martin, S.S., Shapiro, E.P., Mukherjee, M. Atrial septal defects - clinical manifestations, echo assessment, and intervention. Clin Med Insights Cardiol, 2014, 8 (Suppl 1), 93-98.
- Baumgartner, H., De Backer, J., Babu-Narayan, S.V., Budts, W., Chessa, M., Diller, G.-P., et al. 2020 ESC Guidelines for the management of adult congenital heart disease. Eur Heart J, 2020, 1-83.
- Chubb, H., Whitaker, J., Williams, S.E., Head, C.E., Chung, N.A., Wright, M.J., et al. Pathophysiology and Management of Arrhythmias Associated with Atrial Septal Defect and Patent Foramen Ovale. Arrhythmia Electrophysiol Rev, 2014, 3 (3), 168-172.
- Williams, M.R., Perry, J.C. Arrhythmias and conduction disorders associated with atrial septal defects. J Thorac Dis, 2018, 10 (Suppl 24), S2940-S2944.
- Morton, J.B., Sanders, P., Vohra, J.K., Sparks, P.B., Morgan, J.G., Spence, S.J., et al. Effect of chronic right atrial stretch on atrial electrical remodeling in patients with an atrial septal defect. Circulation, 2003, 107 (13), 1775-1782.
- King, T.D., Mills, N.L. Nonoperative closure of atrial septal defects. Surgery, 1974, 75 (3), 383-388.
- Jalal, Z., Hascoet, S., Baruteau, A. Long-term Complications After Transcatheter Atrial Septal Defect Closure: A Review of the Medical Literature. Can J Cardiol, 2016, 32 (11), 1315, e11-1315.e18.
- Butera, G., Carminati, M., Chessa, M., Youssef, R., Drago, M., Giamberti, A., et al. Percutaneous versus surgical closure of secundum atrial septal defect: comparison of early results and complications. Am Heart J, 2006, 151 (1), 228-234.
- Du, Z.D., Hijazi, Z.M., Kleinman, C.S., Silverman, N.H., Larntz, K. Comparison between transcatheter and surgical closure of secundum atrial septal defect in children and adults: results of a multicenter nonrandomized trial. J Am Coll Cardiol, 2002, 39 (11), 1836-1844.
- Vecht, J.A., Saso, S., Rao, C., Dimopoulos, K., Grapsa, J., Terracciano, C.M., et al. Atrial septal defect closure is associated with a reduced prevalence of atrial tachyarrhythmia in the short to medium term: a systematic review and meta-analysis. Heart, 2010, 96 (22), 1789-1797.
- Teo, K.S.L., Dundon, B.K., Molaee, P., Williams, K.F., Carbone, A., Brown, M.A., et al. Percutaneous closure of atrial septal defects leads to normalisation of atrial and ventricular volumes. J Cardiovasc Magn Reson, 2008, 10 (1), 55.
- Webb, G., Gatzoulis, M.A. Atrial septal defects in the adult: recent progress and overview. Circulation, 2006, 114 (15), 1645-1653.
- Duong, P., Ferguson, L.P., Lord, S., Murray, S., Shepherd, E., Bourke, J.P., et al. Atrial arrhythmia after transcatheter closure of secundum atrial septal defects in patients ≥ 40 years of age. Europace, 2017, 19 (8), 1322-1326.
- Gatzoulis, M.A., Freeman, M.A., Siu, S.C., Webb, G.D., Harris, L. Atrial arrhythmia after surgical closure of atrial septal defects in adults. N Engl J Med, 1999, 340 (11), 839-846.
- Roos-Hesselink, J.W., Meijboom, F.J., Spitaels, S.E.C., van Domburg, R., van Rijen, E.H.M., Utens, E.M.W.J., et al. Excellent survival and low incidence of arrhythmias, stroke and heart failure long-term after surgical ASD closure at young age. A prospective follow-up study of 21-33 years. Eur Heart J, 2003, 24 (2), 190-197.
- Alaeddini, J., Feghali, G., Jenkins, S., Ramee, S., White, C., Abi-Samra, F. Frequency of atrial tachyarrhythmias following transcatheter closure of patent foramen ovale. J Invasive Cardiol, 2006, 18 (8), 365-368.
Johnson, J.N., Marquardt, M.L., Ackerman, M.J., Asirvatham, S.J., Reeder, G.S., Cabalka, A.K., et al. Electrocardiographic changes and arrhythmias following percutaneous atrial septal defect and patent foramen ovale device closure. Catheter Cardiovasc Interv, 2011, 78 (2), 254-261. - Spies, C., Khandelwal, A., Timmermanns, I., Schräder, R. Incidence of atrial fibrillation following transcatheter closure of atrial septal defects in adults. Am J Cardiol, 2008, 102 (7), 902-906.
- de Groot, N.M.S., Zeppenfeld, K., Wijffels, M.C., Chan, W.K., Blom, N.A., Van der Wall, E.E., et al. Ablation of focal atrial arrhythmia in patients with congenital heart defects after surgery: role of circumscribed areas with heterogeneous conduction. Heart Rhythm, 2006, 3 (5), 526-535.
- Abaci, A., Unlu, S., Alsancak, Y., Kaya, U., Sezenoz, B. Short and long term complications of device closure of atrial septal defect and patent foramen ovale: meta-analysis of 28,142 patients from 203 studies. Catheter Cardiovasc Interv, 2013, 82 (7), 1123-1138.
- Goodman, D.J., Harrison, D.C., Cannom, D.S. Atrioventricular Conduction in Patients with Incomplete Endocardial Cushion Defect. Circulation, 1974, 49 (4), 631-637.
- Asakai, H., Eastaugh, L., Udekem, Y., Andreas, P. Atrioventricular block after ASD closure. Heart Asia, 2016, 8, 26-31.
- Suda, K., Raboisson, M.-J., Piette, E., Dahdah, N.S., Miró, J. Reversible atrioventricular block associated with closure of atrial septal defects using the Amplatzer device. J Am Coll Cardiol, 2004, 43 (9), 1677-1682.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.