ESC-congres 2020
Symposiumverslag
Deze sessie werd voorgezeten door prof. Pablo Garcia-Pavia (Madrid, Spanje) en prof. Thibaud Damy (Creteil, Frankrijk).
Tijdens deze sessie werd er dieper ingegaan op de laatste inzichten en behandelingsmogelijkheden bij patiënten met transthyretine-amyloïde cardiomyopathie (ATTR-CM).
In het eerste deel van de sessie besprak prof. Pablo Garcia-Pavia de huidige medische behandelingsmogelijkheden. ATTRCM is een progressieve en fatale aandoening waarbij de patiënten die vandaag gediagnosticeerd worden slechts het tipje van de ijsberg voorstellen. Uit onderzoek blijkt meer en meer dat ATTR-CM frequenter voorkomt dan gedacht. Zo bedroeg in een studie de prevalentie van amyloïde cardiale neerslag bij 65-plussers met hartfalen met bewaarde ejectiefractie en linkerventrikelhypertrofie van 15 mm of meer, zelfs 10 %1. Gelijkaardige cijfers werden ook gevonden in patiënten die een transkatheter-aortaklepimplantatie kregen (TAVI).
Tot recent bestonden er voornamelijk ondersteunende medische behandelingen voor deze aandoening die alleen de gevolgen behandelen maar niet inwerken op de onderliggende oorzaak. De hoeksteen van de hartfalentherapie bestaat er altijd in om de congestie of vochtaccummulatie te vermijden door een zoutarm dieet met waterrestrictie en het dagelijks wegen om de dosis van de diuretica te optimaliseren. Er is tot op heden ook geen enkele evidentie dat de klassieke HFrEF-therapie (hartfalen met verminderde ejectiefractie) met o.a. ACE-inhibitoren, sartanen, bètablokkers, mineralocorticoïdereceptorantagonisten of ivabradine ook maar enig klinisch of prognostisch effect hebben bij ATTR-CM. Er zijn integendeel data die aantonen dat deze medicatie het verloop zelfs kan verslechteren. De ervaring leert ons immers dat ACE-inhibitoren of sartanen slecht getolereerd worden vanwege hypotensie. Hetzelfde is zeker waar voor de bètablokkers waarbij patiënten vaak klinisch verbeteren na stopzetting, omdat het hartdebiet bij een dergelijke restrictieve cardiomyopathie meer hartslagafhankelijk is. Een ander belangrijk aspect bij ATTR-CM betreft het voorkomen en behandelen van voorkamerritmestoornissen. Zo is er een studie die aantoont dat het behoud van het sinusritme na een doorgemaakte episode van voorkamerfibrillatie de prognose bij deze patiënten zou kunnen verbeteren. Elektrische cardioversie is echter niet zonder risico en tot 20 % van de patiënten kunnen zelfs te kampen krijgen met complicaties zoals ventriculaire ritmestoornissen, een tijdelijk AV-blok en ischemische beroerte. Het succes van de cardioversie hangt vooral af van het stadium van de ATTR-CM waarin de patiënt zich bevindt. Hoe meer uitgesproken en gevorderd de aandoening al aanwezig is (aan de hand van de gilmore-schaal2), des te minder kans op behoud van sinusritme. Bovendien is het onduidelijk vanaf wanneer patiënten moeten geanticoaguleerd worden, aangezien in een andere studie met MRI bij een behoorlijk aantal intracardiale trombi werd vastgesteld, en dit zelfs in sinusritme (zoals bij mitralisklepstenose). Bijkomend is het momenteel ook niet geweten welke anticoagulantia (warfarine versus DOAC's) het meest doeltreffend zijn hierbij.
Vervolgens besprak prof. Thibaud Damy de rol van tafamidis voor de behandeling van ATTR-CM. Tafamidis remt de amyloïdeneerslag in de organen af door selectief op de thyroxine bindingsplaats van het plasmatransthyretine-eiwit (TTR) te binden, waardoor er geen dissociatie in haar monomeren kan plaatsvinden; het zijn immers deze monomeren die de basis vormen voor de amyloïdeneerslag. Op basis van de ATTR-ACT-studie is tafamidis 61 mg eenmaal per dag goedgekeurd door het EMA voor de behandeling van wildtype (WT) en erfelijke ('heriditary') cardiale transthyretine-amyloïdose bij volwassenen3.
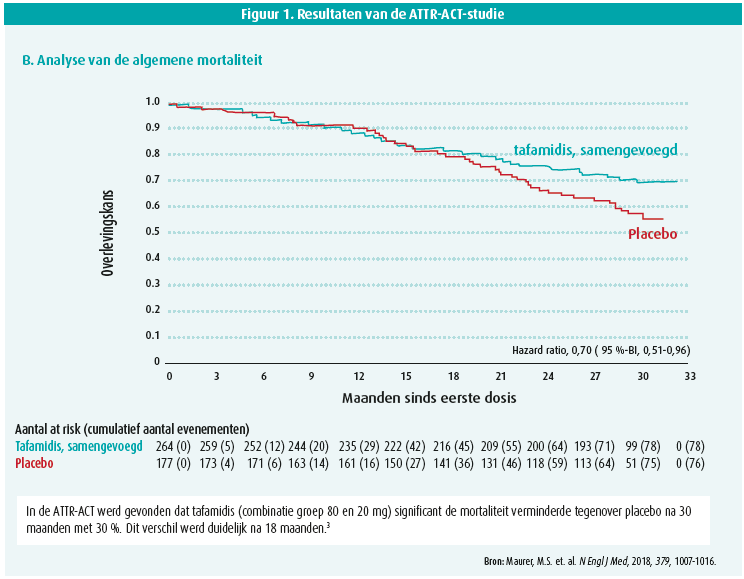
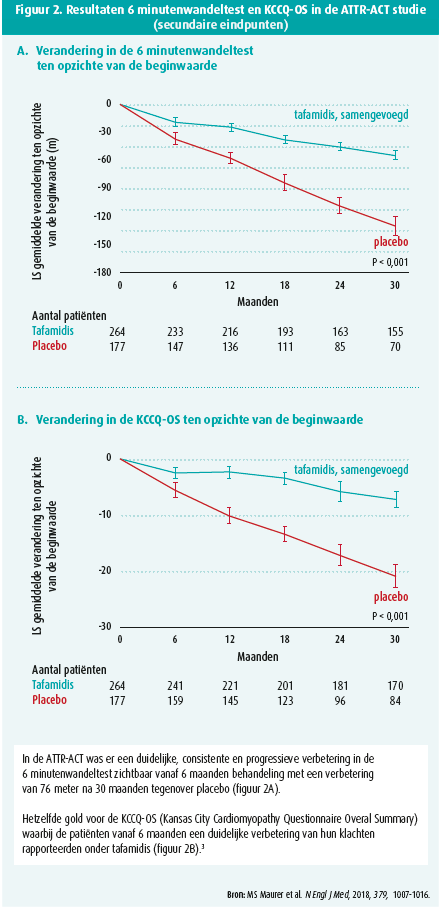
Daarbij is tafamidis 61 mg het goedgekeurde bio-equivalent van het 80 mg tafamidis- meglumine (viermaal daags 20 mg) dat in de ATTR-ACT-studie werd gebruikt. De resultaten van deze studie werden gerapporteerd tijdens het ECS-congres in München in 2018 en simultaan gepubliceerd in het New England Journal of Medicine. In deze multicentrische studie werden 441 patiënten met WT (n = 335) of erfelijke (= 106) ATTR-CM onderzocht op een dubbelblinde, gerandomiseerde en placebogecontroleerde manier. Deze patiënten werden gerandomiseerd in drie groepen: tafamidis-meglumine 80 mg/ dag, 20 mg/dag en placebo. Daarbij werd ontdekt dat in de gehele tafamidisgroep de combinatie van mortaliteit en cardiovasculairgerelateerde hospitalisaties significant verminderde tegenover placebo na 30 maanden. Desondanks blijft ATTR-CM een aandoening met een beperkte prognose waarbij na 30 maanden 71 % van de patiënten nog leefde in de tafamidisgroep versus 57 % in de placebogroep. De relatievemortaliteitsdaling bedroeg 30 % tegenover placebo met een 'number needed to treat' van 7,5 (figuur 1). Tafamidis is dus de eerste behandeling die een reductie van de mortaliteit heeft kunnen aantonen bij ATTR-CM. Daarenboven werd ook ontdekt dat tafamidis een relatiefrisicoreductie van 32 % met zich meebracht voor cardiovasculairgerelateerde hospitalisaties na 30 maanden tegenover placebo. Ook de subjectieve en klinische parameters verbeterden. Zo was er een duidelijke consistente en progressieve verbetering in de 6 minutenwandeltest zichtbaar vanaf 6 maanden behandeling met een verbetering van 76 meter na 30 maanden tegenover placebo. Hetzelfde gold voor de KCCQ-OS (Kansas City Cardiomyopathy Questionnaire Overal Summary) waarbij de patiënten vanaf 6 maanden een duidelijke verbetering van hun klachten rapporteerden onder tafamidis (figuur 2A en 2B).
Na 30 maanden kregen de patiënten de mogelijkheid om deel te nemen aan de ATTR-ACT-extensiestudie waarbij de placebogroep gerandomiseerd werd in een 2:1-verhouding naar 80/20 mg tafamidis. Vanaf 1 juli 2018 werden alle patiënten omgezet naar de nieuwe, eenmaal daagse formulering van 61 mg (bio-equivalent van tafamidis meglumine 80 mg). De resultaten van deze studie werden door prof. Damy gepresenteerd op het Europese hartfalencongres in juni van dit jaar. Deze data tonen aan dat tafamidis 80 mg een betere langetermijnoverleving bood tegenover 20 mg na 51 maanden met een 30 % risicoreductie, wat bijgevolg ook de voorkeursdosering is.
Het veiligheidsprofiel voor tafamidis bleek eveneens gunstig met een globaal gelijkaardige rapportering van nevenwerkingen tegenover placebo. Flatulentie en licht verstoorde levertesten bleken iets meer frequent bij tafamidis. Recente data tonen ook dat tafamidis 61 mg het totale serumthyroxine doet dalen zonder een effect op vrij T4- of het TSH-hormoon.
Na de voorstelling van deze gegevens volgde vervolgens nog een live online Q&A-sessie met beide moderatoren, waarbij nog enkele interessante en praktische vragen naar voren kwamen in verband met de diagnose en behandeling van ATTR-CM.
In de praktijk wordt aangeraden om te starten met de behandeling met tafamidis van zodra een cardiale aantasting bewezen kan worden. Hoe vroeger de behandeling kan worden gestart, hoe beter (NYHA I en II), omdat uit de ATTR-ACT blijkt dat deze groep het meeste voordeel heeft, maar ook bij NYHA III zijn er aanwijzingen (op basis van de ATTR-ACT-extensiestudie) dat er een gunstig effect kan verwacht worden4. Er is daarbij echter geen reversibiliteit op het hart of andere organen te verwachten, waardoor tafamidis niet aangewezen is bij NYHA IV (dit was een exclusiecriterium van de ATTR-ACT). Dit kan eveneens verklaren waarom het effect op de mortaliteit pas na een 18-tal maanden zichtbaar begon te worden (figuur 1).
Voor de diagnose van TTR-CM volstaat in de praktijk vaak een positieve botscan met duidelijke cardiale opname (graad 2 of 3) én uitsluiting van onderliggende AL amyloïdose (amyloïde lichte keten) bij patiënten met cardiale hypertrofie5. Er zijn wel zeldzame andere oorzaken die kunnen leiden tot valspositieve cardiale opname, zoals hydroxychloroquinetoxiciteit, die ook uitgesloten moeten worden. Cardiale biopsie kan evenwel noodzakelijk zijn wanneer de beeldvorming onduidelijk is (bv. valsnegatief bij hoog klinisch vermoeden). Ongeacht de leeftijd van de patiënt wordt genetische testing altijd aangeraden om een erfelijke vorm van ATTR-CM uit te sluiten in verband met genetische counseling van de familieleden.
Voor asymptomatische genetische dragers van een TTR-afwijking wordt aangeraden te wachten totdat cardiale depositie van amyloïde aangetoond is. In het zeldzame geval van gecombineerde familiale transthyretine-amyloïdeneuropathie en -cardiomyopathie wordt volgens prof. Damy ook best tafamidis 61 mg aangeraden in plaats van 20 mg.
Noot van de auteur
In België is op het moment van het schrijven van dit artikel tafamidis nog niet terugbetaald voor de behandeling van TTR-CM, maar wordt verwacht in de loop van 2021. De firma Pfizer heeft evenwel sinds 1/8/20 een medisch noodprogramma lopende in afwachting daarvan.
Referenties
- Damy, T., Costes, B., Hagège, A.A., Donal, E., Eicher, J.C., Slama, M., et al. Prevalence and clinical phenotype of hereditary transthyretin amyloid cardiomyopathy in patients with increased left ventricular wall thickness. Eur Heart J, 2016, 37>, 1826-1834.
- Gillmore, J.D., Damy, T., Fontana, M., Hutchinson, M., Lachmann, H.J., Martinez- Naharro, A., et al. A new staging system for cardiac transthyretin amyloidosis. Eur Heart J, 2018, 39, 2799-2806.
- Maurer, M.S.,, Schwartz J.H., Gundapaneni, B., Elliott, P.M., Merlini, G., Waddington-Cruz, M., et al. Tafamidis Treatment for Patients with Transthyretin Amyloid Cardiomyopathy. N Engl J Med, 2018, NEJMoa1805689.
- Rapezzi, C,. ESC 2020 e-poster: Benefits of tafamidis in patients with advanced transthyretin amyloid cardiomyopathy.
- Hanna, M., Ruberg, F.L., Maurer, M.S., Dispenzieri, A., Dorbala, S., Falk, R.H., et al. Cardiac Scintigraphy With Technetium-99m- Labeled Bone-Seeking Tracers for Suspected Amyloidosis: JACC Review Topic of the Week. J Am Coll Cardiol, 2020, 75, 2851-2862.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.