BSC-sessieverslag - sessie 5
De 40ste editie van het jaarlijkse congres van de Belgian Society of Cardiology vond dit jaar noodgedwongen virtueel plaats. Desal niettemin werden diverse interessante topics besproken door nationale en internationale experten. Zo ook een sessie omtrent het gebruik van SGLT2-inhibitoren bij patiënten die lijden aan hartfalen met gereduceerde ejectiefractie (HFrEF), waarvan dit verslag een samenvatting zal geven. Sprekers waren Wilfried Mullens (Ziekenhuis Oost-Limburg), Christian Mueller (Universitair Ziekenhuis Basel, Zwitserland) en Anne-Catherine Pouleur (Universitair Ziekenhuis St-Luc).
De ontwikkeling van SGLT2-inhibitoren
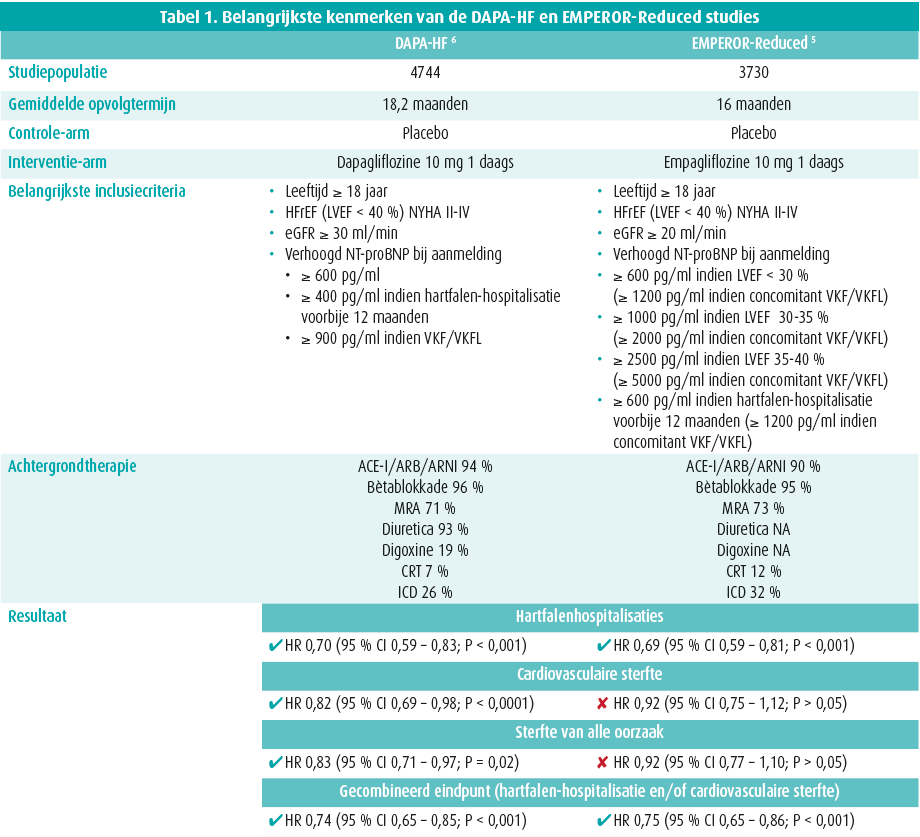
Diabetes mellitus en cardiovasculair lijden gaan vaak hand in hand. Het is dan ook verbazend dat de meeste antidiabetica potentieel schadelijk zijn voor het cardiovasculair systeem. Zelfs de toediening van insuline blijkt geassocieerd met een verhoogde zoutretentie en het potentieel ontwikkelen van congestietekenen.1 Om dit in de toekomst te vermijden besliste het Amerikaanse geneesmiddelenagentschap (FDA) in 2008 dat elk nieuw antidiabeticum vanaf dat moment zijn cardiovasculaire veiligheid diende te bewijzen in kwalitatief onderzoek (de zogeheten cardiovascular outcome trials, CVOT). Vanaf dat moment kon een nieuw antidiabeticum slechts op de markt komen als het zijn cardiovasculaire veiligheid had bewezen. Naast metformine zijn er tot op heden slechts 2 andere klassen antidiabetica met een gunstig cardiovasculair risicoprofiel: de GLP1-agonisten en de SGLT2-inhibitoren. Hoewel enkel de bedoeling om cardiovasculaire veiligheid na te gaan, toonden de CVOT's van deze laatste groep verbazend genoeg een duidelijke reductie in het aantal hospitalisaties vanwege hartfalen. 2-4 Een effect dat zich bovendien reeds vroeg na randomisatie liet merken en dus niet kon worden toegeschreven aan het glucoseverlagende effect van deze geneesmiddelklasse. Om deze bevinding verder te onderzoeken werden dan ook bijkomende studies gepubliceerd in een populatie met HFrEF, onafhankelijk van de aanwezigheid van diabetes mellitus (DAPA-HF & EMPEROR-reduced).5,6 Beide studies toonden een impressionante daling in een gecombineerd eindpunt van hartfalenhospitalisaties en cardiovasculaire mortaliteit (tabel 1). Sindsdien wordt de evidentie voor het gebruik van deze geneesmiddelklasse bij HFrEF-patiënten enkel groter en stelt zich de vraag hoe en wanneer deze middelen moeten worden ingezet.

Decongestieve en nefroprotectieve effecten
Het is belangrijk te noteren dat we het risico op hospitalisatie of sterfte bij een patiënt met HFrEF niet mogen onderschatten. Zo toonde DAPA-HF aan dat liefst een vijfde van de patiënten binnen het anderhalf jaar een dergelijk event ondervindt. Daarnaast blijkt de persisterende aanwezigheid van congestie bij ontslag uit het ziekenhuis een ernstige risicofactor voor rehospitalisatie en mortaliteit. 7 Congestie wordt aldus gezien als een belangrijk alarmteken dat adequaat moet worden aangepakt. Een correct gebruik van diuretica is dus belangrijk, waarbij deze snel en aan een correcte dosering moeten worden ingezet met nadien een regelmatige herevaluatie. De SGLT2-inhibitoren bezitten eveneens anti-diuretische en decongestieve eigenschappen en oefenen hun antidiuretische effect proximaal in de tubulus uit. De EMPA-RESPONSE-AHF-studie was hierbij de eerste, weliswaar kleinschalige, studie die aantoonde dat het gebruik ervan bij acuut gedecompenseerd hartfalen aanleiding geeft tot een vergroot urinair volume en een verminderd risico op rehospitalisatie of sterfte op 60 dagen.8 De decongestieve werking van SGLT2- inhibitoren wordt niet bekomen door een vergrote natriurese, maar wel door een osmotische diurese.
Naast het cardioprotectieve effect van de SGLT2-inhibitoren, werd ook het potentieel nefroprotectieve effect nagegaan in diverse studies.9,10 Dat aangezien de aanwezigheid van chronisch nierlijden in sterke mate bijdraagt tot een slechte prognose bij patiënten met HFrEF, en de aanwezigheid van HFrEF ook de progressie van nierlijden bevordert.11 Uit deze studies bleek dat SGLT2-inhibitoren inderdaad verdere progressie van renale deterioratie kunnen afremmen. Zo toonde de CREDENCE-trial dat het gebruik van canagliflozine bij diabeten met chronisch nierlijden het relatieve risico op het ontwikkelen van eindstadium nierfalen met 32 % deed dalen.9 Ook DAPA-CKD-trial toonde bij patiënten met chronisch nierlijden dat het gebruik van dapagliflozine het risico op het ontwikkelen van eindstadium nierfalen, significante renale deterioratie, of sterfte met 44 % deed dalen. Dit effect was bovendien onafhankelijk van de aan- of afwezigheid van diabetes mellitus type 2.10
De plaats van de SGLT2-inhibitoren binnen hartfalen
Nu het scala aan hartfalentherapieën substantieel groter wordt, stelt de vraag zich wanneer welke therapie dient ingesteld te worden. Historisch groeide de aanbeveling om de diverse preparaten (bètablokkers, ACE-inhibitoren en mineralocorticoïdereceptorantagonisten) stap voor stap te starten en geleidelijk op te titreren, voornamelijk omdat de onderliggende trials eveneens opeenvolgend werden uitgevoerd. Aangezien het gamma aan beschikbare middelen ondertussen zeer uitgebreid is, blijkt deze benadering niet meer gepast. Een dergelijke benadering leidt namelijk vaak tot een zeer lang tijdsinterval voordat patiënten alle noodzakelijke medicatie in correcte dosering ontvangen. Meer en meer observationele reeksen en expert-opinies geven dan ook de voorkeur om alle geneesmiddelen snel opeenvolgend of zelfs gezamenlijk te starten aan een lagere dosering en deze geleidelijk aan op te titreren. Hiervoor zijn verschillende redenen. Ten eerste weet men dat het initiëren van een nieuwe geneesmiddelklasse een groter voordeel biedt dan het optitreren van een reeds gestarte klasse. Daarnaast geven zelfs de laagste doseringen aanleiding tot een reductie in zowel morbiditeit als mortaliteit. Ten derde is het effect van elke geneesmiddelklasse onafhankelijk van de reeds ingenomen achtergrondtherapie. Als laatste wordt een lage dosis van de verschillende klassen vaak beter getolereerd dan een hoog getitreerd geneesmiddel uit één klasse.
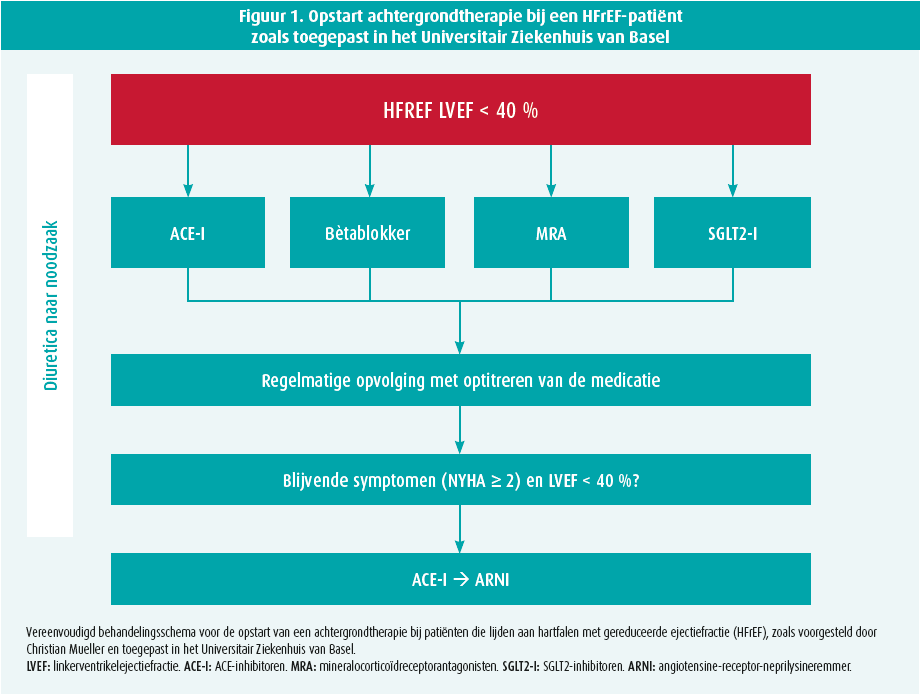
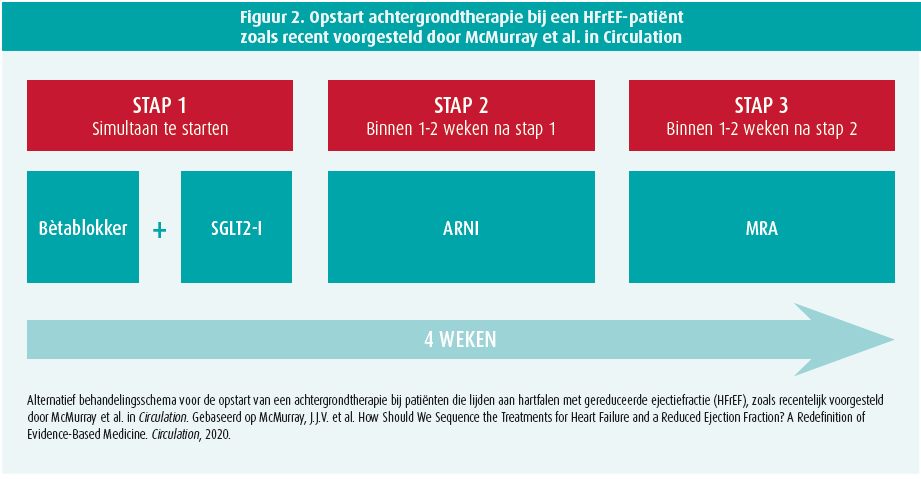
In de sessie toonde Christian Mueller (Universitair Ziekenhuis van Basel, Zwitserland) vervolgens het behandelingsschema dat in het Universitair Ziekenhuis van Basel wordt toegepast (figuur 1). Hierbij initieert men vier geneesmiddelen zo snel als mogelijk bij een nieuwe diagnose van HFrEF, namelijk: een bètablokker, een ACE-inhibitor/sartaan, een mineralocorticoïdereceptorantagonist en een SGLT2-inhibitor. Vervolgens ziet men de patiënt frequent opnieuw om deze geneesmiddelen op te titreren en schakelt men de ACE-inhibitor/sartaan over op ARNI bij de patiënten die symptomatisch blijven ondanks de reeds opgestarte therapie. In een ander voorstel dat recentelijk in Circulation werd gepubliceerd, stelt men voor de vier geneesmiddelklassen binnen de vier weken na diagnose van HFrEF op te starten (figuur 2). Hierbij begint men met een combinatie van een bètablokker en SGLT2-inhibitor, om na 1-2 weken een ACE-I/ARB/ARNI te associëren en als laatste de therapie te vervolledigen met een MRA.12 Uiteraard blijven nog diverse andere farmacologische (bv. ivabradine, hydralazine, vericiguat, ijzer, etc.) en mechanische (bv. CRT, ICD, LVAD, MitraClip, etc.) therapieën beschikbaar voor specifieke patiëntengroepen, maar deze gelden als toevoeging op bovengenoemde achtergrondtherapie. Het blijft bovendien uitkijken naar de positie van bovengenoemde therapieën in de vernieuwde hartfalenrichtlijnen van de European Society of Cardiology. Er wordt alvast verwacht dat de aanbevelingen in lijn zullen liggen met bovengenoemde strategieën.
Terugbetalingscriteria
De grootste beperking op het voorschrijven van SGLT2-inhibitoren in België is tot op heden de beperkte terugbetaling. Deze geneesmiddelen zijn namelijk uitsluitend terugbetaald voor patiënten met type 2 diabetes mellitus met onvoldoende metabole controle onder tenminste één ander antidiabeticum (getuige een HbA1C 7-9 %) en waarbij de berekende renale klaring meer dan 60 ml/min bedraagt. Deze criteria zijn echter dringend aan vernieuwing toe, aangezien zij nog uitsluitend gebaseerd zijn op de studies waarin de SGLT2-inhibitoren werden onderzocht als antidiabeticum. Gezien de huidige evidentie bij patiënten met zowel hartfalen als chronisch nierlijden, wordt verwacht dat de terugbetalingscriteria voor beide groepen verruimd zullen worden. In november 2020 werd dapagliflozine reeds goedgekeurd door de Europese Unie voor het gebruik bij patiënten met HFrEF met of zonder de aanwezigheid van diabetes mellitus type 2. In augustus werd de terugbetaling hiervoor in Zwitserland ook reeds goedgekeurd en zijn de klinische ervaringen tot nu toe zeer goed. Verwacht wordt dat ook hier de terugbetaling voor dapagliflozine in orde zou moeten zijn tegen eind 2021 en dit voor symptomatische HFrEF-patiënten met of zonder diabetes mellitus waarbij de renale klaring minstens 30 ml/min bedraagt.
Optimalisatie en implementatie van hartfalenzorg
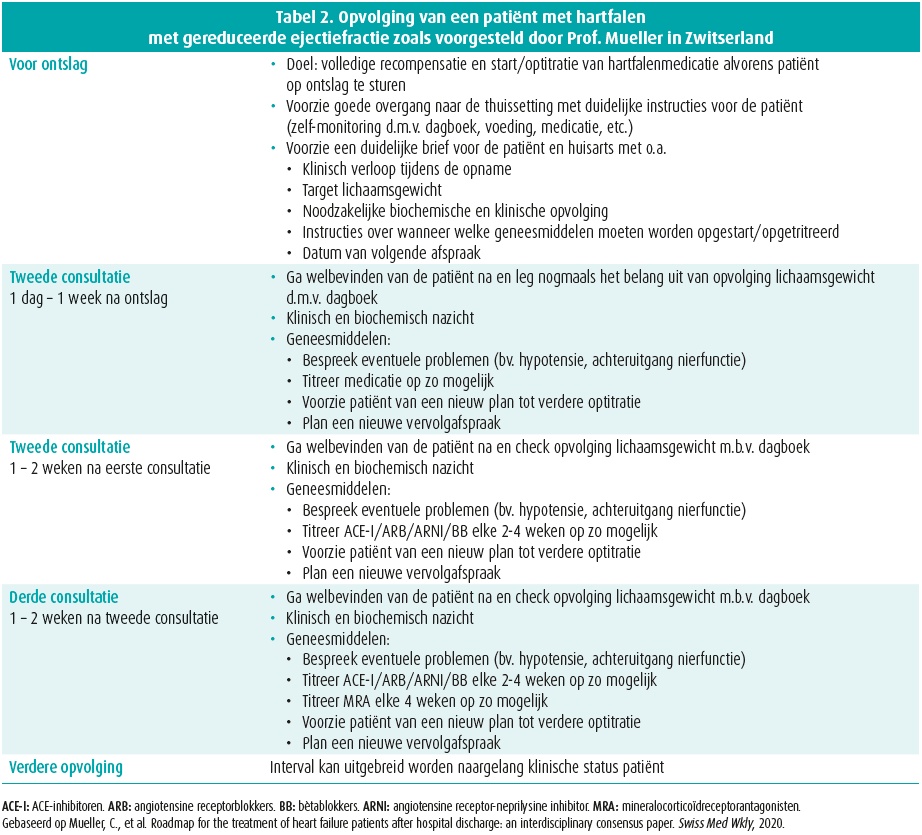
Een optimalisatie en adequate implementatie van hartfalenzorg moet in de toekomst een belangrijk speerpunt vormen. Men ziet namelijk dat het therapeutisch armamentarium waarover de cardioloog beschikt zich uitbreidt, maar toch laat de implementatie ervan vaak nog ruimte over tot verbetering. Zo ziet men dat bijvoorbeeld slechts een derde van de patiënten in Europa recht heeft op een CRT-device, dit ook werkelijk krijgen. Ook blijkt dat in de Europese Unie respectievelijk slechts 22 % en 12 % van de patiënten de aanbevolen dosis ACE-I/ ARB en bètablokkade ontvangen. Er is geen reden om aan te nemen dat deze cijfers anders zouden liggen in ons land. Georganiseerde zorg is dus belangrijk om de therapieën, die hun efficiëntie meermaals hebben bewezen, ook tot bij de patiënt te krijgen. In Zwitserland wordt bijvoorbeeld gehamerd op het belang van de zogenoemde uptitration visits.13 Hierbij worden patiënten frequent op consultatie gezien, waarbij het hoofddoel eruit bestaat de voorgeschreven medicatie gradueel op te titreren in dosis (tabel 2). De verdere oprichting van gespecialiseerde hartfalencentra blijft ook bij ons van belang om elk individu van de correcte therapie te voorzien.
Conclusie
Tot op heden kunnen vijf pathofysiologische signaalcascades geblokkeerd worden met vier geneesmiddelen: de angiotensine- II en neprilysine pathway door middel van ACE-I/ARB/ARNI, de norepinefrine pathway door middel van bètablokkers, de aldosteron pathway door middel van MRA en de SGLT-2 pathway door middel van de SLGT2-inhibitoren. Er is bovendien meer en meer consensus om deze geneesmiddelen allen samen te starten als achtergrondtherapie, en vervolgens op te titreren zo mogelijk. Diuretica worden enkel gegeven om symptomen van congestie te verbeteren en worden steeds gestopt zodra mogelijk. Daarnaast zijn er nog diverse farmacologische (bv. ivabradine, hydralazine, vericiguat, ijzer, etc.) en mechanische (bv. CRT, ICD, LVAD, MitraClip, etc.) therapieen beschikbaar voor specifieke subgroepen. Wat de SGLT2-inhibitoren betreft, wordt terugbetaling voor patiënten met HFrEF verwacht tegen eind 2021. Gezien dit groeiend therapeutisch arsenaal zijn gespecialiseerde hartfalencentra van groot belang om de individuele patiënt van de correcte therapie te voorzien en adequaat op te volgen.
Referenties
- Gilbert, R.E., Krum, H. Heart failure in diabetes: effects of anti-hyperglycaemic drug therapy. The Lancet, 2015, 385 (9982), 2107-2117.
- Wiviott, S.D., Raz, I., Bonaca, M.P. et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med, 2019, 380 (4), 347-357.
- Neal, B., Perkovic, V., Mahaffey, K.W. et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med, 2017, 377 (7), 644-657.
- Zinman, B., Wanner, C., Lachin, J.M. et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med, 2015, 373 (22), 2117-2128.
- Packer, M., Anker, S.D., Butler, J. et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med, 2020, 383 (15), 1413-1424.
- McMurray, J.J.V., Solomon, S.D., Inzucchi, S.E. et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med, 2019, 381 (21), 1995-2008.
- Metra, M., Davison, B., Bettari, L. et al. Is worsening renal function an ominous prognostic sign in patients with acute heart failure? The role of congestion and its interaction with renal function. Circ Heart Fail, 2012, 5 (1), 54-62.
- Damman, K., Beusekamp, J.C., Boorsma, E.M. et al. Randomized, double-blind, placebo-controlled, multicentre pilot study on the effects of empagliflozin on clinical outcomes in patients with acute decompensated heart failure (EMPARESPONSE- AHF). Eur J Heart Fail, 2020, 22 (4), 713-722.
- Perkovic, V., Jardine, M.J., Neal, B. et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med, 2019, 380 (24), 2295-2306.
- Heerspink, H.J.L., Stefánsson, B.V., Correa- Rotter, R. et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med, 2020, 383 (15), 1436-1446.
- Mullens, W., Damman, K., Testani, J.M. et al. Evaluation of kidney function throughout the heart failure trajectory - a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail, 2020, 22 (4), 584-603.
- McMurray, J.J.V., Packer, M. How Should We Sequence the Treatments for Heart Failure and a Reduced Ejection Fraction? A Redefinition of Evidence-Based Medicine. Circulation, 2020. [nog te publiceren].
- Mueller, C., Bally, K., Buser, M. et al. Roadmap for the treatment of heart failure patients after hospital discharge: an interdisciplinary consensus paper. Swiss Med Wkly, 2020, 150, 20159.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.