Verslag EACVI-webinar
Achtergrond
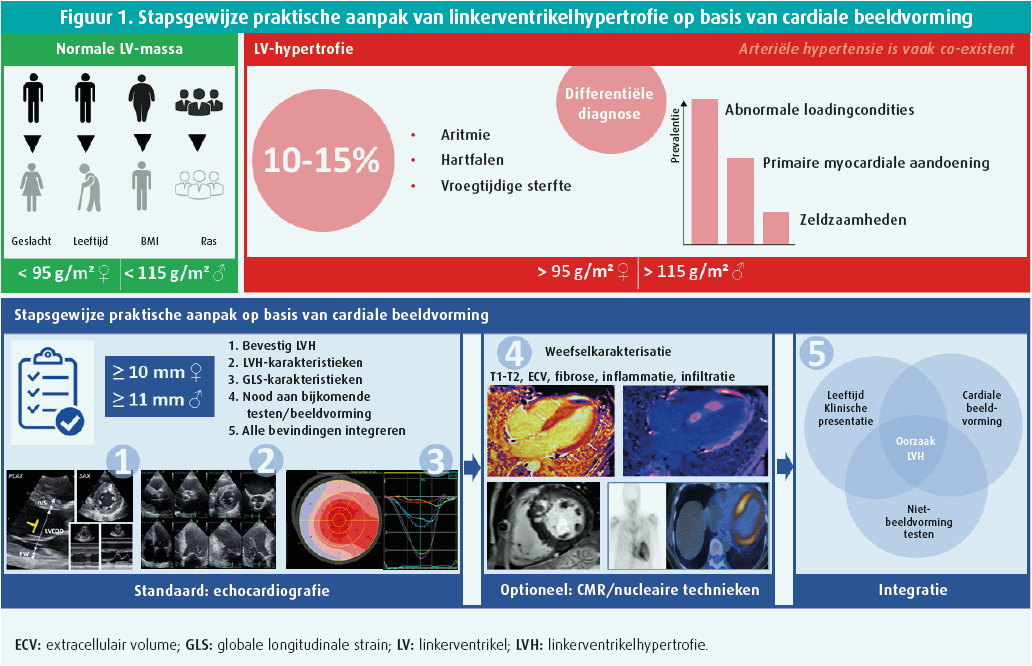
De myocardmassa van het linkerventrikel bij gezonde personen kent vier belangrijke determinanten: geslacht, leeftijd, gewicht en etniciteit. Een relatief grotere linkerventrikelmassa wordt immers genoteerd bij mannen, op jongere leeftijd, met hoger lichaamsgewicht en bij zwart ras. Linkerventrikelhypertrofie (LVH) omvat echter een abnormaal verhoogde linker ventriculaire massa ten gevolge van een primaire myocardiale aandoening of secundair aan abnormale loadingcondities (druk en/of volumeoverbelasting). Deze afwijking komt wereldwijd voor bij 10 tot 15 % van de bevolking en neemt toe met stijgende leeftijd, vaak door accumulatie van comorbiditeiten. LVH is intrinsiek gelinkt aan een verhoogd risico op ritmestoornissen, hartfalen en vroegtijdig overlijden. Een correcte diagnose en causaal gerichte behandeling zijn dan ook van groot belang.
De differentiële diagnose van LVH is uitgebreid (figuur 1), maar twee vaststellingen geven al een eerste praktische aanzet. Ten eerste: wat frequent is, is frequent. De meerderheid van LVHgevallen wordt verklaard door abnormale loadingcondities (druk en/of volume). Hypertensie, obesitas, type 2-diabetes, hartklepstenose of lekkage en atletenhart staan daarom bovenaan de differentiële diagnoselijst. Zo niet, denken we aan primaire cardiale aandoeningen waarbij primaire hypertrofe cardiomyopathie (HCM), infiltratieve amyloïd cardiomyopathie en inflammatoire myocardaandoeningen de lijst aanvoeren. Bij exclusie kan in functie van vooral leeftijd en het klinische (eventueel syndromaal) beeld aan meer uitzonderlijke metabole, neuromusculaire of mitochondriale aandoeningen gedacht worden, dan wel maligniteit, medicatietoxiciteit of malformatiesyndromen. Ten tweede: systeem arteriële hypertensie is een frequente comorbiditeit. Hypertensie kent een sterke leeftijd-afhankelijke prevalentie, voorkomend bij zelfs meer dan 60 % van de 60-plussers. Dit impliceert dat hypertensie vaak co-existent aanwezig is maar niet steeds de hypertrofie verklaart. Zeker bij disproportionele matig tot belangrijke hypertrofie ten opzichte van vaak slechts graad 1 of 2 hypertensie, is waakzaamheid geboden; een belangrijke valkuil in de routine-praktijk.
Praktische aanpak stapsgewijs
Echocardiografie is de eerstelijnsbeeldvormingsmethode voor de diagnose alsook voor de differentiële diagnose van LVH en kan, waar nodig, worden aangevuld met additionele beeldvorming of andere testen. Een praktische benadering omvat stapsgewijs te werk gaan (figuur 1).
Stap 1: Bevestiging linkerventrikelhypertrofie
Standaard wordt de linkerventrikelwanddikte (in mm) gemeten op basis van een 2-dimensionele B-modebeeld in de parasternale lange en de korte as. Het interventrikelseptum (IVS) en de posterior wand (PW) worden gemeten loodrecht op de as van het linkerventrikel op het niveau van de tippen van de mitralisklepbladen. Op het beeld van de korte as (basaal, mid en apicaal) bevestigen we eventueel afwijkende waarden en zoeken we vooral naar bijkomende hypertrofie, niet zichtbaar in de parasternaal lange as. Hypertrofie kan immers voorkomen in een beperkt aantal segmenten, niet zichtbaar op de lange as. Een wanddikte van ≥ 10 mm bij vrouwen en ≥ 11 mm bij mannen wordt gedefinieerd als hypertrofie.1 Voor de bepaling van milde, matige en ernstige LVH bestaan verschillende afkapwaarden bij vrouwen versus mannen. Vaak wordt echter de wanddikte echografisch overschat door inclusie van rechterkamermoderatorband, linkerventrikel papillaire spieren, trabekels of additionele spierbruggen. Hierdoor dreigt foutieve (over)diagnose van LVH.
Bovendien kan ook de linkerventrikelmassa (in g/m²) worden geschat, onder andere door gebruik van de lineaire Cube-formule op basis van linkerventrikel eind-diastolische diameter, PW- en IVS-dikte. Deze heeft een behoorlijke foutenmarge aangezien deze parameters tot de derde macht worden verheven en zijn niet accuraat bij gedilateerde of asymmetrisch hypertrofe ventrikels. 2- of 3-dimensionele metingen benaderen beter de reële massa, maar zijn echografisch minder gevalideerd. Een linkerventrikelmassa van > 95 g/m² bij vrouwen en > 115 g/m² bij mannen geldt als LVH.1
Gebruik van cardiale magneetresonantie (CMR) kan bij gerichte vraagstelling een meerwaarde betekenen in de diagnose van LVH. Ten eerste draagt de hogere spatiale resolutie bij tot een correctere afmeting van de wanddikte (minder over- of onderschatting). Ten tweede kunnen alle ventrikelzones in beeld gebracht worden; gelokaliseerde LVH ter hoogte van rechterkamer en linkerkamer inferior wand bijvoorbeeld wordt immers vaak gemist op echocardiografie. Tot slot geldt CMR als de gouden standaard voor evaluatie van de linkerventrikelmassa.
Stap 2: Karakteristieken van linkerventrikelhypertrofie
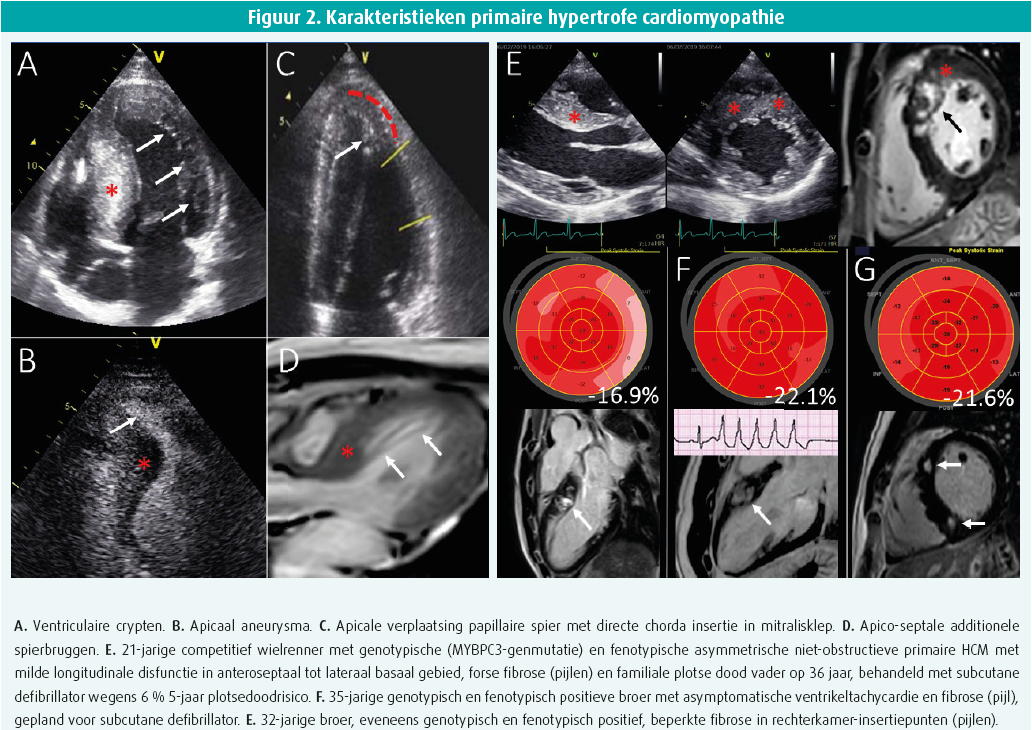
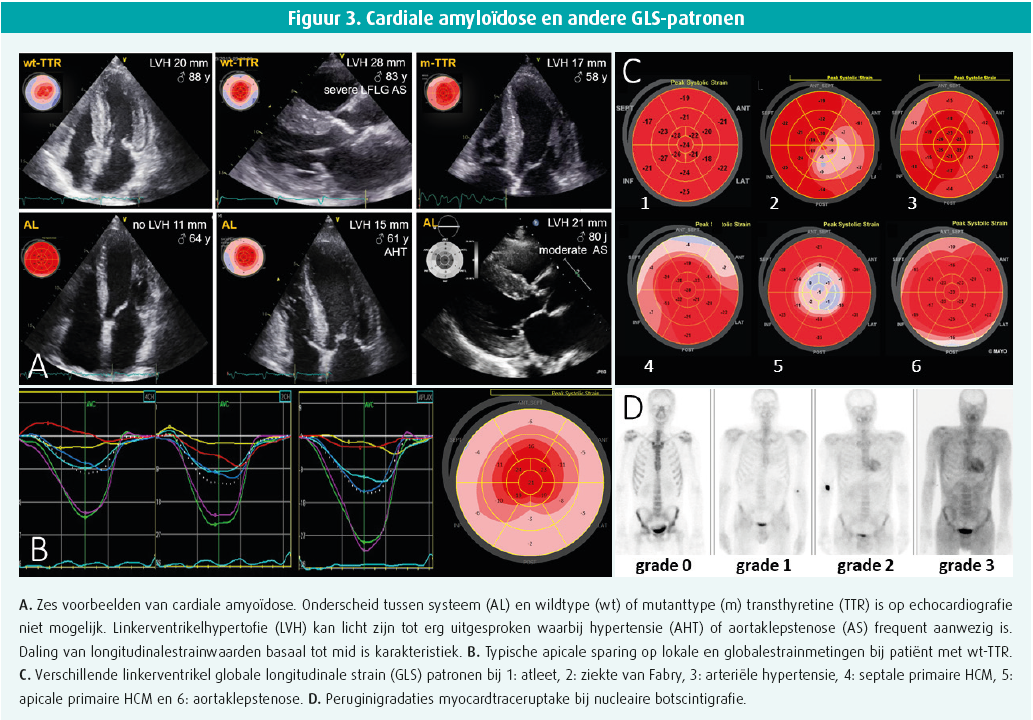
Eens met zekerheid de diagnose LVH bevestigd werd, verleggen we de focus naar differentiële diagnostiek van de onderliggende oorzaak. In stap 2 focussen we op structurele afwijkingen, voornamelijk de ernst, uitgebreidheid, locatie en symmetrie van de LVH, alsook eventueel meer oorzaakspecifieke structurele afwijkingen. Druk-overbelasting zoals hypertensie of aortaklepstenose start vaak met hypertrofie in het basaal septum, door lokale maximale wandspanning, om te evolueren naar een meer concentrische, symmetrische hypertrofie van het gehele linkerventrikel. Ook diabetes, obesitas en atletenhart leiden meestal tot een eerder symmetrische kamerhypertrofie. Bij atletenhart is symmetrie het codewoord: een symmetrische structurele en functionele remodellering zowel rechts als links zijn de regel, waarbij de fitheid geenszins als in/exclusie kan gehanteerd worden om te differentiëren met pathologie. Een wanddikte tussen 12-16 mm komt slechts voor bij 2-3 % van de blanke atleten en tot 8 % van de zwarte atleten, maar diktes > 16 mm zijn steeds pathologisch.2 Primaire hypertrofe cardiomyopathie (HCM), voorkomend in 1:500, omvat in de overgrote meerderheid een asymmetrische lichte tot ernstige hypertrofie die beperkt is tot 1-2 segmenten (12 %), 3-7 segmenten (34 %) of ≥ 8 segmenten (54 %).3 Bovendien zijn minstens het anteroseptale en anterior segment betrokken in 75 % van de gevallen en kan simultane rechterkamerhypertrofie worden gezien in 30 %. Bij deze onderliggende sarcomeeraandoening letten we bovendien op bijkomende structurele hints, zoals elongatie van de mitralisklepbladen (30 %), papillairespierafwijkingen zoals apico-mediale verplaatsing (75 %), additionele papillaire spieren (50 %) of directe insertie van de chordae in de klepblaadjes of zelfs uitstroombaan. Zelfs myocardcrypten, apicale aneurysmata en additionele apicoseptale spierbundels kunnen zich voordoen (figuur 2). Dergelijke afwijkingen worden soms duidelijker gedetecteerd bij CMR. Infiltratieve myopathieën komen meestal voor als symmetrische en vaak biventriculaire hypertrofie, hoewel asymmetrische hypertrofie zelfs met uitstroombaanobstructie niet zeldzaam is. Bij een nieuwe veronderstelde diagnose van primaire HCM bij 60-plussers, moet dus ook aan infiltratieve myopathie worden gedacht. De hypertrofie kan mild tot erg uitgesproken zijn, maar karakterisatie tussen systeem-AL of transthyretineamyloïdose is op basis van echocardiografie (of andere beeldvorming) niet mogelijk (figuur 3). Cardiale transthyretineamyloïdose is zeker niet onfrequent en wordt vaak gezien in combinatie met aortaklepstenose bij 6 % van heelkundige aortaklepingrepen, 15 % van de percutane aortaklepvervangingen en tot wel 30 % bij low-flow low-gradiënt aortaklepstenose.
Stap 3: Karakteristieken van globale longitudinale strain
Na de structurele karakterisatie volgt de volgende stap waar de aandacht wordt gevestigd op functionele afwijkingen. Longitudinale systolische strain geeft het percentage spiervezelverkorting weer in longitudinale richting tijdens systole, hoofdzakelijk bepaald door de subendocardiale laag van myocardvezels in het linkerventrikel. Deze kan makkelijk praktisch bepaald worden door toepassing van 2-dimensionele speckletrackingtechniek op een 2-, 3- en 4-kamerbeeld tijdens echocardiografie. De gemiddelde waarde van alle 17 myocardsegmenten wordt globale longitudinale strain (GLS) genoemd en wordt kleurgecodeerd weergegeven in een 17-segmenten bull's eye plot, waarbij de individuele waarden van de segmenten eveneens worden gevisualiseerd (figuur 3). Er bestaat een normale gradiënt met hogere waarden van apex versus mid versus basis. Een normale GLS-waarde van het linkerventrikel bedraagt ongeveer -20 %. Meer negatieve waarden duiden op meer verkorting en dus betere functie. Linkerventrikel GLS is een uiterst sensitieve maat voor kamerfunctie, die vaak vermindert lang voor ejectiefractiedaling zich voordoet, en steevast correleert met klinisch relevante eindpunten. In de praktijk evalueren we de globale GLS-waarde, het patroon van de bull's eye plots en de gelokaliseerde strainwaarden van de hypertrofe segmenten.
De globale GLS-waarde ten eerste wordt uiteraard bepaald door het ziektestadium, duur van de pathologie alsook de ernst van de hypertrofie. De belangrijkste determinanten van GLS zijn immers 1) intrinsieke myocardcontractiliteit, 2) loading (druk of volume), 3) geometrie (hypertrofie en dilatatie) alsook 4) weefselkarakteristieken waaronder lokale of diffuse fibrose. Hypertensie, diabetes en obesitas geven meestal een licht tot matig gedaalde GLS-waarde. Atleten hebben een normale tot licht gedaalde waarde in rust, maar evolueren naar normale tot supranormale waarden bij inspanning (contractiele reserve). Aortaklepstenose kan gepaard gaan met lichte, matige tot ernstige daling in functie van ernst en duur van de klepvernauwing. Bij primaire HCM hangt de globale GLS-waarde vaak af van het aantal en de graad van hypertrofe segmenten, en de myocardfibrose. Bij cardiale amyloïdose treffen we vaak matige tot ernstige globale GLS-daling aan.4
Het GLS-patroon en de lokale strainwaarden (per myocardsegment) bewijzen in de praktijk vaak nuttig te zijn (figuur 3).
Bij hypertensie en aortaklepstenose valt meestal een licht tot matige daling in de basaal septale segmenten op, waar zich de grootste wandspanning voordoet. Bij primaire HCM zijn de lokale strainwaarden vaak matig tot ernstig gedaald, typisch in de meest hypertrofe segmenten.4 Aangezien fibrose zich vaak initieel lokaal ontwikkelt in de posterolaterale regio bij de ziekte van Fabry, wordt daar een lokale straindaling opgetekend. Bij infiltratieve cardiomyopathie zoals amyloïdose zien we vaak een karakteristiek beeld van apical sparing: behoud van strainwaarde in de apicale regio, maar een matige tot zeer ernstige daling in de mid- en basissegmenten.4 Dergelijk beeld kan soms ook gezien worden bij de ziekte van Danon of ernstige aortaklepstenose, maar vergt steeds exclusie van amyloïdose.
Naast de GLS-evaluatie kunnen zich ook andere functionele afwijkingen voordoen. Systolic anterior movement (SAM) beschrijft de typische systolische beweging van het (eventueel verlengde) anterior mitralisklepblad naar het septum, wat kan bijdragen tot opbouw van een drukgradiënt of uitstroombaanobstructie, al dan niet met functionele mitraliskleplekkage. Uitstroombaanobstructie komt voor bij 70 % van de primaire HCM-patiënten, ongeveer 40 % in rust en nog eens 30 % bij inspanning, best uitlokbaar door inspanningsechocardiografie eerder dan door een valsalvatest.5 Belangrijke septale hypertrofie, zoals gezien wordt bij hypertensie, aortaklepstenose en zelfs infiltratieve cardiomyopathie kan echter ook soms uitstroombaanobstructie en/of SAM genereren.
Stap 4: Weefselkarakterisatie en andere testen
Bij twijfel of nood aan bevestiging van de vermoedelijke LVH-oorzaak, kan additionele cardiale beeldvorming aangewezen zijn. CMR biedt hier een praktische meerwaarde ten opzichte van echocardiografie door de mogelijkheid tot verdere weefselkarakterisatie door specifieke beeldvormingsequenties. Een viertal parameters zijn van belang.6 (figuur 4) 1) T2 gewogen beelden (T2-tijdsconstante die verval van transversale magnetisatie weergeeft) laten identificatie toe van intra- of extracellulair myocardiaal oedeem, aangezien aanwezigheid van water in weefsel de T2-relaxatietijd verlengt met een signaalintensiteit evenredig met waterinhoud. Lokale T2-alteraties kunnen worden gevisualiseerd, maar ook globale, op basis van kleurgecodeerde parametrische T2-mapping. Bijvoorbeeld bij hypertrofie door inflammatoire aandoeningen zoals myocarditis of sarcoïdosis zal de T2-tijd toenemen. 2) Natieve T1 gewogen beelden (T1-tijdsconstante die herstel van longitudinale magnetisatie weergeeft) worden bepaald zonder contrasttoediening (natief), een groot voordeel. T1-relaxatietijd is weefselspecifiek en wijzigt volgens de moleculaire weefselinhoud en wordt dus sterk beïnvloed door myocardaandoeningen zoals fibrose, inflammatie, oedeem en infiltratieve pathologie, waarbij het bijgevolg helpt in de differentiële diagnose. Ook natieve T1-mapping kan worden uitgevoerd met normaalwaarden in functie van lokale magneetsterkte (Tesla) en pulssequentieparameters. 3) Extracellulairvolumemeting (ECV) geschiedt op basis van vergelijking T1-relaxatiewaarden pre en post contrasttoediening tussen myocardium en linkerventrikelbloedpool, gecorrigeerd voor hematocriet (normaalwaarde tot 25 %). Het extracellulaire compartiment omvat vloeistof, collageen, elastine, fibrillen en glycoprotëinen. Expansie van het extracellulair compartiment is vaak veroorzaakt door en dus een maat voor diffuze fibrose, hoewel bijvoorbeeld ook infiltratieve pathologie karakteristiek forse ECV-stijging kan geven. 4) Tot slot is late gadolinium enhancement (LGE) een techniek waarbij extracellulaire gadolinium contraststapeling wordt gevisualiseerd een 10-tal minuten na contrasttoediening. Verhoogde signaalintensiteit wijst op aanwezigheid van lokale extracellulaire compartimentexpansie, meestal een maat voor focale fibrose. Men onderscheidt ischemische (subendocardiaal en in coronair perfusiegebied) en niet-ischemische LGE-patronen (epicardiaal, mid-wall of transmuraal, lokaal, diffuus of vlekkerig). Hoewel geen enkel patroon echt specifiek is, wordt soms een gehele subendocardiale fibrose ring gezien, uiterst suspect voor cardiale amyloïdose. Bij ziekte van Fabry start de lokale fibrose vaak mid-wall tot subepicardiaal in de inferolaterale wand.
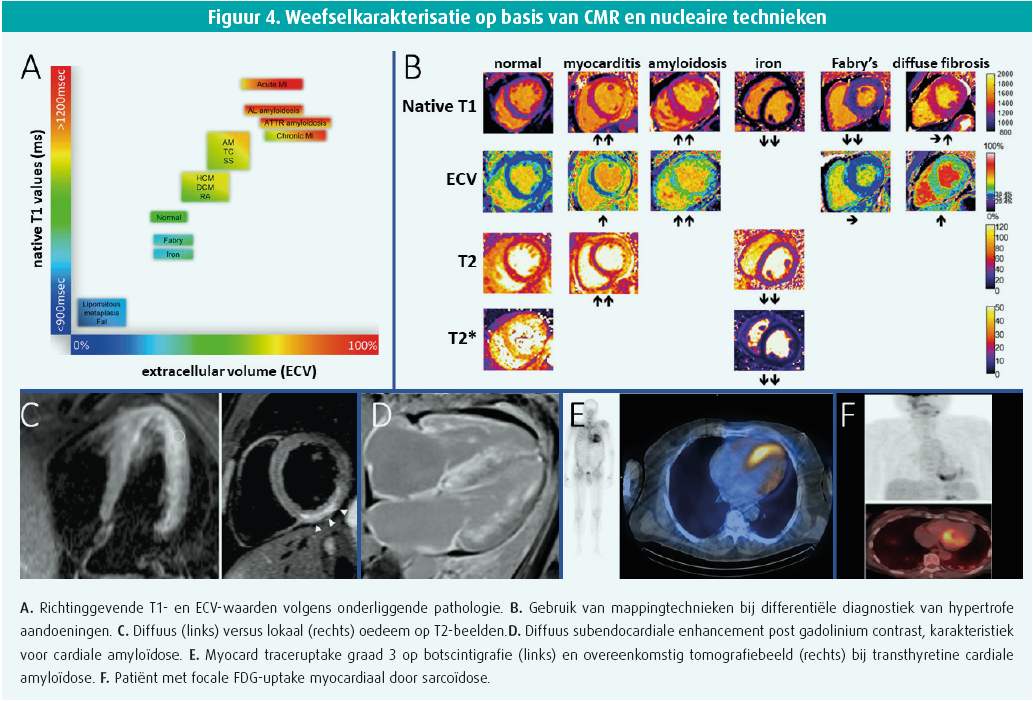
Nucleaire technieken tot slot kunnen tot op zekere hoogte ook weefselkarakterisatie weergeven. Vooral het gebruik van botscintigrafie met tomografie (SPECT) wordt ingezet bij verdenking op amyloïdose (figuur 3). Myocardtraceropname is immers pathologisch en wordt gelinkt aan calciumhoudende chaperone-eiwitten binnen de amyloïdfibrillen die neerslaan. In vergelijking met omliggende skeletweefsel kan er in het myocard geen (Peruginigraad 0), minder (graad 1), gelijk (graad 2) of meer (graad 3) traceruptake zijn. Belangrijk: de combinatie van graad 2 of 3 myocard traceruptake met exclusie van monoklonaliteit op bloed en urine is quasi 100 % specifiek voor transthyretineamyloïdose, gelijkwaardig aan biopsie. Afwezigheid van myocard traceruptake sluit evenwel amyloïd nooit uit. Bij aanwezigheid van monoklonaliteit en/of graad 1 uptake is verdere beeldvorming en/of biopsie aangewezen om met zekerheid systeem AL cardiale amyloïdose uit te sluiten.
Tot slot kan fluorodeoxyglucose positron emissie tomografie (FDG-PET), eventueel in combinatie met CT-scan, worden ingezet bij verdenking op hypertrofe aandoeningen veroorzaakt door bijvoorbeeld myocarditis, sarcoïdosis of maligniteit. Correcte dieetvoorbereiding is essentieel om fysiologische FDG-opname in het myocard te onderdrukken. FDG-opname myocardiaal zal zich dan immers vooral voordoen ter hoogte van zones met verhoogd glucosemetabolisme zoals maligniteit, inflammatie of infectie.
Stap 5: Integratie van alle bevindingen
Bij de finale stap pogen we de vastgestelde structurele en/of functionele afwijkingen op cardiale beeldvorming (echocardiografie, CMR, nucleair) te integreren met vooral het klinisch vignet, eventueel aangevuld met gerichte niet-beeldvormingstesten. Zo zal de leeftijd, familiale historiek en de klinische presentatie van de patiënt vaak doorslaggevend zijn in de differentiële diagnose. Specifieke systeemanamnese naar bijvoorbeeld neurologische, musculoskeletale, mentale, autonome of andere afwijkingen is dan ook essentieel. De ziekte van Danon is bijvoorbeeld meer waarschijnlijk op adolescentenleeftijd. Infiltratieve, metabole of inflammatoire cardiomyopathieën zijn meestal systeemaandoeningen. Transthyretine cardiale amyloïdose gaat bijvoorbeeld vaak gepaard met een historiek van carpaletunnelsyndroom en/of spinale kanaalstenose. Aanvullende niet-beeldvormingstesten zoals rust-ecg, neuromusculaire functionele testen en eventueel gericht aanvullend biochemisch, genetisch of histologisch onderzoek kunnen de puzzel vervolledigen om een finale diagnose te stellen.
Referenties
- Lang, R.M., Badano, L.P., Mor-Avi, V., Afilalo, J., Armstrong, A., Ernande, L. et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging, 2015, 16, 233-70.
- Basavarajaiah, S., Wilson, M., Whyte, G., Shah, A., McKenna, W., Sharma, S. Prevalence of hypertrophic cardiomyopathy in highly trained athletes: relevance to preparticipation screening. J Am Coll Cardiol, 2008, 51, 1033-1039.
- Maron, M.S., Maron, B.J., Harrigan, C., Buros, J., Gibson, C.M., Olivotto, I. et al. Hypertrophic cardiomyopathy phenotype revisited after 50 years with cardiovascular magnetic resonance. J Am Coll Cardiol, 2009, 54, 220-228.
- Cikes, M., Sutherland, G.R., Anderson, L.J., Bijnens, B.H. et al. The role of echocardiographic deformation imaging in hypertrophic myopathies. Nat Rev Cardiol, 2010, 7, 384-396.
- Maron, M.S., Olivotto, I., Zenovich, A.G., Link, M.S., Pandian, N.G., Kuvin, J.T. et al. Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outflow tract obstruction. Circulation, 2006, 114, 2232-2239.
- Messroghli, D.R., Moon, J.C., Ferreira, V.M., Grosse-Wortmann, L., He, T., Kellman, P. et al. Clinical recommendations for cardiovascular magnetic resonance mapping of T1, T2, T2* and extracellular volume: A consensus statement by the Society for Cardiovascular Magnetic Resonance (SCMR) endorsed by the European Association for Cardiovascular Imaging (EACVI). J Cardiovasc Magn Reson, 2017, 19, 75.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.